
- •Тема 3 (лекции 9-17): Молекулярная физика. Термодинамика.
- •2.Модель идеального газа
- •3. Строение вещества. Жидкость, кристаллическая решётка
- •4. Молярная масса. Число Авогадро
- •5. Основное уравнение мкт идеальных газов. Физический смысл давления и температуры
- •17. Цикл Карно
- •18. Реальные газы. Уравнение Ван-дер-Ваальса.
- •19. Изотермы Ван-дер-Ваальса. Метастабильные состояние
- •20. Фазовые переходы
- •21. Формула Клапейрона-Клаузиуса
- •2. Средняя длина свободного пробела молекулы газа
Тема 3 (лекции 9-17): Молекулярная физика. Термодинамика.
План:
1.Основные понятия статистики и термодинамики.
2.Модель идеального газа.
3.Строение вещества. Жидкость, кристаллическая решётка.
4. Молярная масса. Число Авогадро.
5. Основное уравнение МКТ идеальных газов. Физический смысл давления и температуры.
6. Уравнение Менделеева-Клапейрона.
7. Изопроцессы в идеальном газе.
8. Закон равномерного распределения энергии по степеням свободы.
9. Внутренняя энергия идеального газа.
10. Газ в потенциальном поле. Распределение Больцмана. Барометрическая формула.
11. Распределение Максвелла по скоростям.
12. Механическая работа в тепловых процессах.
13. Первое начало термодинамики.
14. Теплоёмкость. Теплоёмкость при постоянном давлении. Теплоёмкость при постоянном объёме. Уравнение Майера.
15. Работа в адиабатическом процессе. Уравнение Пуассона.
16. Энтропия, её статистический смысл. Второе начало термодинамики.
17. Цикл Карно.
18. Реальные газы. Уравнение Ван-дер-Ваальса.
19. Изотермы Ван-дер-Ваальса. Метастабильные состояние.
20. Фазовые переходы.
21. Формула Клапейрона-Клаузиуса.
22. Фазовые диаграммы. Тройная точка.
23. Тепловое расширение кристаллов.
24. Явления на границе раздела фаз.
25 Явление переноса в сплошных средах.
1.Основные понятия статистики и термодинамики.
Молекулярная физикаизучает строение и свойства вещества, исходя из молекулярного строения тела.Процессы в молекулярной физике определяются совокупным действием большого числа молекул. Используются методы статистической физики.
Термодинамика – раздел физики, изучающий свойства макроскопических систем, находящихся в термодинамическом равновесии.
Термодинамические параметры:
Температура:
Термодинамическая шкала T,K
Реперная точка – 273,16 К – температура тройной точки воды (лёд, вода, находятся в термодинамическом равновесии при p=609 Па).
Международная практическая шкала t,0C
Две реперные точки – 0 0С; 1000С, при 1,013∙105Па
T=273,15+t
При 105Па = 1 атм.
Давление:
![]()
![]()
Закон Паскаля:
Газы, как и жидкости, передают давление одинаково во все стороны.
Удельный объем:
![]() ;
;
![]()
2.Модель идеального газа
Потенциальная энергия межмолекулярного взаимодействия:
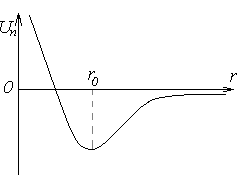
Модель идеального газа– достаточно нагретый и разрежённый газ, который можно представить в виде хаотически двигающихся маленьких твёрдых шариков.Собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда.Между молекулами газа отсутствуют силы взаимодействия.Столкновения молекул газа между собой и стенками сосуда – абсолютно упругие.
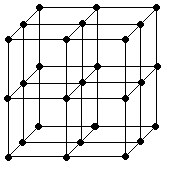
3. Строение вещества. Жидкость, кристаллическая решётка
Жидкость менее сжимаема, чем газ.
Кристаллическая решётка:
4. Молярная масса. Число Авогадро
Задача термодинамики: установление зависимости между термодинамическими параметрами.
f![]() – уравнение состояния данного тела
– уравнение состояния данного тела
![]() –изотермический
процесс (Бойль-Мариотт)
–изотермический
процесс (Бойль-Мариотт)
![]() –изохорный
процесс (Гей-Люссак)
–изохорный
процесс (Гей-Люссак)
![]() –изобарный
процесс (Гей-Люссак)
–изобарный
процесс (Гей-Люссак)
Задача молекулярной физики: установить результат взаимодействия большого числа молекул.
Моль – количество
вещества, содержащее число Авогадро NA
равная![]()
![]()
![]()
![]()
Масса одного моля данного вещества называется молярной массой. Для атомарного вещества она равна приводимой в таблице Менделеева, выражаемой в граммах.
Для молекулярных веществ масса одного моля определяется суммой масс образующих молекулу атомов.
