
- •Моногалогенопроизводные
- •I. Моногалогенопроизводные, галоидные алкилы.
- •Методы получения
- •1. Реакции нуклеофильного замещения атома галогена (Hal)
- •Характеристика связей углерод-галоген
- •II. Реакции элиминировании (е) (отщепления) в ряду моногалогенозамещенных.
- •III. Реакции моногалогенопроизводных с металлами
- •3. Получение литийорганических соединений.
- •Алкенилгалогениды
- •Одноатомные спирты (алканолы)
- •II. Спирты – основания и нуклеофилы
- •1. Проявление оснόвных свойств
- •2. Проявление нуклеофильных свойств
- •III. Реакции замещения он-группы
- •2. Реакции замещения он группы на галоген.
- •IV. Внутримолекулярная дегидратация
- •V. Окисление и дегидрирование спиртов
- •Многоатомные спирты
- •Методы получения
- •2.Образование сложных эфиров
- •3. Реакция замещения он-группы на галоген
- •5. Периодатное окисление
- •Простые эфиры
- •II. Нуклеофильные свойства
Моногалогенопроизводные
I. Моногалогенопроизводные, галоидные алкилы.
Классификация: по типу атома углерода при галогене.
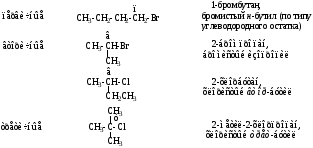
Методы получения
1. Бромирование и хлорирование алканов на свету или при нагревании.
2. Гидрогалоидирование алкенов в ССl4.
Реакционная способность
Основные реакционные центры галогенопроизводных указаны на схеме:
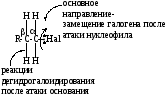
1. Реакции нуклеофильного замещения атома галогена (Hal)
В этих реакциях в результате гетеролитического разрыва связи С-Hal происходит замещение галогена на другие атомы или группы. Реагентами будут молекулы, являющиеся нуклеофилами, или соединения, способные генерировать нуклеофил.
Нуклеофил – это анион или молекула, имеющая элементы с НПЭ, способные атаковать электронодефицитную часть молекулы.
Примеры реакций
Нуклеофил
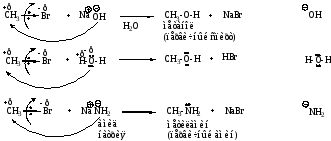
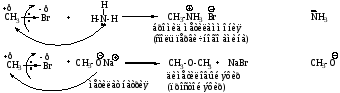
Описанные реакции относятся к реакциям нуклеофильного замещения. Скорость реакций зависит от реакционной способности галогенопроизводного.
Реакционная способность моногалогенопроизводных:
RI> RBr >RCl> RF
Ряд соответствует изменению величин энергии и длин связей С-Hal (с учетом размера атома Hal и величины его электроотрицательности).
Характеристика связей углерод-галоген
|
Тип связи |
Длина связи, нм |
Энергия связи, кДж/моль |
Электроотрицательность (ЭО) элементов (по Полингу) |
|
С-F C-Cl C-Br C-I |
0,140 0,176 0,194 0,213 |
485 339 285 213 |
4,0 3,5 2,8 2,6 |
В соответствии с приведёнными характеристиками иодиды являются наиболее реакционноспособными соединениями в реакциях нуклеофильного замещения.
Для описания реакций используют два механизма – SN1 и SN2. Тип механизма зависит от строения углеводородного радикала в галогенопроизводном. Для первичных галогегидов, имеющих неразветвленный углеводородный остаток, реализуется механизм SN2, для третичных - SN1, в случае вторичных галогенидов возможен смешанный механизм.
|
SN2 |
Реакция описывается как бимолекулярная, т.е. скорость реакции зависит от концентрации субстрата – S (моногалогенопроизводное) и реагента Nu (нуклеофил). В стадии, определяющей скорость реакции, образуется переходное состояние, в котором участвуют молекула S и молекула или анион реагента.
Пример реакции
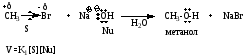
Механизм реакции описывается как переходное состояние, образующееся при столкновении субстрата (S) и нуклеофила (Nu). Характер связей в переходном состоянии является промежуточным: связь C-Hal находится в стадии разрыхления, а новая связь C-Nu только образуется. В переходном состоянии атакуемый атом углерода при галогене является пятикоординационным и становится практически плоским.
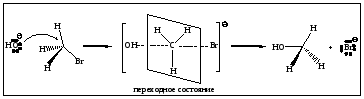
Роль пространственного фактора в механизме SN2 является решающей. Реализация переходного состояния зависит от объема алкильного заместителя в субстрате. Чем больше объем (разветвленность) алкильной группы S, тем труднее реализуется переходное состояние. По механизму SN2 реагируют, преимущественно, первичные галогенопроизводные.
|
SN1 |
Реакция является мономолекулярной, т.е. скорость реакции зависит от концентрации только субстрата. Лимитирующей стадией реакции является диссоциация моногалогенопроизводного за счет диполь-дипольного взаимодействия с молекулами растворителя и образование устойчивого третичного карбкатиона. Далее происходит атака реагента (нуклеофила) на карбкатион, поэтому механизм имеет две стадии.
Пример реакции
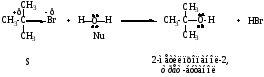
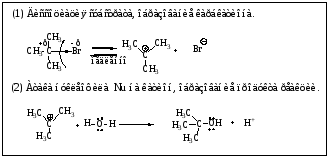
Необходимым условием для реализации механизма SN1 является образование стабильного карбкатиона, главную роль в стабильности играет электронный фактор (чем больше электронодонорных алкильных групп в катионе, тем он устойчивее). Поскольку наибольшей стабильностью обладают третичные карбкатионы, по механизму SN1 реагируют, главным образом, третичные галогенопроизводные.
