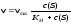Khimia_testy
.docx
Министерство здравоохранения Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
ПЕРВЫЙ МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ имени И.М.СЕЧЕНОВА
Утверждено Учебно-методический совет
_________________________________________
«______»_____________________20____ протокол № ______________________
Фонд оценочных средств
по ________________ХИМИЯ____________________________
(наименование дисциплины/ практики, либо – раздела дисциплины/ практики)
основная профессиональная образовательная программа высшего образования - программа бакалавриата/ специалитета/ магистратуры/ ординатуры/ аспирантуры
__________________________________специалитет_________________________________
указывается код и наименование укрупненной группы специальностей (направлений подготовки)
_____Лечебное дело__Педиатрия__Стоматология _
указывается код и наименование направления подготовки (специальности)
Председатель УМС ___________________ __________________
(подпись) (инициалы, фамилия)
Вид оценочного средства: Тестовые задания:
|
Оценочное средство |
|
|
Вопрос 1. 1. Молярная концентрация эквивалента кислоты в растворе равна 0,2 моль/л. Рассчитайте ее молярную концентрацию в растворе, определив фактор эквивалентности по реакции: Н3РО4+Na ОН → Na2НРО4 + Н2О А) 0,2 б) 0,1 в) 0,4 г) 0,5 д) 1. |
|
|
2. Чему равна масса гидроксида натрия (в граммах), если на титрование затрачено15,1 мл соляной кислоты с с(НСL)=0,103 моль/л. а) 4,12 б) 62,2 в) 0,062 г) 0,412 д) 0,62 |
|
|
3. Чему равен фактор эквивалентности йода в реакции: I2 + 2Na2S2O3→ 2NaI + Na2S2O4 А) 1; б) 1/2; в) 1/3; г) 1/4 ; д) 1/5 |
|
|
4.Сульфат железа (Ш) массой 10,0 мг растворили в 2,5 мл воды. Рассчитайте молярную концентрацию эквивалента соли для реакции полного обмена ионов железа(Ш). А) 0,01 б) 0,02 в) 0,04 г) 0,06 д) 0,10 |
|
|
5. Какой объем раствора азотной кислоты с с=0,065 моль/л необходимо затратить на титрование гидроксида лития массой 0,1 г? А) 3,21 мл б) 0,16 мл в) 0,6 л г) 0,064 л д) 0,15 л |
|
|
6. Укажите, какое вещество используется в качестве титранта в ацидиметрическом титровании: А) перманганат калия; б) гидроксид калия; в) соляная кислота; г) метилоранж. |
|
|
7.Рассчитайте молярную массу эквивалента фосфорной кислоты в реакции полного обмена протонов. А) 24,5 б) 32,67 в) 98 г) 49 д) 65,34 |
|
|
8.Молярная концентрация эквивалента серной кислоты в растворе равна 0,02 моль/л. Рассчитайте ее молярную концентрацию в растворе, учитывая фактор эквивалентности по реакции H2SO4+Na2CO3→ Na2SO4+ CO2+H2O А) 0,02 б) 0,04 в) 0,05 г) 0,03 д) 0,01 |
|
|
9. Чему равен фактор эквивалентности сульфата железа(Ш) в реакции: Fe2(SO4)3 + Ba(OH)2 → Fe(OH)3 + BaSO4 А) 1; б) 1/2; в) 1/3; г)1/4 ; д) 1/6 |
|
|
10. 0,4 моль гидрофосфата натрия находится в растворе объемом 0,8 л. Рассчитайте молярную концентрацию эквивалента этой соли в реакции с избытком кислоты. А) 1 б) 2 3) 0,2 в) 0,2 г) 3 д) 0,3 |
|
|
11.Определите область рН, в которой лежит точка эквивалентности, если определяемое вещество – уксусная кислота, титрант – гидроксид лития А) рН>7; б) рН< 7; в) рН=7 |
|
|
12. Рассчитайте массовую долю (в долях) фосфорной кислоты с молярной концентрацией 1,510 моль/л (плотность 1,025 г/мл). А) 0,238 б) 2,38 в) 0,144 г) 0,072 д) 1,44 |
|
|
13.Укажите точную формулировку понятия «титрант»: А) – это вещество, раствор которого готовят по точной массе и которое реагирует с определяемым веществом; Б) – это вещество, раствор которого используется для определения концентрации другого вещества; В) – это раствор с точной известной концентрацией, объем которого измеряют в процессе титрования; Г) любой раствор с точно известной концентрацией. |
|
|
14. 0,2 моль дигидрофосфата натрия находится в растворе объемом 0,5 л. Рассчитайте молярную концентрацию эквивалента этой соли в реакции с избытком щелочи. А) 0,8 б) 0,4 в) 0,2 г) 0,6 д) 0,3 |
|
|
15.Определите область рН, в которой лежит точка эквивалентности, если определяемое вещество – ацетат натрия, титрант – соляная кислота А) рН>7; б) рН< 7; в) рН=7 |
|
|
16. Рассчитайте массовую долю (в долях) азотной кислоты с молярной концентрацией 6,273 моль/л (плотность 1,200 г/мл). А) 0,329 б) 3,29 в) 0,15 г) 0,3 0,6 |
|
|
17. Укажите формулировку понятия титрант: а) титрант - это вещество, раствор которого можно приготовить по точной массе и которое не реагирует с определяемым веществом; б) титрант - это вещество, раствор которого используется для определения плотности другого раствора; в) титрант - это раствор с точно известной концентрацией, объем которого измеряют при проведении титриметрического анализа; г) титрант - это вещество, раствор которого добавляют к индикатору до достижения точки эквивалентности; д) любой раствор с точно известной концентрацией. |
|
|
18. Молярная концентрация восстановителя в растворе 0,01 моль/л. Определите молярную концентрацию эквивалента восстановителя по реакции KIO3 +KI +H2SO4→ А) 0,05 б) 0,02 в) 0,1 г) 0,01 д) 0,06 |
|
|
19.Определите область рН, в которой лежит точка эквивалентности, если определяемое вещество – ацетат натрия, титрант – кислота А) рН>7; б) рН< 7; в) рН=7 |
|
|
20. Рассчитайте молярную массу эквивалента сульфата хрома (Ш) в реакции полного обмена ионов хрома (Ш). А) 65,3 б) 110,7 в) 332 г) 156 д) 664 |
|
|
Вопрос 2. 1. Молярная концентрация восстановителя в растворе 0,03 моль/л. Определите молярную концентрацию эквивалента восстановителя по реакции KMnO4 +KCI +H2SO4→ А) 0,15 б) 0,06 в) 0,09 г) 0,12 д) 0,03 |
|
|
2. Сосуд с узким горлышком, на котором нанесена кольцевая метка, предназначенный для приготовления растворов точной концентрации, называется: а) бюретка; б) коническая колба; в) мерная колба; г) пипетка. |
|
|
3.Определите область рН, в которой лежит точка эквивалентности, если определяемое вещество – аммиак, титрант – серная кислота А) рН>7; б) рН< 7; в) рН=7 |
|
|
4. Чему равен фактор эквивалентности перманганата калия в реакции: FeSO4 + KMnO4 + H2SO4 → А) 1; б) 1/2; в) 1/3; г)1/4 ; д) 1/5 |
|
|
5. Молярная концентрация окислителя в растворе 0,02 моль/л. Определите молярную концентрацию эквивалента окислителя по реакции KIO3 +Na2SO3 +H2SO4→ А) 0,004 б) 0,01 в) 0,02 г) 0,04 д) 0,1 |
|
|
6.Раствор с точно известной концентрацией называется а) стандартным; б) исследуемым; в) титрантом; г) нормальным. |
|
|
7. Рассчитайте молярную концентрацию эквивалента, если 80,1 г бромида алюминия находится в растворе объемом 1,5 л. А) 1,5 б) 3,0 в) 0,5 г) 0,15 д) 0,6 |
|
|
8.Определите область рН, в которой лежит точка эквивалентности, если определяемое вещество – хлорид аммония, титрант – гидроксид калия А) рН>7; б) рН< 7; в) рН=7 |
|
|
9. Молярная концентрация эквивалента восстановителя в растворе 0,01 моль/л. Определите молярную концентрацию восстановителя по реакции H2S + Br2→ А) 0,01 б) 0,02 в) 0,1 г) 0,05 д) 0,005 |
|
|
10.Какой индикатор можно использовать при алкалиметрическом титровании щелочью раствора уксусной кислоты? А) метиловый оранжевый; Б) фенолфталеин; В) n-нитрофенол. |
|
|
11. Рассчитайте молярную концентрацию эквивалента раствора серной кислоты с с=0,01 моль/л в реакции полного обмена протонов.. А) 0,2 б) 0,005 в) 0,01 г) 0,02 д) 0,1 |
|
|
12. Молярная концентрация окислителя в растворе равна 0,025 моль/л. Определите молярную концентрацию эквивалента окислителя по реакции K2Cr2O7+KI+H2SO4→ А) 0,2 б) 0,05 в) 0,01 г) 0,025 д) 0,15 |
|
|
13. Укажите точную формулировку понятия «титриметрический анализ»: А) добавление одного из растворов к другому при постоянном наблюдении результата; Б) добавление одного из растворов к другому небольшими порциями при постоянном наблюдении результата; В) определение точных объемов растворов титранта и анализируемого вещества. Г) измерение объема раствора титранта, необходимого для завершения реакции с анализируемым веществом; |
|
|
14. .Какие вещества можно определять прямым алкалиметрическим тированием? А) сильную кислоту; Б) слабую кислоту; В) соль, гидролизующуюся по катиону; Г) соль, гидролизующуюся по аниону; Д) негидролизующуюся соль. |
|
|
15. .Какие вещества можно определять прямым ацидиметрическим тированием? А) сильную кислоту; Б) слабую кислоту; В) соль, гидролизующуюся по катиону; Г) соль, гидролизующуюся по аниону; Д) негидролизующуюся соль. |
|
|
16. Каким требованиям должны удовлетворять реакции, использующиеся в титриметрическом анализе? А) реакция должна протекать количественно по определенному уравнению без побочных реакций; Б) реакция должна быть обратимой; В) реакция должна быть практически необратимой; Г) реакция должна протекать достаточно быстро; Д) реакция должна протекать достаточно медленно. |
|
|
17.Фенолфталеин как индикатор используют при титровании: А) раствора щелочи раствором сильной кислоты; Б) раствора слабого основания раствором сильной кислоты; В) раствора слабой кислоты раствором сильного основания; Г) раствора слабого основания раствором сильной кислоты; |
|
|
18.Для каких веществ в обменных реакциях молярная концентрация всегда совпадает с молярной концентрацией эквивалента: А) серная кислота; б) гидроксид калия; в) хлорид аммония; г) плавиковая кислота? |
|
|
19. Метиловый оранжевый как индикатор используют при титровании: А) раствора щелочи соляной кислотой; Б) раствора слабого основания раствором соляной кислотой; В) раствора сильной кислоты раствором щелочи; Г) раствора соли слабого основания раствором щелочи? |
|
|
20. Перманганат калия в зависимости от реакции может иметь следующие факторы эквивалентности: а) 1/2 б)1/3 в) 1/4 г)1/5 д) 1 |
|
|
Вопрос 3. 1. Термодинамическая система, обменивающаяся с окружающей средой веществом и энергией, называется: а) открытая; б) закрытая; в) изолированная; г) равновесная; д) гомогенная. |
|
|
2. Термодинамическая система, обменивающаяся с окружающей средой только энергией, называется: а) открытая; б) закрытая; в) изолированная; г) равновесная; д) гомогенная. |
|
|
3. Термодинамическая система, не обменивающаяся с окружающей средой ни энергией, ни веществом, называется: а) открытая; б) закрытая; в) изолированная; г) равновесная; д) гомогенная. |
|
|
4. Энтальпия – это: а) функция состояния, изменение которой равно теплоте изохорного процесса; б) функция состояния, изменение которой равно теплоте изобарного процесса; в) функция состояния, изменение которой равно работе, совершаемой закрытой системой в изобарно-изотермическом процессе; г) функция состояния, изменение которой равно работе, совершаемой закрытой системой в изохорно-изотермическом процессе; д) функция состояния, равная теплоте обратимого изотермического процесса, деленной на температуру. |
|
|
5. Внутренняя энергия – это: а) функция состояния, изменение которой равно теплоте изохорного процесса; б) функция состояния, изменение которой равно теплоте изобарного процесса; в) функция состояния, изменение которой равно работе, совершаемой закрытой системой в изобарно-изотермическом процессе; г) функция состояния, изменение которой равно работе, совершаемой закрытой системой в изохорно-изотермическом процессе; д) функция состояния, равная теплоте обратимого изотермического процесса, деленной на температуру. |
|
|
6. Энтропия – это: а) функция состояния, изменение которой равно теплоте изохорного процесса; б) функция состояния, изменение которой равно теплоте изобарного процесса; в) функция состояния, изменение которой равно работе, совершаемой закрытой системой в изобарно-изотермическом процессе; г) функция состояния, изменение которой равно работе, совершаемой закрытой системой в изохорно-изотермическом процессе; д) функция состояния, равная теплоте обратимого изотермического процесса, деленной на температуру. |
|
|
7. Энергия Гиббса – это: а) функция состояния, изменение которой равно теплоте изохорного процесса; б) функция состояния, изменение которой равно теплоте изобарного процесса; в) функция состояния, изменение которой равно работе, совершаемой закрытой системой в изобарно-изотермическом процессе; г) функция состояния, изменение которой равно работе, совершаемой закрытой системой в изохорно-изотермическом процессе; д) функция состояния, равная теплоте обратимого изотермического процесса, деленной на температуру. |
|
|
8. Критерий направления самопроизвольно протекающего процесса в закрытой системе в изобарно-изотермических условиях: а) ΔG>0; б) ΔG<0; в)ΔG=0; г)ΔS>0; д)10-5<К<105. |
|
|
9. Критерий равновесия в закрытой системе в изобарно-изотермических условиях: а) ΔG>0; б) ΔG<0; в)ΔG=0; г)ΔS>0; д)10-5<К<105. |
|
|
10. Критерий обратимости процесса в закрытой системе в изобарно-изотермических условиях: а) ΔG>0; б) ΔG<0; в)ΔG=0; г)ΔS>0; д)10-5<К<105. |
|
|
11. Критерий направления самопроизвольно протекающего процесса в изолированной системе: а) ΔG>0; б) ΔG<0; в)ΔG=0; *г)ΔS>0; д)10-5<К<105. |
|
|
12. Количество теплоты, которое необходимо сообщить 1 грамму данного вещества, чтобы увеличить его температуру на 1К, называется а) стандартная энтальпия образования вещества б) стандартная энергия Гиббса образования вещества в) теплоемкость вещества г) удельная теплоемкость вещества д) энтропия |
|
|
13. Эндотермический процесс, сопровождающийся уменьшением энтропии а) протекает самопроизвольно при любой температуре б) не протекает самопроизвольно ни при как ой температуре в) может протекать самопроизвольно при высокой температуре г) может протекать самопроизвольно при низкой температуре д) самопроизвольному протеканию процесса способствует энтальпийный фактор |
|
|
14. Реакция, энтальпия которой равна стандартной энтальпии образования глюкозы а) 6СО2(г) + 6Н2О(ж) → С6Н12О6(кр) + 6О2(г) б) 2С3Н6О3(ж) → С6Н12О6(кр) в) 6С(графит) + 6Н2(г) + 3О2(г)→ С6Н12О6(кр) г) С12Н22О11(кр) + Н2О(ж) → 2С6Н12О6(кр) д)0,5 С12Н22О11(кр) + 0,5Н2О(ж) → С6Н12О6(кр) |
|
|
15. Реакция, энтальпия которой равна стандартной энтальпии образования серной кислоты а) S(ромб) + 2О2(г) + Н2(г)→ Н2SО4(ж) б) SО3(ж) + Н2О(ж) → Н2SО4(ж) в) SО2(г) + 0,5О2(г) + Н2О(ж) → Н2SО4(ж) г) S(ромб) + 6HNO3(ж) → Н2SО4(ж) + 6NO2(г) + 2Н2О(ж) д) Ag2SO4(водн) + 2HCl(водн) → 2AgCl(тв) + Н2SО4(ж) |
|
|
16. Реакция, энтальпия которой равна стандартной энтальпии образования этанола а) С2Н4(г) + Н2О(ж) → С2Н5ОН(ж) б) С6Н12О6(кр) → 2 С2Н5ОН(ж) + 2СО2(г) в) С2Н5Br(ж) + КО Н (водн) → С2Н5ОН(ж)+ KBr(водн) г) 2С(графит) + 3Н2(г) + 0,5О2(г)→ С2Н5ОН(ж) д) 4С(графит) + 6Н2(г) + О2(г)→ 2С2Н5ОН(ж) |
|
|
17. Для реакции в прямом направлениях ΔH>0; ΔS>0. Самопроизвольное протекание реакции: а) возможно при любой температуре; г) невозможно ни при какой температуре; б) возможно при высокой температуре; д) возможно при условии ΔН>ТΔS. в) возможно при низкой температуре; |
|
|
18. Для реакции в прямом направлениях ΔH>0; ΔS<0. Самопроизвольное протекание реакции: а) возможно при любой температуре; г) невозможно ни при какой температуре; б) возможно при высокой температуре; д) возможно при условии ΔН>ТΔS. в) возможно при низкой температуре; |
|
|
19. Для реакции в прямом направлениях ΔH<0; ΔS>0. Самопроизвольное протекание реакции: а) возможно при любой температуре; г) невозможно ни при какой температуре; б) возможно при высокой температуре; д) возможно при условии ΔН>ТΔS. в) возможно при низкой температуре; |
|
|
20. Для реакции в прямом направлениях ΔH<0; ΔS<0. Самопроизвольное протекание реакции: а) возможно при любой температуре; г) невозможно ни при какой температуре; б) возможно при высокой температуре; д) возможно при условии ΔН>ТΔS. в) возможно при низкой температуре; |
|
|
Вопрос 4. 1. Состояние равновесия (в стандартных условиях) в системе H2 + I2 ↔ 2HI наступает при условии А) ∆G>0 б) ∆G < 0 в) Пс < К г) Пс = К д) с(H2) =с (I2) =с(HI) |
|
|
2. Состояние равновесия (в стандартных условиях) в системе H2 + I2 ↔ 2HI наступает при условии А) ∆G>0 б) ∆G < 0 в) Пс < К г) Пс > К д) с˜(H2) = с˜(I2) =с˜(HI) |
|
|
3. Состояние равновесия (в стандартных условиях) в системе H2 + I2 ↔ 2HI наступает при температуре a) Т=∆Ho/∆So б) Т=298К в) Т> 298К г) Т <298К д) Т=273К |
|
|
4. Для системы, находящейся в равновесии, оцените изменение энергии Гиббса и способность системы совершать работу: а) ΔG=0; W=0; г) ΔG>0; W>0; б) ΔG=0; W>0; д) ΔG>0; W=0. в) ΔG<0; W>0; |
|
|
5. 1). ∆S = Q/T; 2). ∆S = (∆H - ∆G)/T; 3). ∆S = k*1nω В каком случае изменение энтропии и термодинамическая вероятность указаны в одном уравнении: а) 1, б) 2, в)3, г)1,2 д)1,2,3. |
|
|
6. Какая из приведенных ниже формул соответствует константе равновесия обратимого процесса: а) е∆G/RT г) е (∆G - T∆S) /RT б) е-∆G /RT д) е -∆Н /RT в) Пс* е -G/RT |
|
|
7. При каких условиях реакция самопроизвольно может протекать в прямом направлении (при постоянных давлении и температуре): а) ∆G0 г) Пс > К б) ∆G0 д) Пс < К в) Пс = К |
|
|
8. При каких значениях изменения энтальпии и энтропии изменение температуры может обратить направление самопроизвольного процесса: а) – ΔН,+ ΔS, б) – ΔН, - ΔS, г) + ΔН, - ΔS. |
|
|
9. От каких факторов зависит величина константы равновесия? а) концентрации исходных веществ б) концентрации продуктов реакции в) температуры г) давления |
|
|
10. При десятикратном увеличении количества вещества идеального газа при постоянной температуре и давлении энтропия системы: а) увеличится приблизительно в 10 раз б) увеличится приблизительно в 20 раз в) уменьшится приблизительно в 10 раз г) уменьшится приблизительно в 20 раз д) не изменится |
|
|
11. С6Н12О6(тв) + 6О2(г) = 6СО2(г) + 6Н2О(ж) ; - Δ Н. Как изменится тепловой эффект реакции, если увеличить количество кислорода вдвое, по сравнению со стехиометрически необходимым? а) увеличится, б) уменьшится, в) не изменится, г) изменится вдвое. |
|
|
12. При смешивании двух газов, находящихся при одинаковых условиях энтропия системы: а) возрастает, б) уменьшается, в) не изменяется, г) достигает максимума, д) достигает минимума. |
|
|
13. Для каких из перечисленных процессов теплота изобарного процесса (Qp) будет равна теплоте изохорного процесса (Qv) при постоянной температуре? а) СН4 (г) + 2О2(г) → СО2(г) +2Н2О (г) б) 2Н2S (г) + О2(г) → 2S (тв)+ 2Н2О (г) в) 2Н2S (г) +3О2(г) → 2SО2(г) + 2Н2О (г) г) С (тв) + О2(г) → СО2 (г) д) СО2 (г) + Сl2(г) → СОСl2(г) |
|
|
14. Для каких из перечисленных процессов теплота изобарного процесса (Qp) будет равна теплоте изохорного процесса (Qv) при постоянной температуре? а) S(тв) + О2(г) → SО2(г) г) 2С (тв) + О2(г) → 2СО (г) б) 2СО (г) + О2(г) → 2 СО2(г) Д) Н2(г) + Сl2(г) → 2НСl(г) в) N2(г) + 3Н2(г) → 2 NН3(г) |
|
|
15. Выразите константу равновесия реакции: 2Н2 (г) +О2 (г) → 2Н2О (г) (К) через константы равновесия реакций: 2СО2 (г) → 2СО (г) + О2 (г) (К1); СО (г) + Н2О (г) → СО2 (г) + Н2 (г) (К2); а) К=К1*К2; б) К= К1/К2; в) К= 1/К1*К22; г) К= К1/К22; д) К=К1–2К2; |
|
|
Вопрос 5. 1. Средняя скорость реакции измеряется... а) концентрацией продукта после окончания реакции б) промежутком времени, за который концентрация уменьшается в 2 раза в) отношением изменения концентрации к соответствующему промежутку времени г) первой производной концентрации по времени д) изменением концентрации за 1 минуту |
|
|
2. Константа скорости гомогенной химической реакции в растворе зависит от … а) концентраций реагирующих веществ б) температуры в) концентрации катализатора г) перемешивания д) атмосферного давления |
|
|
3. Мгновенная (истинная) скорость реакции измеряется... а) промежутком времени, за который концентрация уменьшается в 2 раза б) первой производной концентрации по времени в) отношением изменения концентрации к соответствующему промежутку времени г) изменением концентрации за 1 час д) концентрацией исходного вещества после окончания реакции |
|
|
4. Скорость химической реакции между веществом в растворе и твердым веществом зависит от: а) концентрации вещества в растворе б) атмосферного давления в) перемешивания г) величины межфазной поверхности д) температуры |
|
|
5. Молекулярностью реакции называют... а) сумму показателей степени в кинетическом уравнении б) число частиц, участвующих в элементарном акте реакции в) явление участия в элементарном акте реакции только молекул г) отношение молярных концентраций вещества до и после реакции д) превращение ионов реагирующих веществ в молекулы продуктов |
|
|
6. Скорость ферментативной реакции зависит от ... а) рН раствора б) концентрации фермента в) концентрации субстрата при условии c(S) >> KM г) концентрации субстрата при условии c(S) << KM д) атмосферного давления |
|
|
7. Энергией активации называется... а) энтальпия активированного комплекса б) минимальный избыток энергии относительно средней энергии частиц, необходимый для образования активированного комплекса в) минимальная суммарная кинетическая энергия частиц, необходимая для того, чтобы при их столкновении произошла реакция г) избыток энергии Гиббса, необходимый для непрерывного протекания химического превращения д) разность между потенциальной энергией продуктов реакции и исходных веществ |
|
|
8. Скорость реакции 2-го порядка между газами при постоянном объеме зависит от … а) давления смеси б) температуры в) объема системы г) парциальных давлений газов д) перемешивания |
|
|
9. Порядком кинетического уравнения реакции называется... а) сумма всех стехиометрических коэффициентов в уравнении химической реакции б) число частиц, участвующих в элементарном акте реакции в) последовательность записи веществ в уравнении химической реакции г) сумма показателей степени при концентрациях в кинетическом уравнении д) сумма стехиометрических коэффициентов в левой части уравнения реакции |
|
|
10. Скорость гетерогенной каталитической реакции в жидкой фазе зависит от … а) природы катализатора б) температуры в) концентрации катализатора г) площади поверхности каталитического материала д) давления |
|
|
11. Период полупревращения является постоянной величиной (при данной температуре) в а) реакции нулевого порядка б) каталитической реакции в) фотохимической реакции г) реакции первого порядка д) реакции второго порядка |
|
|
12. Температурный коэффициент скорости реакции в растворе зависит от а) способа выражения температуры б) концентраций реагирующих веществ в) катализатора г) температуры д) атмосферного давления |
|
|
13. Кинетическим уравнением реакции называется... а) уравнение, устанавливающее зависимость константы скорости реакции от температуры б) химическое уравнение с указанием ∆Н0 и константы скорости в) Последовательность уравнений для простых стадий реакции г) уравнение правила Вант-Гоффа γ = kT+10/kT д) уравнение, устанавливающее зависимость скорости реакции от концентраций участвующих в ней веществ |
|
|
14. Свободными радикалами называются... а) одинаковые группы атомов, входящие в состав разных молекул б) ионы, участвующие в обменных реакциях в) атомы хлора в молекуле Cl2 г) любые частицы, ускоряющие протекание реакций д) частицы, имеющие неспаренные электроны |
|
|
15. Период полупревращения реакции второго порядка в растворе зависит от . . . а) температуры б) концентраций реагирующих веществ в) концентрации только одного из реагирующих веществ г) атмосферного давления д) объема раствора |
|
|
16. Если при протекании химической реакции образуется вещество, концентрация которого сначала увеличивается, а потом начинает уменьшаться, то эта реакция наверняка является ... а) гомогенной б) сложной в) фотохимической г) простой д) биохимической |
|
|
17. Скорость гомогенной каталитической реакции в растворе зависит от ... а) природы катализатора б) концентрации катализатора в) площади поверхности катализатора г) атмосферного давления д) температуры |
|
|
18. Радикальной реакцией называется... а) очень быстрая реакция б) реакция, в элементарных актах которой участвуют свободные радикалы в) реакция, протекающая с изменением состава радикалов в реагирующих веществах г) реакция, протекающая в 2 или более стадий д) реакция радиоактивного распада |
|
|
19. Скорость реакции нулевого порядка в растворе зависит от... а) температуры б) концентрации реагирующего вещества в 1-й степени в) природы растворителя г) концентрации реагирующего вещества во 2-й степени д) объема раствора |
|
|
20. Кинетическим механизмом реакции называется... а) последовательность элементарных стадий реакции б) экспериментальная установка для изучения кинетики реакции в) порядок кинетического уравнения и размерность константы скорости г) совокупность условий, необходимых для протекания реакции д) сумма коэффициентов в химическом уравнении |
|
|
Вопрос 6. 1 Катализатор: а) увеличивает константу равновесия реакции; б) увеличивает энергию активации реакции; в) увеличивает скорость прямой реакции и уменьшает скорость обратной реакции; г) увеличивает константу скорости прямой реакции и уменьшает константу скорости обратной реакции; д) изменяет механизм реакции. |
|
|
2. Введение катализатора не влияет на: а) энергию активации реакции; г) механизм реакции; б) константу скорости реакции; д) скорость реакции. в) константу равновесия реакции; |
|
|
3. Введение катализатора не влияет на: а) скорость реакции; г) константу скорости обратной реакции; б) период полупревращения реакции; д) величину энтальпии реакции. в) константу скорости прямой реакции; |
|
|
4. Каталитическая реакция – это обязательно реакция: а) простая; б) сложная в) ферментативная; г) гетерогенная; д) первого порядка. |
|
|
5. Для ферментативных процессов при концентрациях субстрата меньше константы Михаэлиса выберите характер зависимости скорости реакции от концентрации субстрата (c(S)): а) скорость реакции линейно зависит от c(S); б) скорость реакции не зависит от c(S); в) скорость реакции максимальна; г) скорость реакции равна половине максимальной; д) скорость реакции нелинейно изменяется с изменением c(S); |
|
|
6. Константа Михаэлиса (Кm) численно равна: а) концентрации фермента, при которой скорость реакции максимальна; б) скорости образования фермент-субстратного комплекса; в) концентрации субстрата, при которой скорость реакции максимальна; г) концентрации субстрата, при которой скорость реакции достигает половины максимальной величины; д) концентрации субстрата, равной половине исходной концентрации. |
|
|
7. Во сколько раз увеличится скорость реакции при увеличении температуры на 300С, если значение температурного коэффициента Вант-Гоффа равно 2 а) 10; б) 8 ; в) 9; г) 15; д) 4. |
|
|
8. Величина какой из характеристик процесса не зависит от введения катализатора: а) энергия активации реакции; б) константа скорости реакции; в) механизм реакции; г) порядок кинетического уравнения реакции; д) выход продукта реакции. |
|
|
9. Выберите раствор, для которого значение осмотического давления максимально (все растворы одинаковой концентрации) а) глюкоза б) хлорид натрия в)хлорид кальция г)хлорид алюминия |
|
|
10. Выберите раствор, для которого значение осмотического давления минимально (все растворы одинаковой концентрации) а) глюкоза б) хлорид натрия в) хлорид кальция г) хлорид алюминия |
|
|
11. Выберите раствор, для которого значение осмотического давления максимально (массовая доля растворенного вещества одинакова) а) мочевина б) глюкоза в) сахароза г) глицерин д) фруктоза |
|
|
12. Выберите раствор, для которого значение осмотического давления минимально (массовая доля растворенного вещества одинакова) а) мочевина б) глюкоза в) сахароза г) глицерин д) фруктоза
|
|
|
13. Чему равно осмотическое давление (станд.усл.) разбавленного раствора сульфата калия с концентрацией 1 моль/л? а) 2476 Па б) 2476 кПа в) 2576 Па г) 7429 Па д) 7429 кПа |
|
|
14. Закон Рауля гласит: а) осмос – направленный самопроизвольный переход молекул растворителя через полупроницаемую мембрану б) давление пара растворителя над раствором нелетучего неэлектролита всегда меньше давления насыщенного пара в) давление пара растворителя над раствором нелетучего неэлектролита прямо пропорционально молярной доле растворителя г) темепература кипения раствора всегда выше температуры кипения растворителя |
|
|
15. Осмос – это а) одностороннее проникновение молекул растворителя через полупроницаемую мембрану б) одностороннее проникновение молекул растворенного вещества через полупроницаемую мембрану в) переход молекул растворителя из раствора с большей концентрацией растворенного вещества в меньшую г) давление, которое нужно приложить, чтобы диффузия молекул прекратилась |
|
|
Вопрос 7. 1. Что будет происходить с эритроцитами, если их поместить в 10% раствор поваренной соли? а) лизис б) плазмолиз в) гемолиз г) изоосмос |
|
|
2. Что будет происходить с эритроцитами, если их поместить в 0,9% раствор поваренной соли? а) лизис б) плазмолиз в) гемолиз г) изоосмос |
|
|
3. Что будет происходить с эритроцитами, если их поместить в 0,1% раствор поваренной соли? а) лизис б) плазмолиз в) гемолиз г) изоосмос |
|
|
4. Что будет происходить с клетками растений, если их поместить в 0,1% раствор хлорида натрия (T=25°С)? а) лизис б) плазмолиз в) гемолиз г) изоосмос |
|
|
5. Что будет происходить с эритроцитами, помещенными в 1% раствор этиленгликоля (ρ=1г/мл)? а)лизис б) плазмолиз в) гемолиз г) изоосмос |
|
|
6. Выберите раствор с наименьшей температурой замерзания (концентрация растворов одинакова) а) мочевина б) глюкоза в) хлорид калия г) хлорид кальция д) хлорид алюминия |
|
|
7. Выберите раствор с наибольшей температурой замерзания (концентрация растворов одинакова) а) мочевина б) глюкоза в) хлорид калия г) хлорид кальция д) хлорид алюминия |
|
|
8. Выберите раствор с наименьшей температурой кипения (концентрация растворов одинакова) а) мочевина б) глюкоза в) хлорид калия г) хлорид кальция д) хлорид алюминия |
|
|
9. Выберите раствор с наибольшей температурой кипения (концентрация растворов одинакова) а) мочевина б) глюкоза в) хлорид калия г) хлорид кальция д) хлорид алюминия |
|
|
10. Выберите раствор с наименьшей температурой замерзания (молярная концентрация растворов одинакова). а) мочевина б) хлорид натрия в) хлорид кальция г) хлорид алюминия д) сульфат алюминия |
|
|
11. Выберите раствор с наименьшей температурой кипения (молярная концентрация растворов одинакова) а) мочевина б) хлорид натрия в) хлорид кальция г) хлорид алюминия д) сульфат алюминия |
|
|
12. Какое осмотическое давление должны иметь растворы, которые изотоничны крови? а) 540-600кПа б) 640-700кПа в) 740-800кПа г) 840-900кПа |
|
|
13. Какое вещество наиболее вероятно находится в растворе, если известно, что осмотическое давление раствора (0,1 моль/л), измеренное при стандартных условиях, равно 726 кПа. а) глюкоза б) хлорид натрия в) хлорид магния г) хлорид алюминия |
|
|
14. Какое вещество наиболее вероятно находится в растворе, если известно, что осмотическое давление раствора (0,3 моль/л), измеренное при стандартных условиях, равно 1307,5 кПа. а) глюкоза б) хлорид натрия в) хлорид магния г) хлорид алюминия |
|
|
15. Какое вещество наиболее вероятно находится в растворе, если известно. что осмотическое давление раствора (0,2 моль/л), измеренное при нормальных условиях, равно 487 кПа. а) глюкоза б) хлорид натрия в) хлорид магния г) хлорид алюминия |
|
|
16. Вычислите температуру замерзания раствора, если он содержит 3,01*1023 молекул неэлектролита и 500 мл воды. К(H2O) = 1,86 К*кг/моль. а) 1,86°С б) -1,86°С в) -0,186°С г) -18,6°С |
|
|
17. Вычислите массовую долю глюкозы в водном растворе, если он кипит при температуре 101,32°С. Э(Н2О) = 0,52 К*кг/моль. а) 10% б) 19,2% в) 23,3% г) 25% |
|
|
18. Определите молярную массу вещества, если известно, что температура замерзания водного раствора, содержащего 5,42г в 200г воды равна -0,84°С. К(Н2О)=1,86 К*кг/моль. а)45 г/моль б) 60г/моль в) 120 г/моль г) 180 г/моль |
|
|
19. Установите, каким буде 3% раствор этиленгликоля (ρ=0,876 г/л) по отношению к плазме крови а) гипотонический б) изотонический в) гипертонический г) не хватает данных |
|
|
20. Изотонический коэффициент фосфата натрия будет наибольшим в растворе с концентрацией: а) 1моль/л б) 0,5 моль/л в) 10 моль/л г) 0,1 моль/л д) 0,01 моль/л |
|
|
Вопрос 8.
а) нейтрализацию слабой кислоты; г) ионизацию слабого основания; б) нейтрализацию слабого основания; д) гидролиз соли по аниону. в) ионизацию слабой кислоты; |
|
|
2. Протолитический процесс: HPO42- + H2O <=> PO43- + H3O+ описывает: а) нейтрализацию слабой кислоты; г) ионизацию слабого основания; б) нейтрализацию слабого основания; д) гидролиз соли по аниону. в) ионизацию слабой кислоты; |
|
|
3. Протолитический процесс: H2PO4- + OH- <=> HPO42- + H2O описывает: а) нейтрализацию слабой кислоты; г) ионизацию слабого основания; б) нейтрализацию слабого основания; д) гидролиз слои по аниону. в) ионизацию слабой кислоты; |
|
|
4. Протолитический процесс: HCO3- + OH- <=> CO32- + H2O описывает: а) нейтрализацию слабой кислоты; г) ионизацию слабого основания; б) нейтрализацию слабого основания; д) гидролиз слои по аниону. в) ионизацию слабой кислоты; |
|
|
5. Процесс ионизации слабой кислоты описан уравнением: а) HPO42- + H2O <=> H2PO4- + OH-; г) CO32- + H2O <=> HCO3- + OH-; б) HPO42- + H2O <=> PO43- + H3O+; д) H2PO4- <=> HPO42- + H2O. в) HCO3- + H3O+ <=> H2CO3 + H2O; |
|
|
6. Процесс гидролиза соли по аниону описан уравнением: а) CH3COO- + H2O <=> CH3COOH + OH-; г) HPO42- + H2O <=> PO43- + H3O+; б) CH3COOH + H2O <=> CH3COO- + H3O+; д) HCO3- + H3O+ <=> H2CO3 + H2O. в) CH3COOH + OH- <=> CH3COO- + H2O ; |
|
|
7. Сопряженную протолитическую пару образуют: а) H2PO4- и HPO42- в) H2SO4 и SO42- д) HCl и KOH б) H3PO4 и HPO42- г) H3O+ и OH- |
|
|
8. Сопряженную протолитическую пару образуют: а) NH3 и CH3NH2 б) NH3 и NH4+ в) H2SO4 и SO42- г) H3O+ и OH- д) HCl и KOH |
|
|
9. Сопряженную протолитическую пару образуют: а) Fe(OH)2 и Fe(OH)3 б) Fe3+ и Fe2+ в) FeOH2+ и Fe(OH)2+ г) H2O и OH- д) Fe(OH)2 и Fe(OH)2+ |
|
|
10. Сопряженную протолитическую пару образуют: а) HSO4- и НSO3- б) H3O+ и OH- в) CH3COO- и HCOO- г) NH4+ и OH- д) NH4+ и NH3 |
|
|
11. В какой последовательности уменьшаются значения константы гидролиза приведенных ниже солей? (Ответ – комбинация букв). а) KClO (pKa = 7,55) б) NaCN (pKa = 9,00) в) KNO2 (pKa = 3,29) г) NaF (pKa = 3,18) ГВАБ |
|
|
12. В какой последовательности уменьшаются значения констант равновесия приведенных ниже протолитических реакций? (Ответ – комбинация букв). а) Цианид калия + бензойная кислота (Ка = 6,31*10-5) б) Цианид натрия + пропионовая кислота (Ка = 1,35*10-5) ГАБВ в) Цианид калия + фенол (Ка = 1*10-10) г) Цианид калия + муравьиная кислота (Ка = 1,79*10-4) |
|
|
13. Какая величина численно равна значению рН аммиачного буферного с эквимолярным соотношением компонентов? а) pKb(NH3) б) pKa(NH4+) в) pKw г) lgKb(NH3) д) lgc(NH3) |
|
|
14. В какой последовательности увеличиваются значения степени гидролиза приведенных ниже солей в растворах с одинаковой молярной концентрацией? (Ответ – комбинация букв). а) K2S (Ка = 1*10-13) б) Na2CO3 (Ка = 4,68*10-11) в) K2C2O4 (Ка = 6,16*10-5) г) Na2SO3 (Ка = 6,31*10-8) ВГБА |
|
|
15. В какой последовательности увеличиваются значения констант равновесия приведенных ниже протолитических реакций? (Ответ – комбинация букв). а) Феноксид натрия + азотистая кислота (Ка = 5,13*10-4) БГАВ б) Феноксид калия + уксусная кислота (Ка = 1,74*10-5) в) Феноксид натрия + фтороводородная кислота (Ка = 6,61*10-4) г) Феноксид калия + молочная кислота (Ка = 1,48*10-4) |
|
|
Вопрос 9. 1. В организме не функционирует буферная система: а) гидрокарбонатная; б)гемоглобиновая; в) фосфатная; г) ацетатная; д)аммиачная. |
|
|
2. Буферная система, функционирующая в эритроцитах и не функционирующая в плазме, это - а) гидрокарбонатная; б) белковая; в) аммиачная; г) гемоглобиновая; д) фосфатная. |
|
|
3. Наибольшей буферной емкостью в плазме крови обладает буферная система: а) гидрокарбонатная; б)белковая; в) аммиачная; г) гемоглобиновая; д) фосфатная. |
|
|
4. Буферная система образуется при смешивании растворов, содержащих: а) 1ммоль NH3 и 1 ммоль HCl б) 1 ммоль NH3 и 20 ммоль NH4Cl в) 1ммоль NH3 и 1ммоль NaOH г)1ммоль NH3 и 0.5ммоль HBr д) 1ммоль NH3 и 0.5мольNH4Br |
|
|
5. Буферная система образуется при смешивании растворов, содержащих: а)1моль CH3COOH и 0.1моль CH3COONa б) 1моль CH3COOH и 1моль NaOH в) 1моль CH3COOH и 1моль HСl г) 1моль CH3COONa и 0.1моль NaOH д) 1моль HCl и 0.5моль CH3COONa |
|
|
6. Буферная система образуется при смешивании растворов, содержащих: а) 1моль NaH2PO4 и 2моль NaOH б) 1моль NaH2PO4 и 2 моль HCl в) 1 моль NaH2PO4 и 1 моль NaOH г) 1 моль NaH2PO4 и 0.5 моль NaOH д) 1 моль NaH2PO4 и 1ммоль Na2HPO4. |
|
|
7. Буферная система образуется при смешивании растворов, содержащих: а) 2 моль NaH2PO4 и 1 моль NaOH б) 1 моль NaH2PO4 и 2 моль HCl в) 1 моль NaH2PO4 и 1 моль NaOH г) 0.5 моль NaH2PO4 и 0.5 моль NaOH д) 1 моль NaH2PO4 и 1ммоль Na2HPO4. |
|
|
8. Буферная система образуется при смешивании растворов, содержащих: а) 2 моль NaH2PO4 и 1 моль Na2HPO4 б) 1 моль NaH2PO4 и 2 моль HCl в) 1 моль NaH2PO4 и 1 моль NaOH г) 0.5 моль NaH2PO4 и 0.5 моль Na3PO4. д) 1 моль NaH2PO4 и 1ммоль Na2HPO4. |
|
|
9. Буферная система образуется при смешивании растворов, содержащих: а)10моль CH3COOH и 0.1моль CH3COONa б) 1моль CH3COOH и 1моль NaOH в) 1моль CH3COOH и 1моль HСl г) 1моль CH3COONa и 0.1моль NaOH д) 0.5моль HCl и 1моль CH3COONa |
|
|
10. Буферная система образуется при смешивании растворов, содержащих: а) 1моль NH3 и 1 моль HCl б) 1 моль NH3 и 5 моль NH4Cl в) 1моль NH3 и 1моль NaOH г)1моль NH3 и 0.5ммоль HBr д) 1ммоль NH3 и 0.5мольNH4Br |
|
|
11. В какой последовательности увеличивается буферная емкость систем плазмы крови? (Ответ – комбинация букв). а) Фосфатная б) Белковая АБГВ в) Гидрокарбонатная г) Аминокислотная |
|
|
12. Какие частицы образуют сопряженную протолитическую пару с гидрофосфат-ионом а) H3O+ б) H3PO4 в) H2PO4- г) PO43- д) OH- |
|
|
13. При каком соотношении n(CH3COOH):n(KOH) буферная емкость полученной системы по кислоте и основанию оптимальны? а) 1:2 б) 1:11 в) 2:5 г) 1:1 д) 20:1 |
|
|
14. При каком соотношении n(NH4Cl):n(KOH) буферная емкость полученной системы по кислоте и основанию оптимальны? а) 1:2 б) 1:10 в) 20:1 г) 10:1 д) 1:1 |
|
|
15. Какая буферная система способна поддерживать рН в пределах 11 13? а) Ацетатная (рКа = 4,76) б) Аммиачная (рКа = 9,24) в) Гидрокарбонатная (рКа = 6,37) г) Фосфатная (H2PO4-/HPO42-) (рКа = 7,21) д) Фосфатная (HPO42-/PO43-) (рКа = 12,34) |
|
|
Вопрос 10. 1. В каком из пяти насыщенных водных растворов будет минимальная концентрация катиона: а) бромид серебра (Ks = 5,3*10-13); б) карбонат кальция (Ks = 3,8*10-9); в) сульфит бария (Ks = 8,0*10-7); г) оксалат свинца Ks = 4,8*10-10); д) сульфид меди (II) (Ks = 6,3*10-36). |
|
|
2. Какое соединение является термодинамически устойчивой формой в условиях, характерных для организма: а) CaHPO4; б) Ca4H(PO4)3; в) Ca3(PO4)2; г) Ca5(PO4)3OH; д) Ca(H2PO4)2. |
|
|
3. Какой осадок образуется в первую очередь, если к водному раствору, содержащему ионы свинца, серебра, таллия (I), меди (I) и железа (II) в равных концентрациях, по каплям добавлять сульфид аммония: а) сульфид свинца (Ks = 2,5*10-27); б) сульфид серебра (Ks = 6,3*10-50); в) сульфид таллия (I) (Ks = 5,0*10-21); г) сульфид меди (I) (Ks = 2,5*10-48); д) сульфид железа (II) (Ks = 5,0*10-18) |
|
|
4. Вычислите массу ионов кальция над осадком сульфата кальция, контактирующим с раствором сульфата натрия с концентрацией 0,01 моль/л объемом 500 мл. Ks(CaSO4) = 2,5*10-5 а) 0,05; б) 0,10; в) 0,50; г) 0,20; д) 0,0025. |
|
|
5. Имеется пять водных насыщенных растворов малорастворимых соединений. В каком из них будет наибольшая растворимость в воде: а) карбонате таллия (I) (Ks = 4,0*10-3); б) сульфиде таллия (I) (Ks = 5,0*10-21); в) хлорид таллия (I) (Ks = 1,7*10-4); г) бромиде таллия (I) (Ks = 3,9*10-6); д) иодиде таллия (I) (Ks = 5,75*10-8). |
|
|
6. В каком из пяти водных насыщенных растворов малорастворимых соединений будет минимальная концентрация аниона: а) иодиде серебра (Ks = 8,3*10-17); б) хлориде таллия (I) (Ks = 1,7*10-4); в) сульфате кальция (Ks = 2,5*10-5); г) карбонате бария (Ks = 4,0*10-10); д) оксалате бария (Ks = 1,1*10-7). |
|
|
7. В каком из пяти насыщенных водных растворов будет максимальная концентрация катиона: а) сульфат свинца (Ks = 1,6*10-8); б) хлорид серебра (Ks = 1,78*10-10); в) карбонат стронция (Ks = 1,1*10-10); г) оксалат кадмия (Ks = 1,5*10-8); д) сульфат кальция (Ks = 2,5*10-5). |
|
|
8. Раствор малорастворимого соединения, находящийся в равновесии с твердой фазой, называется: а) насыщенным; б) ненасыщенным; в) пересыщенным; г) разбавленным; д) буферным. |
|
|
9. Конкуренцию за общий катион в растворе при равных концентрациях выигрывает: а) анион, образующий менее растворимое соединение с этим катионом; б) анион, который образует более растворимое соединение с этим катионом; в) анион, который не реагирует с данным катионом; г)анион, концентрация которого выше, чем у катиона; д) анион, концентрация которого ниже, чем у катиона. |
|
|
10. Малорастворимое соединение выпадет в осадок если: а) Пс = Кs; б) Пс ˂ Кs; в) Пс ˃ Кs; г) ∆G = 0; д) при разведении. |
|
|
11. Замещение частиц одного компонента в узлах кристаллической решетки частицами другого компонента называют: а) осаждением; б) синергизмом; в) изоморфизмом; г) изолированным гетерогенным равновесием; д) конкуренцией за общий анион. |
|
|
12. Какой осадок будет выпадать первым, если к водному раствору, содержащему ионы в равной концентрации свинца, таллия (I), серебра, кальция, железа (II), по каплям добавлять оксалат аммония: а) оксалат свинца (Ks = 4,8*10-10); б) оксалат таллия (I) (Ks = 2,0*10-4); в) оксалат серебра (Ks = 3,5*10-11); г) оксалат кальция (Ks = 2,3*10-9); д) оксалат железа (II) (Ks = 2,0*10-7). |
|
|
13. Имеется пять водных насыщенных растворов. В каком из них будет максимальная растворимость вещества в воде: а) бромид серебра (Ks = 5,3*10-13); б) иодид серебра (Ks = 8,3*10-17); в) тиоцианат серебра (Ks = 1,1*10-12); г) хлорид серебра (Ks= 1,78*10-10); д) цианид серебра (Ks = 1,4*10-16). |
|
|
14. В каком из перечисленных вариантов выражение для Ks гидроксидфосфата кальция соответствует истинному: а) Ks = c˜(Ca 2+) c˜2 (PO4 3-); б) Ks = c˜( Ca 2+) c˜(HPO4 2-); в) Ks = c˜5 (Ca 2+) c˜3 (PO4 3-) c˜(OH-); г) Ks = c˜4 (Ca 2+) c˜(H+) c˜(PO4 3-); д) Ks = c˜3 (Ca 2+) c˜2 (PO4 3-). |
|
|
15. Как влияет присутствие одноименного иона на растворимость малорастворимого соединения: а) понижает; б) повышает; в) не влияет; г) образует насыщенный раствор; д) вызывает конкуренцию ионов. |
|
|
16. К водному раствору, содержащему сульфат-, сульфит-, оксалат-, карбонат- и фосфат – ионы в равных концентрациях, добавили по каплям раствор нитрата кальция. Какой из осадков образуется в последнюю очередь: а) сульфит кальция (Ks = 3,2*10-7); б) карбонат кальция (Ks = 3,8*10-9); в) сульфат кальция (Ks = 2,5*10-5); г) оксалат кальция (Ks = 2,3*10-9); д) фосфат кальция (Ks = 2,0*10-29). |
|
|
17. Имеется пять водных насыщенных растворов малорастворимых соединений. В каком из них будет наименьшая растворимость в воде: а) сульфат бария (Ks = 1,1*10-10); б) хлорид серебра (Ks = 1,78*10-10); в) бромид таллия (I) (Ks = 3,9*10-6); г) хлорид свинца (Ks = 1,6*10-5); д) карбонат кальция (Ks = 3,8*10-9). |
|
|
18. Какой осадок будет выпадать в последнюю очередь, если к водному раствору, содержащему равные концентрации ионов Ca 2+, Ba2+, Sr2+, Mg2+, Pb2+, по каплям добавлять водный раствор карбоната натрия: а) карбонат кальция (Ks = 3,8*10-9); б) карбонат бария (Ks = 4,0*10-10); в) карбонат стронция (Ks = 1,1*10-10); г) карбонат магния (Ks = 2,1*10-5); д) карбонат свинца (Ks = 7,5*10-14). |
|
|
19. При каком условии образуется осадок малорастворимого оксалата: а) a (M2+) a (C2O4 2-) ˂ a˜(M2+) a˜(C2O42-); б) а (M2+) a (C2O42-) ˃ a˜(M2+) a˜(C2O4 2-); в) ∆ G = RT Пс/Ks= 0; г) Ks (MC2O4) = a˜(M2+) a˜( C2O4 2-). |
|
|
20. Вычислите концентрацию ионов свинца (в г/л) в насыщенном водном растворе хлорида свинца. Константа растворимости равна 1,6*10-5. А) 0,002 б) 3,29 в) 0,414 г) 0,0159 д) 1,08 |
|
|
Вопрос 11. 1. Константа устойчивости (Куст) и константа нестойкости (Кн) при одинаковых условиях связаны между собой следующим образом: а) Куст* Кн = 0; б) Куст * Кн =0,1; в) Куст * Кн = 1; г) Куст = Кн ; д) Куст * Кн = const. |
|
|
2. Координационное число центрального атома в комплексе Na3[Mn(C2O4)3] равно: а) 3 б) 4 в) 2 г) 6 д) 1 |
|
|
3. Максимальную активность фермент карбоксипептидаза проявляет, в том случае, если в активном центре фермента находится ион: а) Cd(II) б) Ni(II) в) Mn(II) г) Zn(II) |
|
|
4. В лабораторной практике для определения алюминия применяется реакция образования внутрикомплексного соединения с: а) купроном б) дитизоном в) ализарином г) диметилглиоксимом д) глицином |
|
|
5. Какая пространственная конфигурация возможна для комплекса [ML4]: а) линейная б) треугольная в) плоскоквадратная г) тетраэдрическая |
|
|
6. Степень окисления центрального атома в комплексном соединении K5[Cu(SO3)3] равна: а) +3 б) -3 в) +1 г) +2 д) 0 |
|
|
7. Комплекс [Ni(NH3)6]2+ имеет в полученном растворе цвет: а) зелёный б) жёлтый в) красный г) сиреневый д) бирюзовый |
|
|
8. Заряд гексатиоцианоферрат (III)-иона равен: а) +2 б) -2 в) +1 г) -1 д) -3 |
|
|
9.Комплекс [Zn(NH3)4]+ имеет в полученном растворе цвет: а) фиолетовый б) бесцветный в) красный г) жёлтый д) синий |
|
|
10. В водном растворе устойчивые гидроксокомплексы и амминокомплексы образуют следующие катионы: а) алюминий (III) б) свинец (II) в) никель (II) г) цинк (II) д) кальций (II) |
|
|
11. Какова степень окисления железа в гемоглобине ? а) +3 б) +1 в) +2 г) 0 д) -1 |
|
|
12. Из перечисленных комплексов окрашенным является: а) [PtCl6] 2- б) [Zn(NH3)4]2+ в) [Ag(CN2)]- г) [Cu(NH3)4]2+ д) [Ag(NH3)2]+ |
|
|
13. Гексадентатным может быть лиганд: а) H2O б) CN- в) NH3 г) H2ЭДТА2- д) CH2(NH2)COO- |
|
|
14. Металлиндикатор эриохром черный Т образует в аммиачном буферном растворе комплексное соединение с ионами кальция: а) синего б) белого в) желтого г) винно – красного д) черного цвета |
|
|
15. Для комплексного соединения K3[Fe(CN)6] выражение для константы нестойкости Кн будет: а) с~-3(К+) * с~([Fe(CN)6]3-) б) с~(FeIII) * c~(CN-) в) с~(FeIII) * c~6(CN-)
c~(K3[Fe(CN)6])
c~([Fe(CN)6]3-)
c~([Fe(CN)6]3-) г)
c~(K+) * c~([Fe(CN)6])
д) c3(K+) * c(Fe(CN)6])
c~(K3[Fe(CN)6])
c(K3[Fe(CN)6])
|
|
|
16. Комплексообразование с монодентатными лигандами наиболее характерно для: а) s- б) p- в) s- и p- г) d- д) s-, p- и d- элементов |
|
|
17. Лиганды с несколькими донорными атомами называются: а) многоядерными б) монодентатными в) полидентатными г) моноядерными д) нет правильного ответа |
|
|
18. Не окрашен водный раствор комплексного соединения: а) K3[Fe(SCN)6] б) [Ni(NH3)6]Cl2 в) [Cu(NH3)4]SO4 г) [Zn(NH3)4]SO4 д) K[Fe(тартр.)] |
|
|
19. К соединениям с макроциклическими лигандами не относится: а) хлорофилл б) гемоглобин в) гемоцианин г) бис-этилендиаминцинка |
|
|
20. Соединение K4[Fe(CN)6] можно отнести к: а) неэлектролитам б) ацидокомплексам в) смешанным комплексам г) анионным комплексам |
|
|
Вопрос 12.
а) увеличить концентрацию окисленной формы г) увеличить значение рН б) увеличить концентрацию восстановленной формы д) уменьшить температуру. в) разбавить систему водой |
|
|
2. Величина редокс-потенциала редокс-системы первого типа увеличится, если а) увеличить значение рН б) уменьшить значение рН в) связать только окисленную форму в комплекс г) связать только восстановленную форму в комплекс. д) разбавить систему водой |
|
|
3. Величина редокс-потенциала редокс-системы второго типа увеличится, если а) увеличить значение рН г)разбавить систему водой б) уменьшить значение рН д) уменьшить температуру. в) связать только окисленную форму в малорастворимое соединение |
|
|
4. Величина редокс-потенциала редокс-системы Fe3+ /Fe2+ уменьшится, если а) добавить соляную кислоту г) добавить в систему воду б) нагреть раствор д) добавить хлорид железа(II). в) добавить хлорид железа(III). |
|
|
5. Величина редокс-потенциала редокс-системы Fe3+ /Fe2+ уменьшится, если а) добавить избыток цианид-ионов г) добавить в систему воду б) нагреть раствор д) добавить хлорид железа (III). в) уменьшить значение рН |
|
|
6. Величина редокс-потенциала редокс-системы MnO4-/Mn2+ увеличиться, если в систему добавить: а) соляную кислоту в) воду д) хлорид калия б) щелочь г) хлорид марганца (II) |
|
|
7. Величина редокс-потенциала редокс-системы MnO4- +8Н+/Mn2++4Н2О увеличится, если в систему добавить: а) хлорид марганца (II) в) воду д) хлорид калия б) перманганат калия г) гидроксид калия |
|
|
8. Величина редокс-потенциала редокс-системы Ag+/Ag уменьшится, если а) добавить раствор нитрата серебра г) уменьшить температуру б) добавить серебро д) добавить воду. в) уменьшить значение рН |
|
|
9. Величина редокс-потенциала редокс-системы второго типа увеличится, если а) увеличить значение рН б) связать только окисленную форму в прочный комплекс в) связать только восстановленную форму в малорастворимое соединение г) понизить температуру д) увеличить концентрацию восстановленной формы. |
|
|
10. В водном растворе наиболее сильным окислителем из перечисленных является если φr° (Cu2+/ Cu+) = +0,54 В; φro (Сl2/ 2CI-) = +1,36 В; φr°(МnO4- / МnO42-) = +0,56 В; φro(метиленового синего) = +0,01 В.: а) Cu2+, входящий в состав гемоцианина б) Сl2 в) МnO4- г) метиленовый синий. |
|
|
11. Инертный металл в сочетании с раствором, содержащим окислительно-восстановительную систему, называется: а) электродом сравнения; в) редокс потенциалом; д) концентрационным элементом б) редокс электродом; г) гальваническим элементом; |
|
|
12. Разность потенциалов на границе раздела фаз: металл−раствор соли металла, называется: а) диффузионным потенциалом; в) редокс потенциалом; д) электродным потенциалом. б) контактным потенциалом; г) электродвижущей силой; |
|
|
13. Разность потенциалов на границе раздела фаз: инертный металл−раствор, содержащий окисленную и восстановленную форму вещества, называется: а) диффузионным потенциалом; г) электродвижущей силой; б) контактным потенциалом; д) электродным потенциалом. в) редокс потенциалом; |
|
|
14. Ионно-металлическим электродом I рода является: а) хлорсеребряный электрод; в) стеклянный электрод; д) цинковый электрод. б) каломельный электрод; г) хингидронный электрод |
|
|
15. Ионно-металлическим электродом II рода является: а) хлорсеребряный электрод; в) ферментный электрод; д) мембранный электрод б) стеклянный электрод; г) хингидронный электрод; |
|
|
16. Окислительно-восстановительным электродом II типа является: а) хлорсеребряный электрод; в) медный электрод; д) хингидронный электрод. б) каломельный электрод; г) цинковый электрод; |
|
|
17. Ионоселективным электродом является: а) хлорсеребряный электрод; в) стеклянный электрод; б) каломельный электрод; г) водородный электрод; |
|
|
18. Электродный потенциал численно равен ЭДС гальванической цепи, составленной из данного электрода и а) хлорсеребряного электрода; г) измерительного электрода; б) платинного электрода; д) стандартного водородного электрода. в) электрода сравнения; |
|
|
19. Стандартный электродный потенциал а) относится к процессу окисления (red – ne- → ox); б) характеризует восстановительную способность редокс-системы; в) характеризует окислительную способность редокс-системы; г) зависит от температуры и активности окислительной и восстановительной форм; д) водородного электрода принят равным единице. |
|
|
20. Величина редокс-потенциала редокс-системы Ag+ /Ag увеличится, если а) добавить азотную кислоту г) добавить в систему воду б) нагреть раствор д) добавить хлорид натрия в) добавить серебро |
|
|
Вопрос 13.
а) σр-р>σр-ль, g>0; в) σр-р<σр-ль, g>0 д) g=0 б) σр-р<σр-ль, g<0; г) σр-р=σр-ль; |
|
|
2. К поверхностно-активным веществам относятся: а) карбоновые кислоты; в) неорганические соли; д) глицерин. б) сахароза; г) α-аминокислоты; |
|
|
3. К поверхностно-активным веществам не относятся: а) спирты; в) карбоновые кислоты; д) соли карбоновых кислот. б) амины; г) α-аминокислоты; |
|
|
4. Поверхностной активностью обладает: а) сахароза; б) глицерин; в) фенол; г) аммиак; д) сульфат натрия. |
|
|
5. Наибольшая поверхностная активность (при одинаковой концентрации и температуре) у раствора: а) муравьиной кислоты; в) пропионовой кислоты; д) гексановой кислоты. б) уксусной кислоты; г) масляной кислоты |
|
|
6. Цетилтриметил-аммония бромид [H3C –(CH2)15 – N(CH3)3]+Br- относится к: а) катионактивным ПАВ; г) неионогенным ПАВ; б) анионактивным ПАВ; д) поверхностно-неактивным веществам. в) амфотерным ПАВ; |
|
|
7. Лаурилсульфат натрия [H3C – (CH2)11 – SO3]-Na+: а) катионактивным ПАВ; г) неионогенным ПАВ; б) анионактивным ПАВ; д) поверхностно-инактивным веществам. в) амфотерным ПАВ; |
|
|
8. Сложные эфиры сорбита и жирных кислот (спаны) с общей формулой O // OH – CH2 – (CHOH)4 – CH2O – С – R относятся к: а) ионогенным ПАВ; г) поверхностно-инактивным веществам; б) неионогенным ПАВ; д) амфотерным ПАВ. в) поверхностно-неактивным веществам; |
|
|
9. Природные α-аминокислоты относятся к: а) ионогенным ПАВ; б) неионогенным ПАВ в) амфотерным ПАВ; г) ПИВ; д) ПНВ. |
|
|
10. Сахароза относится к: а) ионогенным ПАВ; г) поверхностно-инактивным веществам; б) неионогенным ПАВ; д) поверхностно-неактивным веществам. в) амфотерным ПАВ; |
|
|
11. Величина, численно равная работе, которую надо совершить для образования единицы поверхности раздела фаз (Т=const), называется: а) поверхностная активность; г) адсорбция; б) поверхностное натяжение; д) абсорбция. в) поверхностная энергия Гиббса; |
|
|
12. Способность растворенных веществ изменять поверхностное натяжение растворителя называется: а) поверхностная активность; г) адсорбция; б) поверхностное натяжение; д) абсорбция. в) поверхностная энергия Гиббса; |
|
|
13. Явление самопроизвольного перераспределения частиц растворимого вещества между объемом фазы и поверхностным слоем называется: а) поверхностная активность; г) адсорбция; б) поверхностное натяжение; д) абсорбция. в) поверхностная энергия Гиббса; |
|
|
14. Величина, численно равная количеству вещества адсорбтива, поглощенного единицей массы адсорбента, называется: а) поверхностная активность; г) адсорбция; б) поверхностное натяжение; д) абсорбция. в) поверхностная энергия Гиббса; |
|
|
15. Поглощение вещества всей массой адсорбента называется: а) адсорбция; г) десорбция; б) абсорбция; д) хемосорбция в) капиллярная конденсация; |
|
|
16. На полярных адсорбентах лучше адсорбируются: а) неполярные адсорбаты из полярных растворителей; б) неполярные адсорбаты из неполярных растворителей; в) полярные адсорбаты из неполярных растворителей; г) полярные адсорбаты из полярных растворителей; д) ПАВ из полярных растворителей. |
|
|
17. На неполярных адсорбентах лучше адсорбируются: а) неполярные адсорбаты из полярных растворителей; б) неполярные адсорбаты из неполярных растворителей; в) полярные адсорбаты из неполярных растворителей; г) полярные адсорбаты из полярных растворителей; д) ПАВ из полярных растворителей. |
|
|
18. Поверхностно-активные вещества лучше адсорбируются: а) полярными адсорбентами из неполярных растворителей; б) полярными адсорбентами из полярных растворителей; в) неполярными адсорбентами из полярных растворителей; г) неполярными адсорбентами из неполярных растворителей; д) активированным углем из водных растворов. |
|
|
19. Поверхностная активность пропанола по сравнению с поверхностной активностью метанола: а) больше приблизительно в 3 раза; г) меньше приблизительно в 3 раза; б) больше приблизительно в 6 раз; д) меньше приблизительно в 10 раз. в) больше приблизительно в 10 раз; |
|
|
20. Поверхностная активность масляной (бутановой) кислоты по сравнению с поверхностной активностью муравьиной (метановой) кислоты: а) больше приблизительно в 3 раза; г) меньше приблизительно в 9 раз; б) больше приблизительно в 6 раз; д) больше приблизительно в 30 раз. в) больше приблизительно в 9 раз; |
|
|
Вопрос 14. 1. Выберите утверждения, справедливые для поверхностно-активных веществ: а) уменьшают поверхностное натяжение воды; б) увеличивают поверхностное натяжение воды; в) адсорбируются положительно; г) адсорбируются отрицательно; д) концентрация в объеме выше, чем в поверхностном слое. |
|
|
2. Укажите, от каких факторов зависит величина адсорбции на границе раздела твердое тело – раствор: а) удельная поверхность адсорбента; г) температура; б) природа растворителя; д) концентрация адсорбтива в) природа адсорбента; |
|
|
3. Выберите утверждения, справедливые для поверхностно – инактивных веществ: а) уменьшают поверхностное натяжение; б) увеличивают поверхностное натяжение; в) адсорбируются положительно; г) адсорбируются отрицательно; д) концентрация в объеме выше, чем в поверхностном слое. |
|
|
4. Оцените, во сколько раз отличаются величины поверхностной активности уксусной и бутановой кислот в разбавленных водных растворах с одинаковыми концентрациями: а) поверхностная активность уксусной кислоты больше в 3 раза; б) поверхностная активность уксусной кислоты меньше в 9 раз; в) поверхностная активность уксусной кислоты меньше в 30 раз; г) поверхностная активность бутановой кислоты больше в 3 раза;
|
|
|
5. От каких параметров системы зависит величина адсорбции на подвижной границе раздела фаз жидкость – газ: а) химического состава растворителя; б) поверхностной активности растворенного вещества; в) давления газовой фазы; г) температуры раствора; д) концентрации растворенного вещества. |
|
|
6. Уравнение Гиббса отражает условие равновесия объемной фазы и поверхностного слоя при: а) минимальной концентрации вещества в объеме фазы; б) определенных значениях поверхностного натяжения и концентрации растворенного вещества; в) минимальной поверхностной активности вещества; г) постоянной температуре; д) максимальной концентрации вещества в поверхностном слое. |
|
|
7. К полярным адсорбентам относятся: а) алюмосиликаты; б) активированный уголь; в) оксиды; г) карбонаты; д) графитизированная сажа. |
|
|
8. Для удаления фенола из воды следует использовать: а) графитизированную сажу; б) каолин; в) активированный уголь; г) алюмосиликаты; д) силикагель. |
|
|
9. Для экспериментального определения адсорбции на неподвижной границе раздела фаз используют формулы: а) а = Ксn; б) lg a = lg K + n lg c; в) a = amax*c/(α+c); г) a = (c0-c)*V/m. |
|
|
10. К поверхностно-активным веществам относят растворимые в воде: а) органические кислоты; б) неорганические кислоты; в) углеводы; г) белки; д) амины. |
|
|
11. При ионной адсорбции ионы адсорбируются тем лучше, чем: а) меньше их радиус и заряд; б) больше их радиус и заряд; в) меньше их радиус и больше заряд; г) радиус и заряд иона не имеют значения. |
|
|
12. Величину поверхностного натяжения жидкостей экспериментально определяют: а) по изменению осмотического давления; б) по изменению концентрации вещества после завершения адсорбции; в) методом максимального давления в пузырьке газа; г) по поднятию жидкости в капилляре. |
|
|
13. По какому механизму может протекать адсорбция электролитов на поверхности твердого сорбента: а) молекулярному; б) ионообменному; в) избирательному; г) эквивалентному. |
|
|
14. В многокомпонентных системах уменьшение избытка поверхностной энергии происходит за счет: а) уменьшения поверхности; б) увеличения поверхности; в) перераспределения молекул между объемом фазы и поверхностным слоем; г) увеличения температуры; д) уменьшения температуры. |
|
|
15. В водном растворе с концентрацией 0,05 моль/л поверхностная активность пропионовой кислоты по отношению к активности муравьиной кислоты: а) больше приблизительно в 2 раза; б) меньше приблизительно в 3 раза; в) приблизительно одинаковы; г) меньше приблизительно в 2 раза; д) больше приблизительно в 9 раз. |
|
|
16. Адсорбция метиленового синего из водно-спиртового раствора на активированном угле увеличивается при: а) уменьшении концентрации воды и увеличении концентрации спирта при постоянной концентрации метиленового синего; б) нагревании раствора; в) увеличении удельной поверхности угля; г) увеличении массовой доли спирта и воды при постоянной концентрации метиленового синего; д) уменьшении концентрации метиленового синего при постоянных концентрациях спирта и воды. |
|
|
17. Величину адсорбции из растворов на твердом сорбенте экспериментально определяют по изменению следующего свойства: а) объема раствора адсорбата; б) массы адсорбента; в) изменение концентрации адсорбата до и после адсорбции; г) химического состава адсорбента. |
|
|
18. Какое уравнение термодинамически строго описывает зависимость адсорбции поверхностно-активного вещества от его концентрации на подвижной границе раздела: а) уравнение Лэнгмюра; б) уравнение Фрейндлиха; в) уравнение Гиббса; г) уравнение Траубе. |
|
|
19. Расположите в порядке уменьшения поверхностной активности в водном растворе одинаковой концентрации следующие вещества: а) уксусная кислота; б) бутановая кислота; в) пентановая кислота; ГВБАД г) гексановая кислота; д) муравьиная кислота. |
|
|
20. При каком соотношении (NaCH3COO):(HCl) буферная емкость полученной системы по кислоте и основанию оптимальны? а) 15:1 б) 10:1 в) 20:1 г) 1:1 д) 1:10 |
|
|
Вопрос 15. 1. Электролит с наибольшим порогом коагуляции по отношению к золю, частицы которого имеют положительный заряд: а) сульфат алюминия; б) фосфат калия; в) хлорид кальция. |
|
|
2. При электрофорезе частицы золя перемещаются к катоду. Для какой пары электролитов пороги коагуляции этого золя будут примерно одинаковыми? а) сульфат цинка и хлорид меди (II); б) нитрат калия и хлорид кальция; в) хлорид алюминия и фосфат калия; г) бромид натрия и сульфат магния. |
|
|
3. Аэрозолями называют дисперсные системы: а) с газообразной дисперсной фазой; б) с жидкой дисперсной фазой; в) с твёрдой дисперсной фазой; г) с газообразной дисперсионной средой; д) со смешанной дисперсной фазой. |
|
|
4. Интенсивность рассеяния света золем при увеличении радиуса частиц в 2 раза: а) увеличится в 2 раза; б) уменьшится в 2 раза; в) увеличится в 64 раза; г) уменьшится в 64 раза; д) увеличится в 8 раз. |
|
|
5. Частицы гидрозоля при электрофорезе перемещаются к аноду. Для какого электролита порог коагуляции будет максимальным? а) сульфат магния; б) хлорид кальция; в) фосфат калия; г) сульфат алюминия; д) нитрат железа (II). |
|
|
6. Как изменится интенсивность светорассеяния производимого золем, если частичная концентрация золя уменьшится в 2 раза? а) увеличится в 2 раза; б) увеличится в 64 раза; в) увеличится в 4 раза; г) уменьшится в 2 раза; д) уменьшится в 64 раза; е) уменьшится в 4 раза. |
|
|
7. Какой процесс называют пептизацией? а) переход частиц осадка во взвешенное состояние за счёт теплового движения; б) растворение свежеполученного осадка в результате химического взаимодействия с пептизатором с образованием истинного раствора; в) выпадение дисперсной фазы в осадок под действием пептизатора; г) переход свежеполученного осадка в золь под действие пептизатора; д) процесс, аналогичный коагуляции. |
|
|
8. Для очистки коллоидных растворов от грубодисперсных примесей применяют: а) центрифугирование; б) электродиализ; в) диализ; г) фильтрация; д) ультрафильтрация; |
|
|
9. Золь получен пептизацией осадка гидроксида железа (III) хлоридом железа (III). Какой электролит будет иметь максимальную коагулирующую способность по отношению к этому золю: а) CaCl2; б) Al2(SO4)3; в) Na3PO4; г) Zn(NO3)2; д) K4[Fe(CN)6]. |
|
|
10. Какие ионы из присутствующих в растворе при образовании коллоидного раствора могут быть потенциалопределяющими в результате избирательной адсорбции ионов? а) анионы, входящие в состав реагирующих веществ; б) катионы, входящие в состав реагирующих веществ; в) любые ионы, находящиеся в избытке в дисперсионной среде; г) ионы, способные достроить кристаллическую структуру агрегата; д) ионы, входящие в состав ядра. |
|
|
11. Золь бромида серебра получен в условиях избытка соли серебра. Какой из перечисленных электролитов имеет максимальную коагулирующую способность по отношению к этому золю? а) карбонат калия; б) фосфат натрия; в) хлорид алюминия; г) сульфат аммония; д) нитрат магния. |
|
|
12. Суспензиями называют микрогетерогенные системы: а) с жидкими дисперсионной средой и дисперсной фазой; б) с газообразной дисперсной фазой; в) с газообразной дисперсионной средой; г) с жидкой дисперсионной средой и твёрдой дисперсной фазой; д) с твёрдой дисперсионной средой и жидкой дисперсной фазой. |
|
|
13. Диализ коллоидных растворов применяют с целью: а) повышения устойчивости золей; б) очистки от любых примесей; в) очистки от грубодисперсных частиц; г) очистки от молекул и ионов низкомолекулярных веществ; д) концентрирования золей. |
|
|
14. Из каких ионов состоит адсорбционный слой мицеллы? а) из потенциалопределяющих ионов; б) из свободных противоинов; в) из потенциалопределяющих ионов и связанных противоинов; г) из связанных противоинов; |
|
|
15. При электрофорезе частицы золя перемещаются к катоду. Для какой пары электролитов пороги коагуляции этого золя будут примерно одинаковыми? а) ZnCl2 и MgSO4; б) (NH4)2SO4 и Mg(NO3)2; в) NaNO3 и CaCl2; г) AlCl3 и Na2CO3; д) KBr и (NH4)2SO4. |
|
|
16. Из каких ионов состоит диффузный слой мицеллы? а) из потенциалопределяющих ионов; б) из свободных противоинов; в) из потенциалопределяющих ионов и связанных противоинов; г) из связанных противоинов; д) из свободных и связанных противоинов. |
|
|
17. Найдите верное определение электрофореза: а) электрокинетическое явление, возникающее при механическом перемещении дисперсной среды относительно частиц дисперсной фазы; б) электрокинетическое явление перемещения частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля; в) электрокинетическое явление, возникающее при вынужденном перемещении дисперсной фазы относительно дисперсионной среды; г) электрокинетическое явление перемещения дисперсионной среды относительно дисперсной фазы в электрическом поле. |
|
|
18. Золь получен пептизацией осадка гидроксида алюминия хлоридом алюминия. Какой из перечисленных ниже электролитов будет обладать наименьшей коагулирующей способностью по отношению к этому золю? а) сульфат алюминия; б) карбонат натрия; в) фосфат аммония; г) хлорид кальция; д) гексацианоферрат (III) калия. |
|
|
19. Размер частиц дисперсной фазы коллоидно – дисперсных систем: а) меньше 10-9м; б) от 10-7 до 10-5м; в) от 10-9 до 10-7м; г) от 10-9 до10-5м; д) больше 10-7м. |
|
|
20. Найдите верную формулировку правила электролитной коагуляции Шульце – Гарди. а) коагулирующим действием обладает ион электролита, заряд которого противоположен заряду коллоидной частицы, причём его порог коагуляции тем больше, чем больше заряд иона; б) коагулирующая способность электролита приблизительно пропорциональна шестой степени заряда ионов, знак заряда которых противоположен знаку заряда коллоидных частиц; в) порог коагуляции электролита возрастает с увеличением заряда коагулирующего иона, а коагулирующим действием обладает противоион; г) коагулирующая способность ионов обратно пропорциональна шестой степени заряда коагулирующего иона, которым является противоион. |
|
|
Вопрос 16. 1. Выберите свойства, характерные для коллоидно-дисперсных систем: а) агрегативная устойчивость; б) агрегативная неустойчивость; в) седиментационная устойчивость; г) седиментационная нестойкость; д) термодинамическая устойчивость; е) термодинамическая неустойчивость. |
|
|
2. Выберите вещества для химического способа пептизации свежеосаждённого осадка гидроксида свинца: а) нитрат свинца; б) соляная кислота; в) ацетат свинца; г) азотная кислота; д) гидроксид натрия. |
|
|
3. Выберите свойства, характерные для грубодисперсных систем: а) термодинамическая неустойчивость; б) термодинамическая устойчивость; в) седиментационная неустойчивость; г) седиментационная устойчивость. |
|
|
4. Какие из перечисленных ионов могут быть противоионами в мицелле золя, гексацианоферрата (II) меди (II), полученного в избытке сульфата меди (II)? а) SO42-; б) СN-; в) Сu2+; г) Fe2+; д) [Fe(CN)6]4-. |
|
|
5. Какие вещества из перечисленных ниже могут вызвать пептизацию свежеосаждённого гидроксида свинца: а) хлорид натрия; б) гексацианоферрат (II) калия; в) гидроксид калия; г) хлорид свинца; д) аммиак. |
|
|
6. Диссолюционная (химическая) пептизация коагеля гидроксида алюминия возможна при добавлении: а) сульфата алюминия; б) хлорида железа; в) хлороводородной кислоты; г) гидроксида калия; д) сульфата натрия. |
|
|
7. Выберите верные утверждения: Диализационная мембрана: а) пропускает молекулы и ионы низкомолекулярных веществ; б) задерживает молекулы и ионы низкомолекулярных веществ; в) пропускает молекулы растворителя; г) задерживает молекулы растворителя; д) пропускает коллоидные частицы; е) задерживает коллоидные частицы. |
|
|
8. Как располагаются противоионы в мицелле? а) располагаются неравномерно, часть из них входит в состав адсорбционного слоя, а другая часть образует диффузный слой; б) располагаются равномерно в адсорбционном и диффузном слое; в) располагаются неравномерно в диффузном слое; г) располагаются в адсорбционном слое и входят в состав агрегата; д) располагаются в пространстве диффузного слоя с убывающей плотностью. |
|
|
9. Растворы каких из перечисленных электролитов могут перевести свежеполученный осадок гидроксида алюминия в коллоидный раствор? а) гексацианоферрат (II) железа; б) хлорид бария; в) гидроксид натрия; г) хлороводородная кислота; д) хлорид алюминия. |
|
|
10. Какие из перечисленных признаков свидетельствуют о наличии скрытой коагуляции в коллоидном растворе? а) изменение интенсивности светорассеяния; б) увеличение скорости диффузии; в) уменьшение осмотического давления; г) изменение цвета; д) уменьшение интенсивности броуновского движения. |
|
|
11. Выберите свойства, характерные для коллоидно-дисперсных систем: а) частицы дисперсной фазы видны в обычный микроскоп; б) частицы дисперсной фазы не видны в обычный микроскоп; в) опалесценция, эффект Тиндаля; г) седиментационная устойчивость; д) частицы дисперсной фазы задерживаются обычным бумажным фильтром. |
|
|
12. Какие из перечисленных ионов могут быть потенциалопределяющими при образовании золя гексацианоферрата (II) меди (II)? а) Сu2+; б) Fe2+; в) [Fe(CN)6]3-; г) СN-; д) [Fe(CN)6]4-. |
|
|
13. Какие из перечисленных свойств различаются у коллоидных растворов и истинных растворов низкомолекулярных веществ? а) способность к светорассеянию; б) окраска; в) скорость диффузии; г) осмотическое давление; д) агрегативная устойчивость. |
|
|
14. Какими из перечисленных методов можно определить знак заряда коллоидных частиц? а) осмометрическим; б) капиллярным; в) электрофоретическим; г) ультрамикроскопическими; д) криометрическим. |
|
|
15. Выберите свойства, характерные для грубодисперсных систем: а) частицы дисперсной фазы видны в обычный микроскоп; б) частицы дисперсной фазы не видны в обычный микроскоп; в) опалесценция, эффект Тиндаля; г) седиментационная устойчивость; д) частицы дисперсной фазы задерживаются обычным бумажным фильтром. |
|
|
16. Какие из перечисленных факторов влияют на интенсивность броуновского движения в коллоидных растворах? а) размер коллоидных частиц; б) соотношение плотностей дисперсной фазы и дисперсионной среды; в) температура; г) частичная концентрация коллоидного раствора; д) вязкость дисперсионной среды. |
|
|
17. Адсорбционная пептизация коагеля гидроксида алюминия возможна при добавлении: а) сульфата алюминия; б) хлорида железа; в) хлороводородной кислоты; г) гидроксида калия; д) сульфата натрия. |
|
|
18. Какие из перечисленных электролитов имеют приблизительно одинаковые пороги коагуляции по отношению к золю гидроксида железа (III), полученного методом гидролиза? а) нитрат натрия; б) хлорид кальция; в) сульфат алюминия; г) фосфат калия; д) фторид лития. |
|
|
19. Какие из перечисленных признаков свидетельствуют о явной коагуляции? а) уменьшение осмотического давления; б) помутнение; в) изменение цвета; г) уменьшение скорости диффузии; д) выпадение осадка; |
|
|
20. Какие методы применяют для очистки коллоидных растворов от примеси низкомолекулярных электролитов? а) центрифугирование; б) электродиализ; в) диализ; г) фильтрацию; д) ультрафильтрацию; |
|
|
Вопрос 17. 1. В каких из ниже перечисленных реакциях оба реагирующих вещества имеют фактор эквивалентности, равный 1/2: а) Н3РО4 + 2КОН → К2НРО4 + Н2О б) Са(NO3)2 + К2СО3 → 2КNО3 + СаСО3 в) Мg(ОН)2 + Н2SО4 → МgSО4 + 2Н2О г) 2NаI + Вr2 → 2NаВr + I2 д) I2 + 2Na2S2O3 → 2NaI + Na2S4O6 |
|
|
2. При ацидиметрическом титровании pH анализируемого раствора А) увеличивается Б) уменьшается В) сначала увеличивается, затем уменьшается Г) остается без изменения |
|
|
3. При алкалиметрическом титровании pH анализируемого раствора А) увеличивается Б) уменьшается В) сначала увеличивается, затем уменьшается Г) остается без изменения |
|
|
4. Самопроизвольно при любых температурах происходят процессы: а) экзотермические, сопровождающиеся уменьшением энтропии; б) экзотермические, сопровождающиеся увеличением энтропии; в) эндотермические, сопровождающиеся увеличением энтропии; г) эндотермические, сопровождающиеся уменьшением энтропии; д) эндэргонические. |
|
|
5. Самопроизвольному протеканию процесса способствуют увеличение температуры, если процесс: а) экзотермический с увеличением энтропии; б) экзотермический с уменьшением энтропии; в) эндотермический с уменьшением энтропии; г) эндотермический с увеличением энтропии; д) сопровождается выделением тепла. |
|
|
6. Самопроизвольному протеканию процесса способствуют уменьшение температуры, если процесс: а) экзотермический с увеличением энтропии; б) экзотермический с уменьшением энтропии; в) эндотермический с уменьшением энтропии; г) эндотермический с увеличением энтропии; д) сопровождается выделением тепла. |
|
|
7. Экзотермический процесс сопровождается увеличением энтропии. Следовательно: а) самопроизвольному протеканию процесса способствует только энтальпийный фактор; б) самопроизвольному протеканию процесса способствует только энтропийный фактор; в) самопроизвольному протеканию процесса способствует как энтальпийный, так и энтропийный факторы; г) самопроизвольному протеканию процесса препятствует как энтальпийный, так и энтропийный факторы; д) Самопроизвольное протекание процесса невозможно. |
|
|
8. Экзотермический процесс сопровождается уменьшением энтропии. Следовательно: а) самопроизвольному протеканию процесса способствует только энтальпийный фактор; б) самопроизвольному протеканию процесса способствует только энтропийный фактор; в) самопроизвольному протеканию процесса способствует как энтальпийный, так и энтропийный факторы; г) самопроизвольному протеканию процесса препятствует как энтальпийный, так и энтропийный факторы; д) Самопроизвольное протекание процесса невозможно. |
|
|
9. Эндотермический процесс сопровождается увеличением энтропии. Следовательно: а) самопроизвольному протеканию процесса способствует только энтальпийный фактор; б) самопроизвольному протеканию процесса способствует только энтропийный фактор; в) самопроизвольному протеканию процесса способствует как энтальпийный, так и энтропийный факторы; г) самопроизвольному протеканию процесса препятствует как энтальпийный, так и энтропийный факторы; д) Самопроизвольное протекание процесса невозможно. |
|
|
10. Период полупревращения реакции нулевого порядка увеличивается … а) при понижении температуры б) при увеличении концентрации в) при применении катализатора г) при уменьшении концентрации д) по мере протекания реакции |
|
|
11. Реакция называется фотохимической, если... а) молекула исходного вещества должна активироваться, поглощая фотон б) она протекает под действием излучения только в видимой области спектра в) она ускоряется при облучении г) исходные вещества разлагаются под действием излучения д) продукты реакции разлагаются под действием излучения |
|
|
12. Максимальная скорость ферментативной реакции зависит от... а) природы растворителя б) атмосферного давления в) рН среды г) температуры д) концентрации фермента |
|
|
13. Константа скорости гомогенной химической реакции в растворе зависит от … а) концентраций реагирующих веществ б) перемешивания в) концентрации катализатора г) температуры д) атмосферного давления |
|
|
14. Изотонический коэффициент сульфата калия будет наименьшим в растворе с концентрацией: а) 1моль/л б) 0,5 моль/л в) 10 моль/л г) 0,1 моль/л д) 0,01 моль/л |
|
|
15. Как изменяется температура кипения при повышении концентрации растворенного вещества? а) увеличивается б) уменьшается в) остается неизменной г) зависит от природы веществам |
|
|
16. Как изменяется температура плавления при повышении концентрации растворенного вещества? а) увеличивается б) уменьшается в) остается неизменной г) зависит от природы веществам |
|
|
17. Гипотоническими растворами по отношению к 0,9% раствору поваренной соли являются а) 1М раствор хлорида кальция б) 0,1М раствор мочевины в) 0,5М раствор глюкозы г) 0,2М раствор сахарозы д) 2М раствор хлорида натрия |
|
|
18. Вычислите концентрацию ионов кальция над осадком сульфата кальция, контактирующим с раствором сульфата калия 0,002 моль/л с концентрацией 0,01 моль/л? Ks(CaSO4) = 2,5*10-5. А) 2,5∙10-5 б) 5,0∙ 10-3 в) 2,5∙ 10-3 г) 1,8∙ 10-2 д)2,9∙ 10-2 |
|
|
19. Найдите верное определение электроосмоса: а) электрокинетическое явление, возникающее при механическом перемещении дисперсной среды относительно частиц дисперсной фазы; б) электрокинетическое явление перемещения частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля; в) электрокинетическое явление, возникающее при вынужденном перемещении дисперсной фазы относительно дисперсной среды; г) электрокинетическое явление перемещения дисперсной среды относительно дисперсной фазы в электрическом поле. |
|
|
20. Электролит с наименьшим порогом коагуляции по отношению к золю, мицеллы которого имеют следующее строение: {mCaSO4 nCa2+ 2(n-x) Cl-}2xCl-: (ответ – комбинация букв) а) хлорид алюминия; б) сульфат магния; НЕТ ОТВЕТА в) гексацианоферрат (II) калия; г) фосфат натрия. |
|
|
Вопрос 18. 1. Ультрафильтрацию коллоидных растворов применяют с целью: а) концентрирования растворов; б) очистки от грубодисперсных примесей; в) очистки от любых примесей; г) очистки от молекул и ионов низкомолекулярных веществ; д) повышения устойчивости золя. |
|
|
2. Какие факторы влияют на интенсивность рассеяния света в золях? а) размер коллоидных частиц; б) интенсивность падающего света; в) соотношение плотностей дисперсионной фазы и дисперсной среды; г) частичная концентрация коллоидного раствора; д) длина волны падающего света; |
|
|
3. В каких из перечисленных систем могут самопроизвольно протекать процессы в стандартном состоянии (в нейтральном водном растворе): а) KMnO4 + FeCl2 → ; б) KMnO4 + КCl → ; в) KMnO4 + KI → ; г) KMnO4 + СоCl2 → ; д) KMnO4 + KBr → . если φro ( MnO4- +8H+/Mn2+ +4H2O ) = +1,51В; φro (I2/2I-) = +0,54В; φro(Br2/2Br-) = +1,09В; φro(CI2/2CI-) = +1,36В; φro(Fe3+/Fe2+) = +0,77В; φro(Co3+/Co2+) = +1,81В. |
|
|
4. В стандартном состоянии йод может окислить: а) МnO42- до МnO4- б) Cr2+ до Cr3+; г) Sn2+ до Sn4+; в) Fе2+ до Fе3+; д) Со0 до Со2+. если значения стандартных электродных потенциалов равны, соответственно: φro (I2/2I-) = +0,54 В; φro (Fе3+/ Fе2+) = +0,77 В; φro (MnO4-/MnO42-) = +0,56 В; φro (Sn4+/ Sn2+) = +0,56 В; φro (Cr3+/ Cr2+) = - 0,41 В; φro (Со2+/ Со0) = - 0,29 В; |
|
|
5. Определите направление процесса 2Fе3+ + Sn2+→ 2Fе2+ + Sn4+ если значения стандартных электродных потенциалов равны, соответственно: φro (Fе3+/ Fе2+) = +0,77 В; φro (Sn4+/ Sn2+) = +0,56 В; а) процесс не идет; б) процесс идет самопроизвольно; в) процесс идет при избытке ионов Fе3+; г) процесс идет при избытке ионов Fе2; д) процесс идет при избытке ионов Sn 2+ |
|
|
6. Какие ионы нельзя восстановить бромид-ионом в стандартном состоянии: а) кобальт (III); б) железо (III); в) марганец (III); г) таллий (III); φro (Br2/ 2Br -) = +1,09 В; φro (Mn3+/ Mn2+) = +1,51 В φro (Co3+/ Co) = +0,46 В; φro (TI3+/ TI) = +1,25 В φro (Fe3+/ Fe) = -0,04 В; |
|
|
7. Укажите причины, по которым нельзя приготовить титрант – раствор гидроксида натрия по точной массе исходного вещества: а) содержание примеси карбоната натрия; б) незначительная растворимость гидроксида натрия; в) содержание влаги в твердом гидроксиде натрия; г) летучесть гидроксида натрия. |
|
|
8. Укажите возможные причины возникновения ошибочных результатов титрования: а) титрование с воронкой, находившейся в бюретке при титровании; б) добавление избыточного количества индикатора; в) при отборе аликвотной доли из пипетки не был до конца удален раствор; г) не был удален воздух из носика бюретки; |
|
|
9. Выберите методы оксидиметрического титрования: а) дихроматометрия г) ацидиметрия б) броматометрия д) иодиметрия в) алкалиметрия |
|
|
10. Какое вещество можно определить обратным перманганатометрическим титрованием? а) пероксид водорода г) хлороводород б) хромат калия д) гидроксид калия в) сульфит калия |
|
|
11. Среди перечисленных ниже веществ выберите те, которые могут быть использованы как первичные стандарты в кислотно-основном титровании: а) декагидрат карбоната натрия г) серная кислота б) карбонат аммония д) гидроксид калия в) дигидрат щавелевой кислоты |
|
|
12. Укажите вещество, которое можно определить прямым способом как кислотно-основного, так и окислительно-восстановительного титрования: а) гидроксид калия г) дихромат калия б) пероксид водорода д) уксусная кислота в) щавелевая кислота |
|
|
13. Определите фактор эквивалентности бромата калия в реакции: КВrO3 + 5КВr + 6НCl → 3Вr2 + 6КCl + 3Н2O а) 1/1; б)1/2; в)1/3; г) 1/4; д)1/5 |
|
|
14. Способ титрования, когда к определяемому раствору добавляют заведомо избыточный, но точно отмеренный объем раствора известной концентрации и избыток реактива оттитровывают титрантом, называется: а) прямое титрование; б) кислотно-основное титрование; в) обратное титрование; г) оксидиметрия; д) титрование заместителя. |
|
|
17. Какие воздействия на внутреннюю среду эритроцитов увеличивают величину с(гемоглобинат + оксигемоглобинат):с(гемоглобин + оксигемоглобин)? а) Насыщение кислородом б) Уменьшение рН в) Насыщение углекислым газом г) Увеличение концентрации ионов ОН- д) Увеличение доли ионизированных форм фосфолипидов мембраны эритроцита |
|
|
Вопрос 19. 1. Критерием наступления равновесия в закрытой системе в изобарно-изотермических условиях является: а) уменьшение энергии Гиббса г) минимальное значение энергии Гиббса б) увеличение энергии Гиббса д) максимальное значение энтропии в) увеличение энтропии |
|
|
2. Найдите верное утверждение относительно понятия «стационарное состояние термодинамической системы»: а) равновесное состояние, при котором все свойства постоянны во времени и в системе отсутствуют потоки вещества и энергии; б) равновесное состояние, при котором все свойства постоянны во времени, имеются потоки вещества и энергии; в) неравновесное состояние, при котором свойства системы меняются со временем г) неравновесное состояние, при котором свойства системы постоянны во времени, имеются потоки вещества и энергии; д) статическое состояние закрытой системы, при которой все свойства постоянны во времени. |
|
|
3. Выразите константу равновесия реакции: СО2(г) + С(тв) → 2СО(г) через константы равновесия реакций: О2(г) + С(тв) → СО2 (г) ( К1) 2СО2(г) → 2СО(г) + О2(г) ( К2) а) К=К1*К22 б) К= 1/К1К22 в) К=К1*К2 г) К=К1К2 д) К= 1/К1К2 |
|
|
4. 1) С(тв) + О2(г) → СО2(г) ; - Δ Н 2) N2(г) + 3Н2(г) → 2NН3(г) ; - Δ H В каком случае теплота химической реакции является стандартной теплотой образования продукта: а) 1, б) 2, в) 1 и 2, г) в обоих реакциях не является. |
|
|
5. Какие термодинамические характеристики являются экстенсивными параметрами системы? а) энтальпия г) химический потенциал б) энергия Гиббса д) внутренняя энергия в) стандартная энтропия |
|
|
6. Осмотическое давление – это а) минимальное гидравлическое давление, которое нужно приложить к раствору, чтобы осмос прекратился б) давление молекул растворителя на полупроницаемую мембрану в) давление раствора на полупроницаемую мембрану г) сила, которая необходима, чтобы началась диффузия через полупрониаемую мембрану |
|
|
7. Выберите верные утверждения: Коллигативные свойства раствора а) не зависят от химической природы растворенных частиц б) зависят от химической природы растворенных частиц в) не зависят от концентрации г) зависят от концентрации д) зависят от числа частиц растворенного вещества |
|
|
8. Выберите верные утверждения: К коллигативным свойствам относятся а) осмотическое давление б) давление насыщенного пара в) понижение температуры замерзания г) понижение давления насыщенного пара д) осмос |
|
|
9. Выберите верные утверждения: К коллигативным свойствам не относятся: а) осмотическое давление б) температура замерзания в) повышение температуры кипения г) осмолярность д) давление насыщенного пара |
|
|
10. При приеме горячей ванны кожа на пальцах сморщивается. На каком явлении это основано? а) лизис б) плазмолиз в) гемолиз г) изоосмос |
|
|
11. Расположите приведенные ниже системы в порядке увеличения в них концентрации ионов гидроксония. (Ответ – комбинация букв). а) Сыворотка крови б) Желудочный сок БВАГ в) Раствор хлороводорода с концентрацией 10-6 моль/л г) Раствор гидроксида калия с концентрацией 10-6 моль/л |
|
|
12. рН водного раствора смеси слабых и сильных кислот определяется как а) Потенциальная кислотность б) Общая кислотность г) Суммарная концентрация всех кислот в) Активная кислотность д) Сумма потенциальной и активной кислотности |
|
|
13. Какие воздействия, оказываемые на водный раствор ацетата натрия, уменьшают степень его гидролиза? а) Удаление части воды б) Увеличение температуры в) Уменьшение концентрации ацетата натрия г) Добавление гидроксида натрия д) Добавление хлорида натрия |
|
|
14. Какие частицы связывают ионы водорода при поступлении в кровь кислот? а) Гемоглобинат-ион б) Дигидрофосфат-ион в) Гидрокарбонат-ион г) Оксигемоглобин д) Хлорид-ион |
|
|
15. В какой последовательности увеличиваются значения степени ионизации приведенных ниже электролитов в их растворах с концентрацией 0,01 моль/л? (Ответ – комбинация букв). а) Пропионовая кислота (Ка = 1,35*10-5) б) Фенол (Ка = 1*10-10) БГАВ в) Бензойная кислота (Ка = 6,31*10-5) г) Угольная кислота (H2O + CO2) (Ка = 4,26*10-7) |
|
|
Вопросы 20 – 25 на соответствие. Вопрос 20. 1. Найдите соответствие между типом протолитической системы и способом ее получения: 1) 1 ммоль H2PO4– + 1 ммоль KOH; а) раствор гидролизующейся соли; 2) 1 ммоль H2PO4– + 3 ммоль KOH; б) раствор, содержащий буферную 3) 1 ммоль H2PO4– + 0,5 ммоль NaOH; систему; в) раствор соли, гидролиз которой подавлен сильным основанием. 1А 2В 3Г |
|
|
2. Для приведенных протолитических реакций найдите соответствующие им названия реакций, использующиеся в теории кислот и оснований Аррениуса: 1) Н2РО4– + Н2О → Н3О+ + НРО42–; 2) НРО42– + Н2О → Н2РО4– + ОН–; 1В 2А 3Б 3) НРО42– + ОН– → Н2О + РО43–; а) гидролиз; б) нейтрализация; в) ионизация слабой кислоты; г) ионизация слабого основания |
|
|
3. Найдите соответствие между конкретной протолитической реакцией и ее названием, использующимися в теории кислот и оснований:
|
|
|
4. Для приведенных протолитических реакций найдите соответствующие им названия процессов: 1) Н2РО4– + Н2О → НРО42– + Н3О+; 1В 2А 3Б 2) НСО3– + ОН– → СО32– + Н2О; 3) НСО3– + Н3О+ → СО2 + 2Н2О; а) нейтрализация анионной формы кислоты; б) нейтрализация анионной формы основания; в) ионизация анионной формы кислоты; г) ионизация анионной формы основания. |
|
|
5. Найдите соответствие между значениями рН, которые нужно поддерживать примерно постоянными (правый столбик) и буферными системами (левый столбик) , которые можно для этой цели применять. а) ацетатная буферная система 1) рН 9,1 б) фосфатная буферная система (H2PO4-/HPO42-) 2) рН 8,5 1В 2Б 3А в) аммиачная буферная система 3) рН 5,5 |
|
|
6. Найдите соответствие между типом протолитической системы ( правый столбец) и способом ее получения (левый столбец). а) 1 ммоль NH3 + 2 ммоль HCl б) 2 ммоль NH3 + 1 ммоль HCl в) 1 ммоль NH3 + 1 ммоль HCl 1В 2Б 3А 1) раствор гидролизующейся соли 2) буферная система 3) раствор соли, гидролиз которой подавлен сильной кислотой |
|
|
7. Найдите соответствие между типом протолитической системы ( правый столбец) и способом ее получения (левый столбец). а) 10 ммоль CH3COOH + 0,5 ммоль NaOH б) 10 ммоль CH3COOH + 5 ммоль NaOH в) 10 ммоль CH3COOH + 10 ммоль NaOH 1Б 2В 3А 1) буферная система 2) раствор гидролизующейся соли 3) раствор слабой кислоты, гидролиз которой подавлен одноименным ионом |
|
|
8. Подберите для буферных систем (левый столбец) их значение для живых систем (правый столбец) а) гидрокарбонатная 1Б 2А 3В б) гемоглобиновая в) ацетатная 1) поддерживает рН только в эритроцитах 2) поддерживает рН и в плазме, и в эритроцитах 3) в организме не функционирует |
|
|
9. Для приведенных в левом столбце протолитических полуреакций найдите в правом столбце соответствующее описание функции аниона. а) HCO3- + H2O → б) NO3- + H2O → 1Б 2АВ 3- в) HSO3- + H2O → 1) анион не является ни кислотой, ни основанием 2) анион является преимущественно кислотой 3) анион является преимущественно основанием |
|
|
10. Для приведенных в левом столбце протолитических реакций найдите в правом столбце соответствующие им названия реакций, использующиеся в теории кислот и оснований Аррениуса а) H2PO4- + H2O → H3O+ + HPO42- б) H2PO4- + H2O → H3PO4 + OH- в) H2PO4- + OH- → H2O + HPO42- 1) гидролиз соли 1Б 2В 3А 2) нейтрализация 3) ионизация слабой кислоты |
|
|
11. Для сопряженных протолитических пар, приведенных в правом столбце, подберите в левом столбце утверждение относительно способности составляющих их кислот и оснований проявлять в водном растворе свойства амфолитов. а) Амфолитами являются и основание, и кислота б) Амфолит – только кислота в) Амфолит – только основание 1Б 2В 3А 1) HS- /S2- 2) +NH3CH2COOH/ +NH3CH2COO- 3) H2PO4-/HPO42- |
|
|
12. В правом столбце подберите те значения рН, которыми характеризуются водные растворы солей, перечисленных в левом столбце а) NH4CN б) NH4CH3COO в) NH4F 1А 2- 3БВ 1) pH = 7 2) pH > 7 3) pH < 7 |
|
|
13. Для приведенных в левом столбце протолитических реакций найдите в правом столбце соответствующие им названия реакций, использующиеся в теории кислот и оснований Аррениуса а) HPO42- + OH- → H2O + PO43- б) HPO42- + H2O → H3O+ + PO43- в) HPO42- + H2O → H2PO4- + OH- 1) гидролиз 1В 2Б 3А 2) ионизация слабой кислоты 3) нейтрализация |
|
|
14. Подберите для индикаторов (левый столбец) форму их существования в водном растворе с рН 5,8 (правый столбец). а) метиловый оранжевый б) метиловый красный в) фенолфталеин 1В 2А 3Б 1) практически только в молекулярной форме 2) практически только в ионизированной форме 3) и в молекулярной, и в ионизированной формах |
|
|
15. Для сопряженных протолитических пар, приведенных в правом столбце, подберите в левом столбце утверждение относительно способности составляющих их кислот и оснований проявлять в водном растворе свойства амфолитов. а) кислота и основание (амфолит) б) кислота (амфолит) и основание (амфолит) в) кислота (амфолит) и основание 1) H2PO4-/HPO42- 1Б 2В 3А 2) +NH3CH2СOO-/ NH2CH2COO- 3) +NH3CH2CH2NH3+/+NH3CH2CH2NH2 |
|
|
16. Для приведенных в левом столбце протолитических реакций найдите в правом столбце соответствующие им названия реакций, использующиеся в теории кислот и оснований Аррениуса а) HB+ + H2O → B + H3O+ б) A- + H2O → HA + OH- в) HA + H2O → A- + H3O+ 1) гидролиз по катиону 1А 2В 3Б 2) ионизация слабой кислоты 3) гидролиз по аниону |
|
|
17. Для приведенных в левом столбце протолитических полуреакций найдите в правом столбце соответствующее описание функции аниона. а) HPO42- + H2O → б) H2PO4- + H2O → в) Cl- + H2O → 1) анион не является ни кислотой, ни основанием 1В 2Б 3А 2) анион является преимущественно кислотой 3) анион является преимущественно основанием |
|
|
18. Найдите соответствие между типом протолитической системы (правый столбец) и способом ее получения (левый столбец). а) 1 ммоль Na2HPO4 + 2 ммоль HCl б) 2 ммоль Na2HPO4 + 1 ммоль HCl в) 1 ммоль Na2HPO4 + 1 ммоль HCl 1В 2Б 3А 1) раствор гидролизующейся соли 2) буферная система 3) раствор слабой кислоты |
|
|
19. Найдите соответствие между типом протолитической системы ( правый столбец) и способом ее получения (левый столбец). а) 10 ммоль HF + 0,5 ммоль NaOH б) 10 ммоль HF + 5 ммоль NaOH в) 10 ммоль HF + 10 ммоль NaOH 1Б 2В 3А 1) буферная система 2) раствор гидролизующейся соли 3) раствор слабой кислоты, гидролиз которой подавлен одноименным ионом |
|
|
20. Найдите соответствие между типом протолитической системы ( правый столбец) и способом ее получения (левый столбец). а) 1 ммоль Na2CO3 + 2 ммоль HCl б) 2 ммоль Na2CO3 + 1 ммоль HCl в) 1 ммоль Na2CO3 + 1 ммоль HCl 1В 2Б 3А 1) раствор гидролизующейся соли 2) буферная система 3) раствор слабой кислоты |
|
|
Вопрос 21. 1. Подберите соответствующие описания выражений для их записи в общем виде: 1) с = √Ks; 1А 2Б 2) с = 3√Ks/4. а) расчет равновесной концентрации ионов в насыщенном растворе малорастворимого соединения типа МА; б) расчет равновесной концентрации ионов в насыщенном водном растворе малорастворимого соединения типа МА2; в) расчет равновесной концентрации ионов в насыщенном водном растворе малорастворимого соединения типа М2А3; г) расчет растворимости малорастворимого соединения типа МА; д) термодинамические условия выпадения осадка. |
|
|
2. Подберите соответствующие описания процессов для их записи в общем виде: 1) Ks (MA) > Ks (MB) 1А 2Б 2) Ks (M1B) > Ks (M2B) а) конкуренцию за общий катион выигрывает анион, который образует менее растворимое соединение; б) конкуренцию за общий анион выигрывает катион, который образует менее растворимое соединение; в) изоморфное замещение; г) образование твердой фазы при сливании двух растворов электролитов; д) влияние одноименного иона. |
|
|
3. Дайте соответствующие описания следующих выражений для их записей в общем виде: 1) Ks = а (М+) а (А-); 1Б 2Г 2) с˜(М+) = с˜(А-) = √Ks; а) константа равновесия гетерогенного процесса; б) константа растворимости для вещества МА в насыщенном растворе; в) термодинамические условия выпадения осадка; г) расчет равновесной молярной концентрации ионов в насыщенном растворе малорастворимого электролита типа МА; д) расчет растворимости вещества. |
|
|
4. Дайте соответствующие описания следующих процессов: 1) с (Ва2+) с (SO42-) = Кs (BaSO4); 2) с(Ва2+) с(SO42-) = Пс (ВаSO4) а) в системе не образуется осадок ВаSO4; б) выражение для расчета произведения концентраций; 1Г 2Б в) в системе образуется осадок ВаSO4; г) в системе образуется насыщенный раствор; д) конкуренция за общий анион. |
|
|
5. Подберите следующие описания выражений для их записи в общем виде: 1) Ks = c˜2 (M+) c˜ (A-) 2) c˜ =3√ Кs / 4. 1Б 2Г а) математическое выражение константы растворимости малорастворимой соли состава МА; б) математическое выражение константы растворимости малорастворимой соли состава М2А; в) расчет равновесной концентрации ионов в насыщенном растворе малорастворимого электролита типа М3А2; г) расчет равновесной молярной концентраций ионов в насыщенном растворе малорастворимого электролита типа М2А; д) расчет растворимости малорастворимого электролита типа МА. |
|
|
6. Выберите выражение для 1) константы устойчивости 2) константы нестойкости комплексного иона: триоксалатоманганат (III): а) с~(Mn3+) * c~(C2O42-) / c~[Mn(C2O4)3]3- б) c~[Mn(C2O4)3]3- / c~(Mn3+) *c~3(C2O42-) 1Б 2В в) с(Mn3+) * c3(C2O42-) / c([Mn(C2O4)3]3-) г) c(Mn3+) * c(C2O4)2- / c([Mn(C2O4)]+) |
|
|
7. Найдите название для комплексного иона: 1) [BiI6]3- 2) [Fe(H2O)2(SCN)4]- 1Б 2В 3Д 3) [Cd(CN)3Cl]2- а) трицианохлорокадмий (II) б) гексаиодовисмутат (III) в) диакватетратиоцианатоферрат (III) г) тетратиоцианодиакваферрат (III) д) трицианохлорокадмиат (II) |
|
|
8. Выберите тип связи между 1) центральным атомом и лигандами 2) внутренней и внешней сферой комплекса: 1Г 2А а) ионная б) водородная в) ковалентная неполярная г) ковалентная полярная д) металлическая |
|
|
9. Выберите конфигурацию комплекса для случая 1) sp3 2) d2sp3 гибридизации атомных орбиталей центрального атома 1Г 2Б а) пирамида б) октаэдр в) плоский квадрат г) тетраэдр д) линейная |
|
|
10. Установите соответствие типа реакции, в которой участвует комплекс 1) [Cu(NH3)4]SO4 + BaCl2 = [Cu(NH3)4]Cl2 + BaSO4 2) 2K4[Fe(CN)6] + Cl2 = 2K3[Fe(CN)6] + 2KCl 3) [Ag(NH3)2]Cl + 2KCN = K[Ag(CN)2] + KCl + 2NH3 а) ионообменная б) соединения в) замещения лиганда 1А 2Д 3В г) кислотной диссоциации д) окислительно – восстановительная |
|
|
11. Отнесите комплекс к определённому классу: 1) [Cr(C6H6)2] 2) ) [Cu(NH3)4]SO4 3) [Са(NH2CH2COO)2] 1Д 2А 3Г а) электролит б) полиядерный в) макроциклический г) хелатный д) металлоцены (сэндвичевые) |
|
|
12. Укажите возможность образования комплексов ионами: 1) железа (III) 2) калия с лигандами а) SCN- б) СN- 1АБВГ 2Д в) F- г) H2ЭДТА2- д) дибензо-18-краун-6 (краун-эфир) |
|
|
13. Найдите названия для комплексных ионов: 1) [Fe(CN)6]4- 2) [Fe(SCN)6]3- 3) [Fe(H2O)6]3+ а) гексацианоферрат (II) 1А 2В 3Г б) гексатиоцианатоферрат (II) в) гексатиоцианатоферрат (III) г) гексаакважелезо (III) д) гексацианоферрат (III) |
|
|
14. Определите заряд комплексного иона в: 1) хлориде нитратопентамминхрома (III) 2) хлороаквадиамминпалладий (II) а) 0 б) +1 1В 2Б в) +2 г) +3 д) -1 |
|
|
15. Найдите соответствие: центральный атом – комплексное соединение: 1) Mg (II) а) Витамин В12 2) Co (III) б) гем 1В 2А 3Г 3) Fe (II) в) хлорофилл |
|
|
16. Отнесите комплекс к определенному классу: 1) [Ni(NH3)6]Cl2 2) K4[Fe(CN)6] 3) CаЭДТА2- 4) [Co(NH3)3Cl3] 1А 2А 3Г 4Б а) электролиты б) неэлектролиты в) макроциклы г) хелаты д) металлоцены (сэндвичевые) |
|
|
17. Какие комплексные соединения имеют: а) хелатообразующие лиганды ; б) макроциклические лиганды: 1) глицинат меди; 2) тетраэтилентетрамин никеля ( II); - 3) валиномицин ( полиэфир 18-краун-6 с катионом калия); А1,5 Б2,3 4) гексатиоцианатоферрат (III) ; 5) тетацин . |
|
|
18. Отнесите комплекс к определенному классу: 1) [Cо(C6H6)2] 2) K3[[Fe(SCN)6] 1Б 2А 3Г 4Д 3) [Мg(NH2CH2COO)2] 4)[ Ni (CO)5 ] а) электролиты б) металлоцены в) макроциклы г) хелаты д) неэлектролиты |
|
|
19. Определите заряд комплексного иона в: а) трицианохлорокадмий (II) б) гексаиодовисмутат (III) в) диакватетратиоцианатоферрат (III) 1) +1 2) -2 А2 Б4 В5 3) +3 4) -3 5) -1 |
|
|
20. Определите заряд комплексного иона в: 1) бромиде тетрамминхрома (III) 2) хлороаквадиамминникеля (II) а) 0 б) +1 в) +2 1Г 2Б г) +3 д) -1 |
|
|
Вопрос 22. 1. При введении в водный раствор поверхностно-активного вещества 1) полярного адсорбента; 2) неполярного адсорбента: происходит: а) адсорбция молекул растворителя; 1Г 2Б б) удаление растворенного вещества из водной фазы; в) выравнивание разностей полярностей в комплексе адсорбент-растворитель; г) адсорбция ПАВ; д) растворение адсорбента. |
|
|
2. После проведения эксперимента по предложенным формулам можно рассчитать:
а) P = kS ; б) a = P/Ps; 1Д 2В в) а = ∆cV/m ; г) А = (c0 - c)/cm ; д) Р = kl . |
|
|
3. Какие из приведенных веществ по отношению к воде являются:
а) бутанол-1; 1ВД 2АГ б) сахароза; в) соляная кислота; г) масляная кислота; д) хлорид кальция. |
|
а) различается на длину метиленовой группы; б) различается в 2 раза; в) одинакова; г) различается на диаметр гидроксильной группы; д) различается на длину двух гомологических разностей. |
|
|
5. Найдите соответствие характера примесей коллоидного раствора и методов очистки: 1) грубодисперсной примеси; 2) молекул и ионов низкомолекулярных веществ; а) диализ; б) фильтрация; 1Б 2АВГ в) электродиализ; г) ультрафильтрация. |
|
|
6. Какими методами получены в лабораторной работе золи: 1) гексацианоферрата (II) меди (II); 2) серебра; а) химическая конденсация (реакция гидролиза); б) химическая конденсация (реакция обмена); 1Б 2В в) химическая конденсация (окислительно- восстановительная реакция); г) физическая конденсация (замена растворителя); д) физико – химическая диспергирование (пептизация). |
|
|
7. Какие электрокинетические явления наблюдаются при механическом перемещении: 1) частиц дисперсной фазы относительно дисперсионной среды; 2) дисперсионной среды относительно частиц дисперсной фазы? 1А 2Б а) электрофорез; б) электроосмос; в) потенциал протекания; г) потенциал седиментации. |
|
|
8. Какими методами получены в лабораторной работе золи: 1) серебра; 2) берлинской лазури; а) химическая конденсация (реакция гидролиза); б) химическая конденсация (реакция обмена); 1В 2Д в) химическая конденсация (окислительно- восстановительная реакция); г) физическая конденсация (замена растворителя); д) физико – химическое диспергирование (пептизация). |
|
|
9. Подберите в правом столбце типы систем, для которых величина среднего эквивалентного диаметра частиц дисперсной фазы перечислена в левом столбце: 1) 10-9 ‹ d ‹ 10-7м; а) коллоидно-дисперсные; 2) d ‹ 10-9м; б) суспензии; 1А 2Г 3В 3) 10-7 ‹ d ‹ 10-5м; в) грубодисперсные; г) истинные растворы низкомолекулярных веществ; д) аэрозоли. |
|
|
10. Найдите соответствие названия системы и агрегатного состояния фаз (в числителе указано состояние фазы, в знаменателе – среды). 1) пыль; а) ж/т; 2) кровь; б) т/ж; 3) туман; в) т/г; 1В 2Д 3Г г) ж/г; д) ж/ж. |
|
|
11. Найдите соответствие названия системы и агрегатного состояния фаз (в числителе указано состояние фазы, в знаменателе – среды): 1) дым; а) г/ж; 2) молоко; б) т/ж; 1В 2Б 3А 3) мыльная пена; в) т/г; г) ж/г; д) ж/ж. |
|
|
12. Установите соответствие между приведёнными величинами и единицами их измерения:
г) м-1; д) моль/м. |
|
|
13. Установите соответствие между веществом, растворенным в воде, и его поверхностной активностью: 1) сахароза 2) изоамиловый спирт 1Д 2А 3А 3) олеиновая кислота а) уменьшает поверхностное натяжение воды, является поверхностно-активным б) уменьшает поверхностное натяжение воды, является поверхностно-неактивным в) повышает поверхностное натяжение воды, является поверхностно-активным г) повышает поверхностное натяжение воды, является поверхностно-инактивным д) не изменяет поверхностное натяжение воды, является поверхностно-неактивным |
|
|
14. Установите соответствие между веществом, растворенным в воде, и его поверхностной активностью: 1) лаурилсульфат натрия 2) хлорид натрия 1А 2Г 3Г 3) аминоуксусная кислота а) уменьшает поверхностное натяжение воды, является поверхностно-активным б) уменьшает поверхностное натяжение воды, является поверхностно-неактивным в) повышает поверхностное натяжение воды, является поверхностно-активным г) повышает поверхностное натяжение воды, является поверхностно-инактивным д) не изменяет поверхностное натяжение воды, является поверхностно-неактивным |
|
|
15. Установите соответствие между названиями и сущностью явлений, происходящих при коагуляции золей смесями электролитов: 1) синергизм а) ослабление действия одного иона другим 1Г 2А 3Б 2) антагонизм б) суммирование действия ионов 3) аддитивность в) взаимная коагуляция ионов г) усиление действия одного иона другим д) чередование зон коагуляции |
|
|
16. Установите соответствие между веществом, растворенным в воде, и его поверхностной активностью: 1) глицерин 1Г 2А 3А 2) этилацетат 3) пропановая кислота а) уменьшает поверхностное натяжение воды, является поверхностно-активным б) уменьшает поверхностное натяжение воды, является поверхностно-неактивным в) повышает поверхностное натяжение воды, является поверхностно-активным г) повышает поверхностное натяжение воды, является поверхностно-инактивным д) не изменяет поверхностное натяжение воды, является поверхностно-неактивным |
|
|
17. Установите соответствие между веществом, растворенным в воде, и его поверхностной активностью: 1) гидроксид натрия 1Г 2Д 3А 2) сахароза 3) белок а) уменьшает поверхностное натяжение воды, является поверхностно-активным б) уменьшает поверхностное натяжение воды, является поверхностно-неактивным в) повышает поверхностное натяжение воды, является поверхностно-активным г) повышает поверхностное натяжение воды, является поверхностно-инактивным д) не изменяет поверхностное натяжение воды, является поверхностно-неактивным |
|
|
18. Установите соответствие между веществом, растворенным в воде, и его поверхностной активностью: 1) фенол 1А 2Г 3А 2) глицерин 3) стеарат натрия а) уменьшает поверхностное натяжение воды, является поверхностно-активным б) уменьшает поверхностное натяжение воды, является поверхностно-неактивным в) повышает поверхностное натяжение воды, является поверхностно-активным г) повышает поверхностное натяжение воды, является поверхностно-инактивным д) не изменяет поверхностное натяжение воды, является поверхностно-неактивным |
|
|
19. Установите соответствие между названиями графических зависимостей и выражениями y = f (x):
а) y = f (c(равн.)); б) Г = f (c(средн.)); 1Д 2Б в) 1/а = f (1/c); г) lg a = f (lg c); д) σ = f(c) . 20. При графическом методе нахождения численных значений констант в уравнении Лэнгмюра по зависимости 1/а = f (1/с) численному значению констант соответствуют:
а) отрезок, отсекаемый прямой на оси ординат; 1В 2А(Б) б) обратная величина отрезка, отсекаемого прямой на оси ординат; в) тангенс угла наклона прямой к оси абсцисс; г) произведение численных значений тангенса угла наклона и максимальной адсорбцию |
|
|
Вопрос 23.
а) Na2C2O4 б) NaHSO3 в) NaNO3 г) KBr д) Fe 2(SO4)3 |
|
а) нитрат; б) ацетат; в) сульфит; г) тиосульфат |
|
|
3. Укажите аналитический эффект, наблюдаемый при добавлении подкисленного раствора перманганата калия по отдельности к растворам: 1) нитрита натрия; а) обесцвечивание раствора; 2) оксалат натрия; б) образование осадка; 1А 2В в) обесцвечивание раствора и выделение газа; г) аналитический эффект отсутствует. |
|
|
4. Укажите аналитический эффект, наблюдаемый при добавлении соляной кислоты к раствору:
в) выделение бурого газа и образование осадка; г) выделение бесцветного газа, буреющего на воздухе; 1Г 2Б д) аналитический эффект отсутствует. |
|
|
5. Для аналитических эффектов, наблюдаемых при действии групповых реактивов, выберите соответствующие растворы солей: 1) бромная вода обесцвечивается 2) выделение брома при добавлении к бромиду натрия 1АВД 2Б а) Na2S2O3 б) K2Cr2O7 в) K2S г) CaCO3 д) FeSO4 |
|
|
6. Выберите подходящие методы и способы титрования для решения следующих задач: а) определение массы серной кислоты в пробе; б) определение молярной концентрации пероксида водорода в растворе. 1) обратное перманганатометрическое титрование; 2) прямое ацидиметрическое титрование; А4 Б3 3) прямое перманганатометрическое титрование; 4) прямое алкалиметрическое титрование. |
|
|
7. Найдите соответствия между областью рН, в которой заканчивается титрование, и конкретной аналитической задачей: а) рН > 7 б) рН < 7 А3 Б5 В1 в)рН = 7 1) определяемое вещество NаОН, титрант – НNO3; 2) определяемое вещество СН3СООNа , титрант – NаОН; 3) определяемое вещество СН3СООН, титрант – NаОН; 4) определяемое вещество NH4Cl, титрант – КОН; 5) определяемое вещество NН3, титрант – Н2SО4. |
|
|
8. Выберите подходящие методы и способы титрования для решения следующих задач: а) определение массовой доли гидроксида натрия в растворе; б) определение массы оксалата натрия в растворе. 1) прямое алкалиметрическое титрование; А2 Б3 2) прямое ацидиметрическое титрование; 3) прямое перманганатометрическое титрование; 4) обратное ацидиметрическое титрование; 5) обратное перманганатометрическое титрование. |
|
|
9. Выберите подходящие методы и способы титрования для решении: следующих задач: а) определение массовой доли железа в образце сульфата железа (II); б) определение молярной концентрации уксусной кислоты в растворе. 1) прямое ацидиметрическое титрование; 2) прямое перманганатометрическое титрование; 3) обратное перманганатометрическое титрование; А2 Б4 4) прямое алкалиметрическое титрование; 5) обратное алкалиметрическое титрование. |
|
|
10. Найдите соответствия между областью рН, в которой заканчивается титрование, и конкретной аналитической задачей: а) рН > 7 б) рН < 7 в) рН = 7 1) определяемое вещество КОН, титрант – НСl; 1В 2В 3А 4В 5Б 2 ) определяемое вещество НNO3 , титрант – NаОН; 3) определяемое вещество СН3СООН, титрант – NаОН; 4) определяемое вещество NаНSО4, титрант – КОН; 5) определяемое вещество NН3, титрант – НСl. |
|
|
11. Найдите соответствия между областью рН, в которой заканчивается титрование, и конкретной аналитической задачей: а) рН = 7 б) рН < 7 в) рН > 7 1) определяемое вещество – NаНСО3, титрант – НСl; А2 Б1 В4 2) определяемое вещество – Ва(ОН)2. титрант – НNO3; 3) определяемое вещество – NH3, титрант – Н2SO4 4) определяемое вещество – НСООН, титрант – КОН; 5) определяемое вещество – NН4Сl, титрант – NaОН. |
|
|
12. Выберите подходящие методы и способы титрования для решения следующих задач: а) определение массы гидрокарбоната натрия в растворе; б) определение массовой доли пероксида водорода в растворе. А2 Б1
|
|
|
13. Подберите соответствующие описания процессов для записи их в виде следующих уравнений: 1) BaCO3 (тв) + Pb2+ → PbCO3 (тв) + Ba2+ 2) Mg2+ + HPO42- + NH3 → MgNH4PO4. 1Г 2Б а) в результате реакции не образуется осадок; б) аналитическая реакция на ион магния; в) изоморфное замещение; г) конкуренция за анион. |
|
|
14. Дайте соответствующие описания процессов для их записей в виде следующих уравнений: 1) PbS (тв) + Cu(NO3)2 (водн) → Pb(NO3)2 (водн) + CuS (тв) 2) Ca5(PO4)3OH + F- → Ca5(PO4)3F + OH- а) конкуренция за катион; б) конкуренция за анион; в) явление изоморфизма; 1Б 2В г) качественная реакция на ион Ca2+; д) влияние одноименного иона на растворимость. |
|
|
15. Подберите соответствующие описания процессов для их записей, в основе которых лежат следующие реакции: 1) 3SrCl2 (p-p) + Ca3(PO4)2 (тв) → Sr3(PO4)2 (тв) + 3CaCl2 (р-р) 2) CaCl2 (p-p) + Na2С2О4 (p-p) → CaС2О4 + 2 NaCl а) выпадение осадка малорастворимого вещества; б) замещение ионов Са2+ в костной ткани, приводящее к повышенной ломкости костей; в) конкуренция за катион; г) совмещенное гетерогенное равновесие; 1Б 2А д) влияние одноименного иона на растворимость. |
|
|
Вопрос 24. 1. Укажите смысл или названия приведенных уравнений а)
1) уравнение Аррениуса 2) уравнение Аррениуса для двух экспериментальных точек 3) кинетическое уравнение 1 порядка 4) кинетическое уравнение нулевого порядка |
|
|
2. Укажите смысл или названия приведенных уравнений а) 1) взаимосвязь между температурным коэффициентом и энергией активации 2) интегрированное уравнение 1 порядка 3) кинетическое уравнение для реакции типа 2А →продукты А2 Б3 В1 4) кинетическое уравнение для реакции типа А + 2В → продукты |
|
|
3. Укажите смысл или названия приведенных уравнений: а)
1) уравнение Аррениуса 2) период полупревращения реакции нулевого порядка А3 Б1 В4 3) период полупревращения реакции второго порядка 4) уравнение Михаэлиса-Ментен |
|
|
4. Укажите смысл или названия приведенных уравнений: а)
1) интегрированное уравнение реакции 1 порядка 2) уравнение Михаэлиса-Ментен 3) интегрированное уравнение реакции 2 порядка А4 Б2 В3 4) уравнение Аррениуса |
|
|
5. Укажите смысл или названия приведенных уравнений а)
1) уравнение Аррениуса для двух экспериментальных точек А2 Б3 В1 2) период полупревращения реакции 1 порядка 3) кинетическое уравнение реакции 3-го порядка 4) период полупревращения реакции нулевого порядка |
|
|
6. Укажите смысл или названия приведенных уравнений а)
1) правило Вант-Гоффа для температурного интервала 30 градусов А4 Б1 В2 2) интегрированное уравнение 1 порядка 3) интегрированное уравнение 2 порядка 4) уравнение теории переходного состояния |
|
|
7. Укажите смысл или названия приведенных уравнений а)
1) период полупревращения реакции нулевого порядка А1 Б2 В3 2) кинетическое уравнение реакции второго порядка 3) уравнение теории переходного состояния 4) период полупревращения реакции второго порядка |
|
|
8. Укажите смысл или названия приведенных уравнений а)
c = co - kt б) v = kc в)
1) уравнение Аррениуса 2) уравнение Михаэлиса-Ментен 3) кинетическое уравнение 1 порядка А4 Б3 В2 4) интегрированное уравнение реакции нулевого порядка |
|
|
9. Укажите смысл или названия приведенных уравнений а)
c=co-kt б)
1) уравнение Аррениуса, преобразованное для расчета температурного коэффициента 2) период полупревращения реакции второго порядка 3) период полупревращения реакции нулевого порядка А4 Б2 В1 4) интегрированное уравнение реакции нулевого порядка |
|
|
10. Укажите смысл или названия приведенных уравнений а)
1) уравнение теории переходного состояния 2) уравнение Михаэлиса-Ментен А4 Б1 В2 3) кинетическое уравнение 1 порядка 4) интегрированное уравнение реакции второго порядка. |
|
|
11. Укажите смысл или названия приведенных уравнений а)
1) период полупревращения реакции нулевого порядка 2) период полупревращения реакции второго порядка 3) дифференциальное кинетическое уравнение 2-го порядка А3 Б2 В1 4) дифференциальное кинетическое уравнение 1-го порядка |
|
|
12. Укажите смысл или названия приведенных уравнений а)
1) период полупревращения реакции нулевого порядка 2) период полупревращения реакции первого порядка А2 Б4 В3 3) кинетическое уравнение скорости реакции 4) уравнение Аррениуса для расчета температурного коэффициента скорости |
|
|
13. Укажите смысл или названия приведенных уравнений а)
1) кинетическое уравнение нулевого порядка А4 Б2 В1 2) интегрированное уравнение 1-го порядка 3) кинетическое уравнение второго порядка 4) уравнение Аррениуса для расчета температурного коэффициента скорости |
|
|
14. Укажите смысл или названия приведенных уравнений а)
1) период полупревращения реакции 1 порядка 2) кинетическое уравнение 3 порядка 3) период полупревращения реакции нулевого порядка А1 Б2 В4 Г3 4) уравнение Аррениуса для двух экспериментальных точек |
|
|
15. Укажите смысл или названия приведенных уравнений а)
1) уравнение теории переходного состояния 2) уравнение Михаэлиса-Ментен 3) кинетическое уравнение 1 порядка 4) интегрированное уравнение реакции второго порядка. А4 Б1 В2 5) период полупревращения реакции второго порядка |
|
|
16. Предложите вероятные характеристики реакций: а) NH3 + H2O → NH4+ + OH- б) Cl2 → Cl· + Cl· в) C3H8 + 5O2 → 3CO2 + 4H2O г) CaCO3 + 2HCl → CaCl2 + CO2 + H2O 1) простая 2) сложная 3) фотохимическая 4) гетерофазная А2 Б3 В1 Г4 |
|
|
17. Предложите вероятные характеристики реакций: а) N2+ H2 → NH3 б) Ag+ + Br- → AgBr в) 2NO2 → N2O4 А4 Б2 В1 Г3 г) H2 + Cl∙ → HCl + Н∙ 1) молекулярная простая 2) ионная 3) радикальная 4) молекулярная сложная |
|
|
18. Предложите вероятные характеристики реакций: а) AgF + KBr → AgBr + KF б) 2H2 + O2 → 2H2O в) 2NO2 → N2O4 г) H2 + Cl2 → 2HCl А2 Б1 В3 Г1 1) цепная простая 2) ионная 3) молекулярная 4) цепная разветвленная |
|
|
19. Предложите вероятные характеристики реакций а) 2H2O → H3O+ + OH- б) 2SO2 + O2 → 2SO3 в) 4Al + 3O2 → 2Al2O3 г) 2O2 → O3 + O 1А 2Б 3Г 4В 1) простая 2) сложная 3) фотохимическая 4) гетерофазная |
|
|
20. Установите единицы измерения констант скорости. а) нулевой порядок б) первый порядок в) второй порядок А4 Б3 В1 Г2 г) третий порядок 1) л*моль–1*с–1 2) л–2*моль–2*с–1 3) 1/с 4) моль*л–1*с–1 |
|
|
Вопрос 25. 1. Для каких растворов с одинаковой молярной концентрацией величина: 1) ионной силы численно равна молярной концентрации; 2) ионной силы раствора минимальна; а) фосфат калия; б) хлорид железа (III) 1ВД 2ВД в) бромид натрия; г) уксусная кислота; д) хлорид аммония. |
|
|
2. При каких воздействиях на раствор сильного электролита: 1) величина коэффициента активности иона в растворе возрастает; 2) величина ионной силы раствора не изменяется; а) добавление сильного электролита в раствор; б) увеличение концентрации данного иона в растворе; 1В 2Г в) разбавление раствора; г) добавление неэлектролита. |
|
|
3. В каком из разбавленных растворов с одинаковой молярной концентрацией электролитов: 1) коэффициент активности иона натрия имеет наименьшее значение; 1Г 2В 2) значение изотонического коэффициента наименьшее; а) Na2SO4 в) CH3COONa б) Na2C2O4 г) Na3PO4 |
|
|
4. Укажите, для каких электролитов в разбавленных растворах: 1) изотонический коэффициент i → 3; 2) ионная сила раствора приблизительно одинакова (при одинаковой концентрации растворов); а) FeCl3; б) FeCl2; 1БГ 2БГ в) CuSO4; г) [Cu(NH3)4]Cl2; |
|
|
5. Установите соответствие между веществом и возможным изотоническим коэффициентом в 0,1М растворе. 1. хлорид натрия 2. фосфат калия 3. нитрат алюминия 4. глюкоза i= а) 0,8 б) 1 в) 1,7 г) 2,75 д) 3,8 е) 4,2 1В 2Д 3Д 4Б |
|
|
6. Водные растворы одинаковых объемов, содержащие:
а) замерзают при одинаковой температуре б) кипят при одинаковой температуре 1Г 2Г в) являются изотоническими г) имеют разное осмотическое давление д) имеют одинаковое давление насыщенного пара |
|
|
7. Водный раствор глюкозы изотоничен плазме крови. Раствор, имеющий такую же концентрацию:
а) изотонический по отношению к плазме крови б) гипотонический по отношению к плазме крови 1В 2А в)гипертонический по отношению к плазме крови г) кипит при более низкой температуре, чем раствор глюкозы д) замерзает при более высокой температуре, чем раствор глюкозы |
|
|
8. Разбавленные водные растворы, содержащие равные молярные концентрации:
а) замерзают и кипят при одинаковой температуре б) замерзают при одинаковой температуре, кипят – при разной 1А 2Г в) кипят при одинаковой температуре, замерзают – при разной г) имеют разное осмотическое давление д) являются идеальными растворами |
|
|
9. Предложите вероятные характеристики реакций а) F2 = F· + F· б) Fe + O2 + H2O → FeO(OH) в) CH3Cl + OH– → CH3OH + Cl– г) H2CO3 = CO32– + 2H+ 1) простая 2) сложная 3) фотохимическая 4) гетерофазная А3 Б2,4 В2 Г1 |
|
|
10. Изменение концентрации в ходе реакции. а) реагент б) продукт в) катализатор г) интермедиат А3 Б1 В2 Г4 1) увеличивается 2) уменьшается и восстанавливается 3) уменьшается 4) увеличивается и потом уменьшается |
|
|
11. Какая роль типична для следующих частиц в реакциях? а) свободный радикал б) ион в) молекула г) бирадикал А1 Б3 В4 Г2 1) ОН 2) OCH2CH2O 3) OH– 4) C6H5CH3 |
|
|
12. Предложите вероятные характеристики реакций: а) H3PO4 → 3H+ + PO43– б) F– + H3O+ → HF + H2O в) N2O4 → 2NO2 г) CH4 + Cl∙ → CH3Cl + Н∙ А3 Б1 В4 Г2 1) ионная 2) радикальная 3) молекулярная сложная 4) молекулярная простая |
|
|
13. Предложите вероятные характеристики реакций: а) 3C2H2 = C6H6 б) CaCl2 + K2C2O4 = CaC2O4 + 2KCl в) 2C2H2 → CH2=CH–C≡CH г) CH3Cl + Cl∙ → CH2Cl2 + Н∙ А2 Б4 В2 Г1 1) радикальная 2) молекулярная сложная 3) молекулярная простая 4) ионная |
|
|
14. Выберите из перечисленных комплексных соединений:1) окрашенные в водном растворе; 2) бесцветные в водном растворе. а) K3[Fe(SCN)6] 1АБВГ 2 Г б) [Ni(NH3)6]Cl2 в) [Cu(NH3)4]SO4 г) [Zn(NH3)4]SO4 д) K[Fe(тартр.)] |
|
|
15. Выберите молекулы или группы атомов, которые могут быть:1) монодентатными ; 2) полидентатными: а) H2O 1АБВ 2 ГД б) CN- в) NH3 г) H2ЭДТА2- д) CH2(NH2)COO- |
|
|
16. Определите заряд центрального атома в комплексах: а ) [Ni(NH3)6]Cl2 1) +1 б) Na3[FeF6] 2) +2 в) [Co(NH3)6]Cl2 3) +3 А2 Б3 В2 Г2 Д3 г) [Cu(Гли-)2] 4) 0 д) K3[Fe(SCN)6] 5) -1 |
|
|
17. Выберите конфигурацию комплекса для случая 1) sp 2) d sр 2 гибридизации атомных орбиталей центрального атома 1Д 2В а) пирамида б) октаэдр в) плоский квадрат г) тетраэдр д) линейная |
|
|
18. Дайте соответствующие описания для ниже перечисленных процессов, в основе которых лежат следующие уравнения: 1) MgCO3 (тв) + Ca2+ (водн) → CaCO3 (тв) + Mg2+ (водн) 2) Mg2+ + HPO42- + NH3 → MgNH4PO4 а) совмещенное гетерогенное равновесие; б) конкуренция за катион; 1Г 2Д в) изоморфное замещение; г) конкуренция ионов за анион; д) аналитическая реакция на ион магния. |
|
|
19. Подберите соответствующие описания для следующих уравнений: 1) BaSO4 (тв) + Na2CO3 (нас. водн) → BaCO3 (тв) + Na2SO4 2) BaCl2 (водн) + Na2SO4 (водн) → BaSO4 (тв) +2NaCl а) изоморфное замещение; б) конкуренция за катион; 1Б 2В в) аналитическая реакция на ион бария; г) действие хлорида бария как группового реагента на анионы; д) влияние одноименного иона на растворимость. |
|
|
20. Подберите соответствующие описания процессов для их записей в общем виде: 1) MA (тв) + B-(водн) → МВ (тв) + А- (водн); 2) М1А (тв) + М2+ (водн) → М2А (тв) + М1+ (водн) а) конкуренция за катион; б) конкуренция за анион; 1А 2В в) образование твердой фазы при сливании двух растворов; г) влияние одноименного иона; д) дробное осаждение. |
|






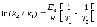 б) v = k в)
б) v = k в)
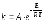 А2
Б4 В1
А2
Б4 В1 б) v = kc2 в)
б) v = kc2 в)
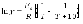
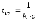 б)
б)
 в)
в)
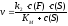
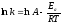 б)
б)
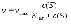 в)
в)
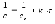
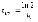 б)
б)
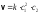 в)
в)
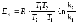
 б)
б)
 в)
в)

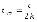 б) v = kc1c2 в)
б) v = kc1c2 в)
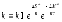
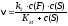
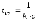 в)
в)
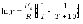
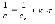 б)
б)
 в)
в)

 б)
б)
 в)
в)
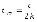
 б)
б)
 в)
в)
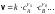
 б)
б)
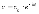 в) v = k
в) v = k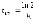 б)
б)
 в)
в)
 г)
г)

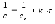 б)
б)
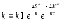 в)
в)