
11 Кінетика
.pdf
Кінетика біохімічних реакцій. Вивчення впливу різних факторів на перебіг хімічних реакцій.
1.Хімічна кінетика. Швидкість хімічної реакції.
2.Закон діючих мас для швидкості реакції. Константа швидкості, її фізичний зміст. Порядок реакції.
3.Гомогенні та гетерогенні процеси. Вплив ступеня дисперсності реагуючих речовин на швидкість хімічної реакції.
4.Вплив температури на швидкість хімічної реакції. Правило Вант-Гоффа.
Рівняння Арреніуса. Енергія активації.
ХІМІЧНА КІНЕТИКА
Хімічна кінетика – це вчення про швидкість хімічних реакцій і залежність від різних факторів: природи, концентрації речовин, що реагують, тиску,
температури, каталізаторів.
Швидкість реакцій та методи її визначення.
Формальна кінетика дає математичний опис швидкості реакції без урахування механізму цієї реакції.
Швидкість хімічної реакції – це кількість речовини, що реагує за одиницю часу в одиниці об'єму, тобто зміна концентрації реагуючої речовини за одиницю часу. Якщо початкова концентрація однієї з речовин була c°, а через час t стала с, то середня швидкість реакції дорівнює:
сер. |
|
с с |
|
t |
|||
|
|
Істинна швидкість реакції – це нескінченно мала зміна концентрації, що відбувається за нескінченно малий проміжок часу, тобто:
|
dc |
, |
(2.1) |
|
dt |
||||
|
|
|
якщо швидкість вимірюють за реагентом, або
dcdt ,
якщо її вимірюють за продуктом реакції. Знак «–» потрібний тому, що швидкість реакції може бути тільки позитивною величиною.
1. Швидкість реакції і закон діючих мас.
Одне із завдань хімії – встановити зв’язок між будовою, енергетичними
характеристиками хімічних зв’язків і реакційною здатністю речовин, вивчити вплив різних факторів на швидкість і механізм хімічних реакцій. Про принципову неможливість процесу говорять по величині зміни енергії Гіббса системи. Однак, ця величина нічого не говорить про реальну можливість протікання реакції в даних конкретних умовах, не дає ніякого уявлення про швидкість і механізм процесу. Наприклад, реакція:
2NO(г) + О2(г) = 2NO2(г) |
G0298 = -150 кДж/моль, |
проходить швидко при кімнатній температурі. Тоді, як: |
|
2Н2(г) + О2(г) = 2Н2О(г) |
G0298 = - 456,5 кДж/моль, |
яка характеризується |
значно більшим зменшенням енергії Гіббса, в |
звичайних умовах, практично не відбувається. Суміш водню з киснем зберігається при кімнатній температурі без помітної взаємодії достатньо довгий час, тоді як в присутності каталізатора або при 700 С (G1000 = - 495,3 кДж/моль) процес відбувається майже миттєво (з вибухом).
Отже, для повного опису хімічної реакції необхідно знати закономірності її протікання в часі, тобто, її швидкість і детальний механізм.
Швидкість і механізм хімічних перетворень вивчає хімічна кінетика.

Реакції можуть бути гомогенними і гетерогенними. Гомогенні реакції проходять в однорідному середовищі (наприклад, в газовій фазі або в рідкій фазі – у розчині, в твердій фазі – при отриманні інтерметалічних сполук).
Гетерогенні реакції проходять в неоднорідному середовищі – між речовинами, які знаходяться в різних фазах (твердої і рідкої, газова і рідинна і т.д.).
Отже, гомогенні реакції відбуваються рівномірно в усьому об’ємі,
заповненому реагентами, а гетерогенні – тільки на поверхні розділу фаз.
Швидкістю хімічної реакції називають число елементарних актів реакції,
які відбуваються за одиницю часу в одиниці об’єму (у випадку гомогенних реакцій) або на одиницю площі поверхні розділу фаз (у випадку гетерогенної реакції).
Швидкість реакції у гомогенному середовищі, звичайно характеризують зміною концентрації якого-небудь з вихідних або кінцевих продуктів реакції в одиницю часу і частіше всього виражають в моль/см3·хв (можуть бути інші розмірності моль/л·хв).
Про швидкість реакції можна говорити і за швидкістю зміни якої-небудь властивості системи, наприклад, забарвлення, електричної провідності,
тиску,спектра і т.д.
Якщо в моменти 1 і 2 концентрації одного з вихідних речовин рівні С1 і
С2 , то середню швидкість в інтервалі часу 1 і 2 можна подати так:= (с1-с2)/ ( 1 - 2) = -с/ .
Оскільки, йдеться про зменшення концентрації вихідної речовини, то зміна концентрації в цьому випадку береться із знаком “мінус”.
У ході хімічних реакцій концентрації речовин змінюються неперервно.
Тому, важливо знати величину швидкості реакції в даний момент часу, тобто миттєву швидкість реакції. Остання виражається першою похідною концентрації по часу:
= dc/d .
Якщо швидкість реакції оцінюється збільшенням концентрації одного з продуктів реакції, то похідна береться із знаком “+”.

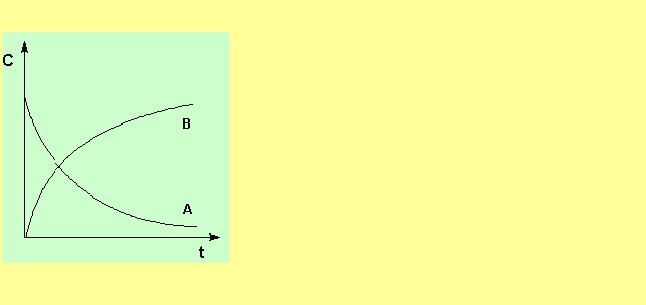
Розглянемо залежність концентрації вихідної речовини від часу. В кожен момент часу (наприклад, 1 ) миттєва швидкість реакції рівна тангенсу кута нахилу кривої = tg .
= tg .
Дослідження швидкостей хімічних реакцій і аналіз подібних графіків дозволяє отримати цінні відомості про механізм реакцій.
Швидкість хімічних реакцій залежить від:
природи реагуючих речовин;
концентрацій реагуючих речовин;
температури;
наявності каталізатора;
деяких зовнішніх факторів.
Швидкість гомогенних реакцій залежить від числа зіткнень за одиницю часу в одиниці об’єму. Імовірність одночасного зіткнення взаємодіючих частинок в свою чергу пропорційна добутку концентрацій реагуючих речовин.
Таким чином, швидкість реакції пропорційна добутку концентрацій
реагуючих речовин у ступенях, що є відповідними коефіцієнтами в
рівнянні реакції.
Ця закономірність має назву закону діючих мас (ЗДМ), його відкрив Бекетов (рос.) і Гульдберг та Вааге (норвез.).
Для реакції
А(г) + В(г) = АВ(г).
Швидкість реакції виражається наступним кінетичним рівнянням:
V = k·СА·СВ,
де, V- швидкість реакції,
СА і СВ – концентрації реагентів А і В. k – коефіцієнт пропорційності.
Коефіцієнт k називають константою швидкості реакції. Константа швидкості реакції рівна її швидкості, коли концентрації реагентів рівні одиниці.
k = V, коли СА = СВ = 1моль/л (моль/см3).

Константа швидкості реакції залежить від природи реагуючих речовин і від температури. При сталій температурі вона є величина постійна і характеризує природу реагуючих речовин.
Згідно з основним постулатом хімічної кінетики Швидкість хімічної реакції пропорційна добутку концентрацій
реагуючих речовин, піднесених до степенів, які рівні стехіометричним коефіцієнтів рівняння реакції.
Наприклад, для реакції
аА + bB + dD+...—> продукти
швидкість
k cAn1 cBn2 cDn3 ...... (2.2)
Коефіцієнт пропорційності k називається константою швидкості реакції.
Фізичний зміст константи швидкості можна встановити, якщо прийняти, що сА
= сВ = cD = 1.
Тоді
υ=k,
тобто константа швидкості дорівнює швидкості реакції при умові, що концентрації всіх реагуючих речовин рівні одиниці. Константа швидкості залежить від природи реагентів, температури, каталізатора, але не залежить від концентрацій. Її називають питомою швидкістю.
Показники ступенів п1, п2, п3, називаються порядком реакції за речовинами А, В, D, а їх сумарні значення п = п1 + п2 + п3 + --- — загальним порядком реакції. В багатьох випадках порядок не збігається зі стехіометричними коефіцієнтами в рівнянні реакції (тобто п1 ≠ а, п2 ≠ b і т.д.).
Це пояснюється тим, що більшість реакцій проходить в декілька стадій, які мають різні швидкості, тому стехіометричне рівняння - це сумарний результат всіх елементарних стадій, а загальна швидкість реакції визначається швидкістю найповільнішої (лімітуючої) стадії.
В елементарному акті реакції можуть приймати участь одна, дві або три молекули. За цією ознакою розрізняють: одномолекулярні, двомолекулярні і тримолекулярні реакції.

Для елементарних реакцій вводять поняття молекулярність — число молекул, які беруть участь в елементарному акті хімічної взаємодії. Існують одно-, двоабо тримолекулярні реакції. Участь в елементарному акті більше трьох молекул малоймовірна.
На відміну від молекулярності порядок реакції може бути нульовим,
цілочисельним або дробовим.
Лише для елементарних реакцій чисельні значення молекулярності і кінетичного порядку збігаються і дорівнюють стехіометричним коефіцієнтам.
Швидкість реакцій та методи її визначення.
Швидкість реакції визначають експериментальне хімічними або фізико-
хімічними методами. Хімічні методи полягають в тому, що з реакційної посудини через певні проміжки часу відбирають проби і визначають вміст речовини в них титриметричними методами. До фізико-хімічних методів належать кондуктометрія, спектроскопія, рефрактометрія, дилатометрія,
поляриметрія та ін. При використанні фізико-хімічних методів не треба відбирати проби. можна вести аналіз безперервно, вимірюючи через певні проміжки часу відповідну властивість реагуючої системи за допомогою певного приладу.
Порядок реакції — це важлива кінетична характеристика. Для визначення загального порядку реакції необхідно спочатку встановити порядок реакції за кожною реагуючою речовиною. Сума порядків реакції за кожною речовиною дас загальний порядок. Для визначення порядку реакції за даною речовиною необхідно створити такі умови, щоб в процесі реакції змінювалася концентрація тільки даної речовини. Для цього концентрації всіх інших учасників повинні бути настільки великими, щоб зміною їх в часі можна було знехтувати. Отже, значення цих концентрацій можна ввести в константу швидкості, тоді кінетичне рівняння реакції матиме вигляд:
u=kcn (2.3)
де п — порядок реакції за даною речовиною. Розрізняють інтегральні та диференціальні методи визначення порядку реакції.
Інтегральні методи
Метод підбору кінетичного рівняння. Експериментальні значення поточної концентрації і часу підставляють в рівняння для констант швидкостей реакцій різних порядків. Рівняння, за яким одержують сталі значення константи швидкості, описує кінетику досліджуваного процесу.
Іншим варіантом цього методу є подання експериментальних значень с і t у
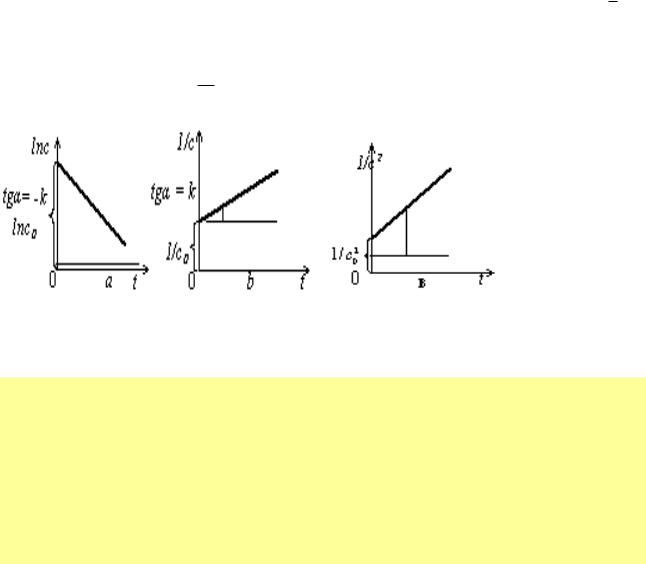
координатах, що дають лінійні залежності. Для реакції першого порядку графік
буде лінійним в координатах ln с — t , другого порядку — в координатах 1с t ,
третього по-с
рядку — в координатах с12 t (рис.8).
Рис.8. Графічні залежності ln c(а), 1/с (б), 1/с2 (в) від часу перебігу реакцій відповідно першого, другого та третього порядків
Метод періоду напівперетворення. Вивчають залежність періоду напівперетворення від початкової концентрації реагуючої речовини. Для реакцій першого порядку t1/2 не залежить від с0 , для реакцій другого порядку
він обернено пропорційний с0 , для реакцій третього порядку — обернено пропорційний с02
Диференціальні методи
Метод Вант-Гоффа. Прологарифмуємо рівняння:
ln v =ln k + n ln c

Одержали лінійне рівняння в координатах ln v—ln c, тангенс кута нахилу прямої дає значення порядку реакції n. Отже, визначаючи швидкість реакції при різних концентраціях реагуючої речовини, можна знайти порядок реакції.
Для визначення швидкості реакції будують кінетичну криву в координатах с — t (рис. 8). Швидкість реакції згідно з (2.1) дорівнює тангенсу кута нахилу дотичної до кривої в даній точці, яка відповідає певній концентрації.
Рис.9. Визначення швидкості реакції графічним методом
Молекулярність і порядок реакції
У більшості випадків прості реакції — це стадії складних хімічних процесів.
Розглянемо реакції, для яких молекулярність і порядок збігаються і дорівнюють одиниці, двом, трьом. Найчастіше зустрічаються реакції першого і другого порядків.
Реакції першого порядку. Швидкість реакції першого порядку
|
|
|
|
|
|
dc |
|
kc |
(2.4) |
||
|
|
|
|
|
dt |
||||||
|
|
|
|
|
|
|
|
||||
Розділяємо змінні: |
|
|
|||||||||
|
|
|
|
dc |
kdt |
|
(2.5) |
||||
|
|
|
|
c |
|
||||||
|
|
|
|
|
|
|
|
|
|
||
Інтегруємо (2.5)при умові с = c0 |
при t = 0: |
||||||||||
c |
dc |
1 |
|
|
|
c0 |
|
|
|||
|
k dt; |
ln |
kt |
(2.6) |
|||||||
c |
c |
||||||||||
c |
0 |
0 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
Звідси одержуємо рівняння залежності'п'оточної концентрації від часу:

ln c = -kt +ln c0 |
(2.7) |
Це лінійне рівняння в координатах ln с — t, значення k чиcельно дорівнює
тангенсу кута нахилу прямої, взятому з протилежним знаком: k = -tgα (рис. 1,
а).
Пряма відсікає на осі ординат відрізок, рівний ln со. З рівняння (2.6) одержуємо формулу для розрахунку k:
k |
1 |
ln |
c0 |
(2.8) |
|
|
|||
|
t c |
|
||
Розмірність константи швидкості [k] = t-l (c-1, хв-1 тощо).
При зменшенні початкової концентрації реагенту вдвічі, тобто до значення
с сс0 , з рівняння (2.6) одержуємо величину t1/2 — період напівперетворення
(напівреащії):
t |
|
ln 2 |
|
0,693 |
|
(2.9) |
|
|
|||||
1/ 2 |
|
k |
|
k |
|
|
|
|
|
|
|||
Отже, період напівперетворення не залежить від початкової концентрації реагенту. Це відмітна ознака реакцій першого порядку.
Реакції другого порядку
Для реакцій другого порядку: dcdt kc1 c2
якщо с1 = с2, то
dcdt kc2
Інтегруємо для умови с = с0 при t = 0:
c |
dс |
1 |
1 |
|
1 |
|
|||
|
k dt |
|
kt |
||||||
2 |
c |
c |
|
||||||
c |
0 |
с |
0 |
|
0 |
|
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||
Звідси:
(2.10)
(2.11)
|
|
|
1 |
1 |
|
|
1 |
|
|
|
|
|||||
k |
|
|
|
|
|
|
|
|
|
|
|
|
(2.12) |
|||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
c |
|
|
c0 |
|
|
|
||||||
1 |
kt |
1 |
|
|
|
|
|
(2.13) |
||||||||
|
с |
|
c0 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Отже, одержали лінійне рівняння в координатах |
1 |
t |
(рис.7, б). |
|||||||||||||
c |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Константа швидкості дорівнює тангенсу кута нахилу прямої. Період напівперетворення розраховується з (2.11) при c c20 :

t |
|
1 |
(2.14) |
|
|||
1/ 2 |
|
kc0 |
|
|
|
|
Таким чином, період напівперетворення обернено пропорційний початковій концентрації — це відмінна ознака реакцій другого порядку. Розмірність константи швидкості реакції другого порядку
[ k] = л . моль-1 . c-1 .
Реакції третього порядку
Для реакцій третього порядку:
ddtс kc1 c2 c3
При
c |
|
c |
|
|
|
c |
|
|
dc |
kc3 |
|
|
|
|
(2.15) |
||||||||||
|
2 |
3 |
|
|
|
|
|
||||||||||||||||||
1 |
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
c |
dс |
|
1 |
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
||||||||
|
|
k dt |
|
|
|
|
|
|
kt |
(2.16) |
|||||||||||||||
3 |
|
|
|
|
|
|
|
c |
c |
|
|||||||||||||||
|
c |
0 |
с |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
0 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
1 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
(2.17) |
|||||
|
|
|
|
|
|
2t |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
c0 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
1 |
|
2kt |
|
1 |
|
|
|
|
|
|
(2.18) |
|||||||
|
|
|
|
|
|
|
с2 |
|
c |
2 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|||
Графік лінійної залежності с12 t представлений на рис.8, в. Константа
швидкості дорівнює tg .
2
Період напівперетворення розраховують за формулою:
t1/ 2 |
3 |
(19) |
|
||
2kc2 |
||
|
0 |
|
тобто він обернено пропорційний квадрату початкової концентрації.
Розмірність константи швидкості реакції третього порядку [k]= л2 –моль-2
