
08. Буферна ємність
.pdf
ВИЗНАЧЕННЯ БУФЕРНОЇ ЄМНОСТІ. РОЛЬ БУФЕРІВ В
БІОСИСТЕМАХ.
1.Поняття буферної ємності. Від яких факторів вона залежить?
2.Буферні системи крові, механізм дії, їх біологічне значення. Бікарбонатний буфер, фосфатний буфер. Білкові буферні системи. Які буферні системи крові мають найбільшу буферну ємність і чому?
3.Поняття про кислотно-основний стан крові.
4.Визначення буферної ємності. Рівняння для розрахунку буферної ємності за кислотою та лугом.
БУФЕРНА ЄМНІСТЬ
При додаванні ж великих кількостей кислоти, або лугу змінюється співвідношення концентрацій компонентів буферу і рН змінюється чутливіше.
Аналогічний механізм дії й інших буферних систем. Наприклад, для білкового буферу, утвореного кислотною та сольовою формами білка, при додаванні сильної кислоти йони Н+ зв’язуються сольовою формою білка:
Кількість слабкої кислоти при цьому незначно збільшується, а сольової форми білка - еквівалентно зменшується. Тому рН залишається практично постійним. При додаванні лугу до цього буферного розчину йони Н+, зв’язані в кислотній формі білка вивільнюються й нейтралізують додані йони ОН-.
Кількість сольової форми білка при цьому незначно збільшується, а
кислотної форми еквівалентно зменшується , тому рН практично не змінюється.
Отже, буферна дія розчину зумовлена зміщенням кислотноосновної рівноваги за рахунок зв’язування доданих йонів Н+ чи ОН- у результаті реакції цих йонів і компонентів буферної системи з утворенням малодисоційованих продуктів.
Вплив розведення буферних систем на рН. Збереження постійності рН буферних розчинів при розведенні пояснюється тим, що концентрація

водневих йонів залежить не від концентрації компонентів, а від їх співвідношення. При розведенні концентрація обох компонентів змінюється однаково, а їх співвідношення залишається незмінним. Незначне збільшення рН пояснюється тим, що зростає ступінь дисоціації солі, який подавляє дисоціацію оцтової кислоти, що приводить до незначного зниження кислотності і збільшення рН.
Буферні системи можуть підтримувати постійність значень рН розчинів до певної межі. Зміщення рН буферних систем залежить від кількості доданих до них кислоти або основи.
Здатність буферних систем протидіяти зміщенню рН вимірюється буферною ємністю. Буферна ємність - це кількість мольеквівалентів сильної кислоти або лугу, які необхідно додати до 1 л буферного розчину, щоб змістити рН на одиницю. За одиницю буферної ємності приймають ємність такого розчину, для зміни рН якого на одиницю потрібне введення сильної кислоти або лугу в кількості 1 моль-еквівалент на 1 л рочину.
Розраховують за формулою
'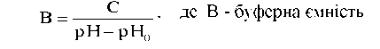
С - кількість моль-еквівалентів сильної кислоти або лугу; рН0 - водневий показник до додавання кислоти або лугу; рН - водневий показник після додавання кислоти або лугу.
Для визначення буферної ємності розчинів за кислотою або за лугом відбирають піпеткою певний об'єм досліджуваного розчину, додають відповідний індикатор і титрують розчином сильної кислоти або лугу до зміни забарвлення індикатора.
Буферну ємність розраховують за формулами:
Вл - буферна ємність за лугом; Вк - буферна ємність за кислотою;
Vб - кількість мл буферного розчину, який беруть для титрування;
N •Vл - кількість моль-еквівалентів лугу; N •Vк - відповідно, кислоти.
На буферну ємність розчинів впливають:
1.Концентрація буферного розчину. Чим вища концентрація буферного розчину, тим більша його буферна ємність. Концентрація виражається числом моль-еквівалентів буферного розчину на 1 л.
2.Співвідношення концентрацій компонентів буферного розчину.
Буферна ємність буде однаковою як за кислотою так і за лугом, якщо співвідношення компонентів рівне одиниці. За такого співвідношення концентрацій рН розчину змінюється меншою мірою, ніж при інших, а, отже,
буферна ємність максимальна при рівних концентраціях компонентів буферної системи й зменшується з відхиленням від цього співвідношення.
Робоча ділянка буферної системи становить приблизно одну одиницю рН з кожного боку від рКа. Інтервал рН = рКа+1 називається зоною буферної дії.
Поза цим інтервалом буферна ємність швидко падає до 0.
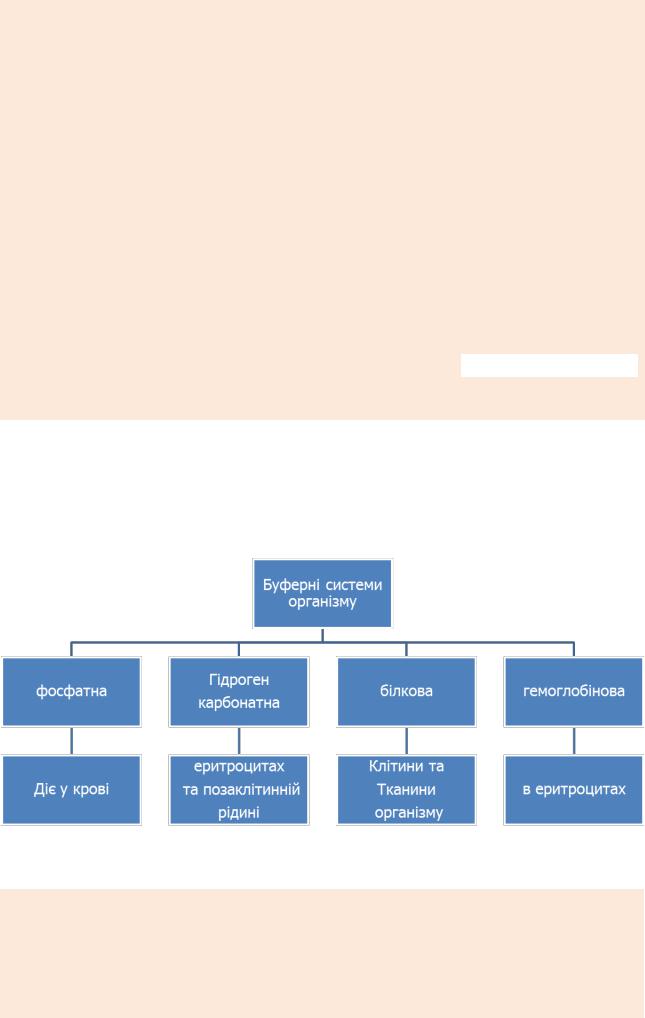
БУФЕРНІ СИСТЕМИ ОРГАНІЗМУ
Постійність рН біологічних рідин (гомеостаз) пояснюється наявністю фізико-хімічних та фізіологічних механізмів регуляції кислотно-основної рівноваги в організмі.
Регуляторними системами, які забезпечують постійність рН крові є:
1) буферні системи (рН стабілізується за 30 сек) - гідрогенкарбонатна
(Н2СО3 + NaHCO3), фосфатна (NаН2РО4 +Na2НРO4), білкова (РrotCООН +
РгоtCOONa), гемоглобінова (ННв + КНв), оксигемоглобінова (ННвO2 +

КНвO2);
2)діяльність легень (~1-3 хв необхідно легеням для того, щоб знизити найменшу зміну рН);
3)видільна функція нирок (~ 20 год необхідно ниркам для того, щоб стабілізувати рН).
Гідрогенкарбонатний є найважливішим позаклітинним буфером, на частку якого припадає 35% буферної дії плазми і лише 18% буферної дії еритроцитів. При значенні рН плазми крові 7,40 співвідношення компонентів його Н2СО3/НСО3 - складає 1/20.
У процесі обміну речовин в організмі людини утворюються невеликі кількості кислих продуктів. Всі кислоти, які утворюються в організмі,
потрапляють у кров і нейтралізуються бікарбонатним буфером:
Надлишок карбонатної кислоти розкладається до СО2 і Н2О за участі фермента карбоангідрази.СО2 переноситься кров'ю в легені і виділяється.
Концентрація бікарбонату крові при цьому зменшується, але рН крові залишається постійним, оскільки одночасно збільшується об'єм легеневої вентиляції і зменшується кількість СО2. Тому відношення Н2СО3/NаНСO3
залишається постійним. Якщо має місце збільшення в крові продуктів основного характеру (наприклад, амоніачних солей), вони нейтралізуються карбонатною кислотою:
що приводить до збільшення концентрації бікарбонату. При цьому відбувається зменшення легеневої вентиляції. Карбон (IV) оксид нагромаджується в організмі, буферне відношення Н2СO3/NаНСO3,
залишається постійним і рН крові теж.
Запас бікарбонату в крові NаНСO3, який являє собою хімічно зв'язану
карбонатну кислоту, називається лужним резервом крові . У нормі лужний
резерв крові складає 50-65% (25-30 ммоль/л). Завдяки лужному резерву,
організм звільняється від надлишку кислот, які утворюються при обміні речовин.
Іноді при патологічних процесах в організмі утворюються кислі продукти обміну, які понижують лужний резерв організму. При пониженні лужного резерву до 46% відбувається компенсований ацидоз, а при підвищенні до 75% -
компенсований алкалоз. рН крові при цьому не змінюється. Особливо тяжкі форми ацидозу і алкалозу викликають зміну рН крові. У цих випадках може мати місце некомпенсований ацидоз і алкалоз.
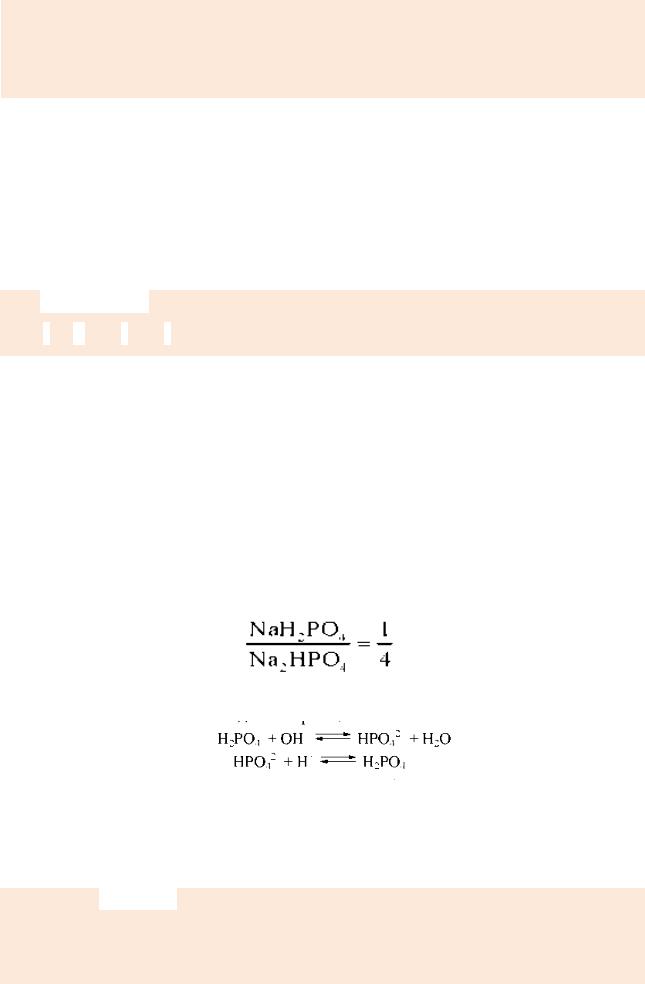
Фосфатний буфер складається з дигідро- і гідрофосфату натрію
(NaH2РО4 + Na2НРО4) і є головним внутрішньоклітинним буфером тканин.
Він складає основу буферної системи тканин (особливо нирок) і деяких біологічних рідин (сеча та ін.). Фосфатний буфер має вищу ємність за кислотою, ніж за лугом. Тому він ефективно нейтралізує кислі метаболіти, що надходять у кров, наприклад, молочну кислоту (Hlac): НРО42- + HLac = Н2РО4- + Lac-. Однак буферна ємність даної системи за кислотою і лугом не настільки великі, як у гідрогенкарбонатної у зв’язку з малим вмістом фосфатів у плазмі крові (5% загальної буферної дії крові). Співвідношення компонентів при рН крові 7,40 становить:
Механізм дії зводиться до таких реакцій:
У першому випадку сильна основа замінюється на двозаміщену сіль, у
другому - сильна кислота замінюється еквівалентною кількістю слабкої кислоти і рН практично не змінюється.
Склад білкових буферних систем може бути виражений таким чином РrotCООН + РгоtCOONa Завдяки білкам всі клітини і тканини організму мають певну буферну дію:

Білковий буфер діє аналогічно іншим буферним системам: сильна основа
(ОН ) замінюється слабкою спряженою основою (ProtCOO-), а сильна кислота
(Н+) - слабкою (РrotCООН), тому рН практично не змінюється. При рН = 7,40
білки плазми здатні зв'язати 18 ммоль основ на 1 г плазми.
До буферних систем крові належить також гемоглобінова (ННв + КНв) і,
оксигемоглобінова (ННвО2 + КНвО2), вони володіють найбільшою дією (75%).
Буферна дія гідрокарбонатної, гемоглобінової і оксигемоглобінової систем тісно пов'язана з дихальною функцією крові.
Дихальною функцією крові називається здатність крові транспортувати кисень від легень до тканин і СО2, від тканин до легень.
За своєю силою карбонатну, оксигемоглобінову і гемоглобінову кислоти можна розмістити в ряд: ННвO2 > Н2СO3 > ННв
У легенях протікає процес: ННв + O2 = ННв02
Слабка кислота, за рахунок приєднання кисню перетворюється в сильну.
Оксигемоглобін як сильніша кислота витісняє карбонатну кислоту з її солі:
Утворена карбонатна кислота швидко розкладається за участю фермента карбоангідрази і СО2 виділяється легенями в навколишнє середовище, а кисень
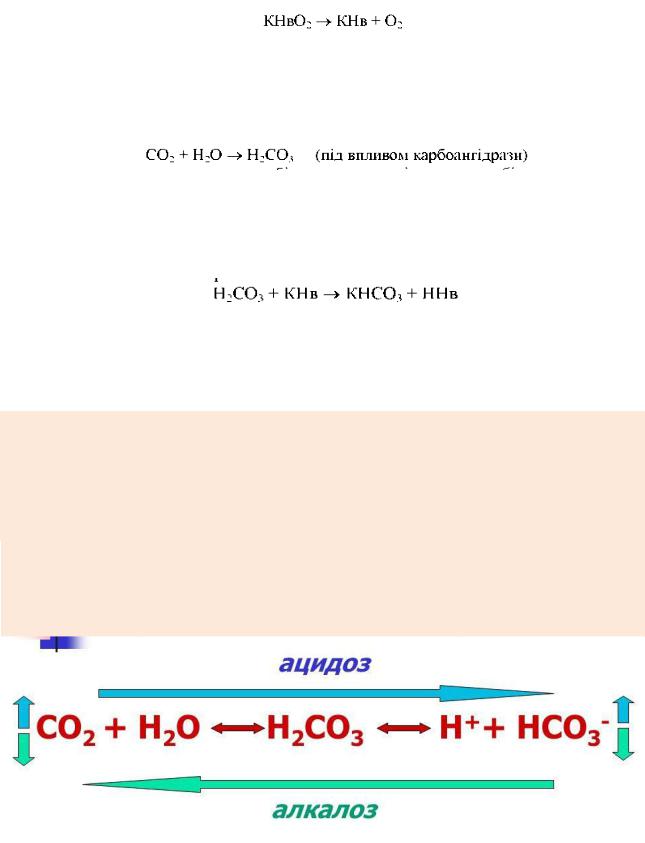
у вигляді калієвої солі оксигемоглобіну артеріальною кров'ю транспортується в тканини організму, де відбувається його дисоціація:
Кисень із еритроцитів поступає в тканини, де витрачається в реакціях окиснення. У результаті обміну речовин в тканинах утворюється дуже багато СО2 і підвищується концентрація карбонатної кислоти:
Карбонатна кислота, як більш сильна, витісняє гемоглобін з його солі,
тому нагромадження кислоти не відбувається, оскільки вона зв'язується в гідрогенкарбонат:
Гемоглобін і гідрогенкарбонат переносяться венозною кров'ю до легенів,
де процес повторюється.
КИСЛОТНО-ОСНОВНИЙ СТАН КРОВІ
Кислотно-основна рівновага є однією з найважливіших характеристик внутрішнього середовища організму. Кислотно - основною рівновагою
називають співвідношення концентрацій гідроген- і гідроксил-йонів у біологічному середовищі.
Зміщення кислотно-основного стану крові в напрямку підвищення концентрацій йонів Гідрогену називають ацидозом, а в напрямку зниження її концентрації алкалозом.
Знаючи рН крові (7,40) і величину йонного добутку води при температурі людського тіла [Н+] [ОН-] = 10-13,55 можна розрахувати концентрацію кожного з йонів і знайти їх співвідношення:

тобто концентрація йонів Гідрогену в організмі людини приблизно в 17
разів менша від концентрації гідроксильних йонів.
Не дивлячись на те, що в процесі обміну речовин постійно утворюють продукти кислого й основного характеру, рН крові практично залишається незмінним. Це має дуже важливе значення, оскільки організм людини надзвичайно чутливий до зміни рН.
Для корекції кислотно-основної рівноваги у клініці при ацидозі використовують 4%-вий розчин натрію гідрогенкарбонату внутрішньовенно.
Корекція при алкалозі складніша. У простіших випадках коригують 5%-вим розчином аскорбінової кислоти.
Основну частину білків плазми крові (90%) становлять альбуміни й глобуліни. Буферна ємність, що зумовлена білками плазми, залежить від концентрації білків, їх вторинної й третинної структури, числа вільних протоно-акцепторних груп. Ця система може нейтралізувати як кислі, так й основні продукти. Ізоелектричні точки цих білків знаходяться у діапазоні рН
4,9-6,3, тому за фізіологічних умов при рН = 7,4 білки перебувають перважно в основній формі, тому буферна ємність їх значно вища за кислотою й становить для альбумінів 10 ммоль/л, а для глобулінів - 3 ммоль/л.
Буферна ємність вільних амінокислот плазми крові незначна як за кислотою, так і за лугом. Це пов’язано з тим, що майже всі амінокислоти мають значення рКа далекі від рКа = 7. Тому при фізіологічному значенні рН їх потужність мала. Практично тільки одна амінокислота - гістидин (рКа=6,0) має значну буферну дію при значеннях рН, близьких до рН плазми крові. Отже,
потужність буферних систем плазми крові зменшується в ряду:
У внутрішньому середовищі еритроцитів у нормі рН становить 7,25, який підтримується за рахунок гідрогенкарбонатної, фосфатної, гемоглобінової й оксигемоглобіневої систем. Крім того, в еритроцитах білкова система гемоглобін-оксигемоглобін відіграє важливу роль у процесі дихання -

транспортна функція щодо переносу кисню до тканин і органів й видаленню з них метаболічного СО2.
Співвідношення концентрацій компонентів гідрогенкарбонатної системи в еритроцитах менше, ніж у плазмі крові, проте ця система ефективно підтримує сталість рН.
Фосфатна буферна система відіграє в клітинах крові важливішу роль, ні у плазмі крові. Насамперед, це пов’язано з більшим вмістом в еритроцитах неорганічних фосфатів. До того ж велике значення в підтримці сталого рН мають фосфоліпіди, що становлять основу мембран еритроцитів.
ПОРУШЕННЯ КИСЛОТНО-ОСНОВНОГО СТАНУ
Порушення кислотно-основного стану - це порушення процесу утворення і виділення кислот. Порушення КОС є більшою мірою правилом, ніж винятком,
у хворих, що знаходяться у відділеннях інтенсивної терапії. Якщо порушення таке, що буферні системи не можуть забезпечити нормальний рН, то включаються наступні системи захисту, спрямовані на збереження рівноваги між РСО2і НСО3-.Головну роль у цьому відіграють функції легень і нирок.
Порушення КОС:
•ацидоз дихальний та метаболічний;
•алкалоз дихальний та метаболічний;
•компенсовані (рН в межах норми);
•некомпенсовані (рН за межами нормальних коливань);
•різноспрямовані (протилежні зміни дихального та метаболічного компонентів);
•односпрямовані (зрушення в бік ацидозу або алкалозу обох компонентів).
Найважливіша умова успішного лікування порушень КОС - визначення причини. Терапія повинна бути спрямована на усунення основної причини, а не компенсаторних реакцій.
ЛАКТАТ-АЦИДОЗ
Молочна кислота є кінцевим продуктом анаеробного гліколізу в організмі. У нормі її концентрація в сироватці крові становить 2 ммоль/л або
менше. Велика частина молочної кислоти метаболізується печінкою в процесі глюконеогенезу. Збільшення кількості молочної кислоти в сироватці крові спостерігається при метаболічних порушеннях, пов'язаних з посиленням анаеробного гліколізу. Збільшення рівня молочної кислоти в сироватці крові завжди є показником значних метаболічних порушень. Причини лактат-
ацидозу:
•зниження оксигенації тканин –тканинна гіпоксія. Найбільше значення надають циркуляторних порушень (кардіогенний, септичний, гіповолемічний шок). Можливість лактат-ацидозу при артеріальній гіпоксемії, особливо короткочасної й неглибокої, сумнівна. Також немає прямих доказів збільшення рівня молочної кислоти в крові при анемії, якщо відсутні клінічні симптоми шоку. Проте присутність всіх форм гіпоксемії теоретично сприяє розвитку лактат-ацидозу. Останній припускають у всіх випадках клінічно важкого перебігу захворювання, у хворих з нестабільною гемодинамікою, інотропної підтримкою, синдромом здавлення і ін. Необхідно визначати показники КОС методом Аструпа, аніонну різницю і рівень лактату в крові;
•порушення функції печінки призводять до зниження її здатності до перетворення молочної кислоти в глюкозу і глікоген. Нормально функціонуюча печінка переробляє значні кількості лактату, а при шоку ця здатність порушується;
•недолік тіаміну (вітамін B1) може призводити до розвитку лактат-
ацидозу за відсутності серцево-судинної недостатності. Дефіцит тіаміну наголошується в критичних станах, нерідко у хворих, що зловживають алкоголем. Недолік тіаміну сприяє збільшенню рівня молочної кислоти внаслідок пригнічення окиснення пірувату в мітохондріях. Рівень лактату в сироватці крові підвищується під час непомірного вживання спиртних напоїв, а
через 1-3 дні лактат-ацидоз переходить в кетоацидоз;
•підвищення рівня правообертальні ізомеру молочної кислоти -D-
лактоацидоз. Цей ізомер утворюється в результаті дії мікроорганізмів, які розщеплюють глюкозу в кишечнику. D-лактат-ацидоз частіше зустрічається у хворих після абдомінальних операцій: обширних резекцій тонкої кишки,
