

8 |
ГЛОБАЛЬНОЕ ЗАГРЯЗНЕНИЕ |
ОКРУЖАЮЩЕЙ СРЕДЫ РТУТЬЮ |
|
И ЕЕ СОЕДИНЕНИЯМИ |
|
В.С. Петросян |
Введение
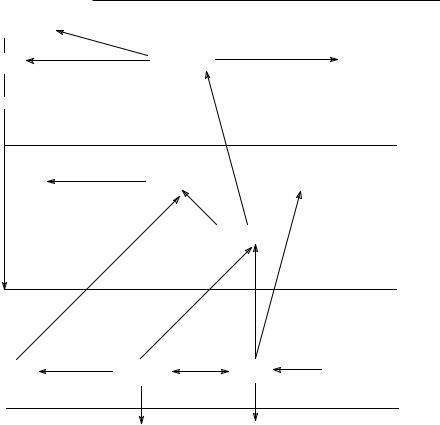
Научно-техническая революция XX в. привела к разнообразным применениям ртути и ее соединений. За последние 25 лет поставки металлической ртути в мире колебались от 3,5 до 7,5 тыс. т в год, из которых значительная часть в итоге оказалась в окружающей среде [35]. Это антропогенное влияние существенно нарушает нормальный биогеохимический цикл ртути (рис. 8–1), в результате чего биота наряду с влиянием других экотоксикантов испытывает и негативные эффекты ртути и ее производных [17].
Из всех типов соединений ртути наиболее распространенными в окружающей среде являются: металлическая ртуть Hg0, ее неорганические соединения – соли двухвалентной ртути типа НgX2 и органические производные – ртутьорганические соединения типа RHgX (рис. 8–1). Другие возможные формы, например, неорганические соли одновалентной ртути типа каломели Hg2X2 или полные ртутьорганические соединения типа R2Hg, безусловно, менее типичны, однако, как будет видно ниже, также могут оказывать токсические эффекты, иногда с летальным исходом.
Hg0 – жидкий металл с температурой кипения 357 °С, летучий (в 1 м3 насыщенного при 25 °С воздуха может содержаться до 20 мг Hg), почти нерастворим в воде (максимум 0,28 мкМ/л при 25 °С) [13]. Токсичность металлической ртути обусловлена тем, что при ее вдыхании более 80% ртутных паров легко абсорбируется в почках, мозге и других внутренних органах с последующим бионакоплением, что приводит к негативным эффектам на эти органы и разрушению легких [50]. В тканях живых организмов металлическая ртуть претерпевает процессы окисления, превращаясь, в основном, в соединения двухвалентной ртути.
Типичным представителем солей двухвалентной ртути является сулема HgCl2 – негидролизующееся соединение с ковалентными связями. Ее температура плавления – 277 °С, растворимость в воде – 69 г/л, а в ацетоне – 143 г/л. Сулема весьма реакционноспособна по отношению к биологически активным молекулам, давая с белками соединения типа RSHgSR, приводя к агглютинации эритроцитов и ингибированию ферментов, чем и обусловлена ее известная токсичность. Соли типа HgХ2 легко накапливаются в почках, но, в отличие от металлической ртути, не могут
Россия в окружающем мире: 2006 (Аналитический ежегодник). Отв. ред. Н.Н. Марфе нин / Под общ. ред.: Н.Н. Марфенина, С.А. Степанова. – М.: МНЭПУ, Авант, 2007. – 320 с.
149
Россия в окружающем мире: 2006
CH |
Hg+, Hg2+ |
окисление |
|
|
|
воздух |
||
3 |
|
|
|
|
|
|
|
|
|
фоторазложение |
|
(CH3)2Hg |
фоторазложение |
|
CH4+C2H6 |
||
Hg0 |
|
|
|
|
|
|||
Влажные и сухие |
|
|
|
|
|
|
||
|
осадки |
|
|
|
|
|
|
|
|
|
бактериальное |
|
вода |
|
|
||
|
Hg0 |
CH3Hg+ |
CH |
HgSCH |
|
|||
|
восстановление |
3 |
||||||
|
|
|
3 |
|
|
|||
|
|
|
|
|
|
в моллюсках |
||
|
окислительное |
|
|
(CH 3)2Hg |
|
|
|
|
|
|
|
|
|
|
|
||
|
метилирование |
|
|
|
|
|
|
|
|
|
|
|
|
Взвесь, |
верхние |
||
|
|
|
|
|
|
осадки |
||
|
|
бактериальное |
|
бактерии |
|
|
|
|
|
Hg0 |
CH3Hg+ |
Hg2+ |
|
Hg0, Hg2+ |
|||
|
|
|
||||||
|
|
восстановление |
|
Кравн ~0,01 |
|
|
|
|
|
Глубокие осадки |
HgS |
HgS |
|
Рис. 8–1. Биогеохимический цикл ртути
эффективно преодолевать гематоэнцефалический и плацентарный барьеры. Острые отравления солями ртути вызывают осаждение белков из мукомембран желу- дочно-кишечного тракта, обусловливая боль, рвоту и расстройство желудка. При отравлении происходит гемолиз эритроцитов, а наибольший негативный эффект приходится на печень [10].
В метилртутных солях типа СН3HgX связь Hg–C весьма устойчива, не разрушается водой и слабо взаимодействует с кислородсодержащими основаниями и кислотами, но при замене группы СН3 на группы С6Н5 или СН3ОСН2СН2 связь Нg–C разрывается достаточно легко [43]. При взаимодействии с галогеноводородными кислотами или содержащими азот, фосфор и серу основаниями реакции протекают достаточно энергично, чем и объясняется высокая токсичность метилртутных солей по отношению к живым организмам. Метилртутные соли в 100 тыс. раз (!) более токсичны, чем неорганические соли ртути НgX2, что в некоторых случаях (Аргентина, Ирак, Япония) приводило к массовым нейротоксическим заболеваниям и гибели людей.
150

Глобальное загрязнение окружающей среды ртутью и ее соединениями
Наиболее известный случай такого заболевания и массовой гибели людей произошел в Японии в 1954 г., когда около 3000 жителей поселков вокруг залива Минамата пострадало вследствие потребления ими морепродуктов, отравленных метилртутными соединениями, образовавшимися в водах залива в результате сбрасывания в него компанией «Чиссо» сточных вод, содержащих неорганические соли ртути, которые путем биометилирования превращались в метилртутные соединения. Судебное разбирательство этого наиболее трагичного в истории Японии массового отравления людей продолжалось более 50 (!) лет, и только в 2005 г. Верховный суд Японии принял решение об ответственности правительства страны
ипрефектуры Кумамото за это отравление и постановил выплатить людям, пострадавшим в результате этих событий, компенсации в 71,5 млн иен [47].
Максимальнойтоксичностью(вмиллионраз(!)большей,чемметилртутныесоли)
обладает трудно обнаруживаемая в окружающей среде диметилртуть СН3HgCH3, от отравления которой погибли не только химики, впервые синтезировавшие ее в 1865 г. [30], но и некоторые из тех, кто контактировал с ней в наши дни [40, 42].
Всемирная организация здравоохранения (ВОЗ) в своих официальных документах предупредила мировую общественность о токсичности для окружающей среды
иживых организмов ртути в 1989 г. [36] и метилртути – в 1990 г. [37].
Источники ртути и еЕ соединений в окружающей среде
Обычно рассматривают две группы источников поступления ртути и ее соединений в окружающую среду – природные и антропогенные [20]. При этом природные источники подразделяют на глобальные, региональные и локальные. Основными глобальными источниками являются верхняя мантия земной коры (в первую очередь, продукты извержения вулканов и выветривания горных пород) и Мировой океан (включая все виды поверхностных и подземных вод). К региональным источникам относят, главным образом, крупные месторождения ртутьсодержащих пород (рудные пояса и зоны). В свою очередь, в качестве локальных источников рассматривают лишь отдельные рудные поля.
Основные антропогенные источники ртути, загрязняющие окружающую среду (атмосферу, почву и водные экосистемы) и негативно влияющие на здоровье населения и биоразнообразие, приведены в таблице 8–1 [41].
Сжигаемое в стационарных печах топливо (нефть и уголь) содержит в своем составе природную ртуть. При производстве золота металлическая ртуть используется в технологии амальгамирования. Добываемые для производства черных и цветных металлов руды также содержат в своем составе природную ртуть. Технология производства цемента предполагает сжигание нефтяного и угольного топлива, а производство соды и вовсе происходит с применением ртутных электродов.
Важными антропогенными источниками ртути являются различные ртутьсодержащие приборы (вакууметры, барометры, термометры и т.п.) и изделия электроники и электротехники (ртутные батареи и микробатарейки, флуоресцентные
151

Россия в окружающем мире: 2006
Таблица 8–1
Глобальные выбросы ртути из антропогенных источников в 2000 г. (т)
Источник/Континент |
Африка |
Азия |
Австралия |
Европа |
Южная |
Северная |
Всего |
Америка |
Америка |
||||||
Стационарные печи |
215 |
912 |
112 |
114 |
32 |
107 |
1492 |
Производство золота |
178 |
47 |
8 |
... |
... |
2 |
235 |
Цветная металлургия |
8 |
87 |
4 |
15 |
25 |
25 |
164 |
Производство цемента |
5 |
82 |
... |
30 |
6 |
... |
123 |
Захоронение отходов |
... |
33 |
... |
12 |
... |
64 |
109 |
Производство соды |
... |
31 |
1 |
40 |
5 |
2 |
79 |
Черная металлургия |
1 |
12 |
... |
13 |
1 |
... |
27 |
Производство ртути |
... |
... |
... |
... |
23 |
... |
23 |
Другие |
... |
... |
... |
15 |
... |
2 |
17 |
Всего |
407 |
1204 |
125 |
239 |
92 |
202 |
2269 |
лампы и др.). За последние десятилетия в окружающую среду было выброшено около 30 млн ртутных микробатареек, вместо которых теперь используются щелочные микробатарейки. Что касается флуоресцентных ламп, то только на территории России в них содержится около 500 т металлической ртути [18].
Из содержащихся в атмосфере ртути и ее соединений около 30% имеет антропогенное происхождение, главным образом в виде металлического пара и аэрозолей с сорбированной ртутью [25]. Из рисунка 8–1 следует, что помимо антропогенных выбросов металлическая ртуть в атмосфере может образовываться и при фотохимическом разложении диметилртути (при этом в качестве побочных продуктов образуются простейшие углеводороды метан и этан).
Основной способ попадания ртути в водные экосистемы – со сточными водами в виде гомогенных и коллоидных растворов и взвесей. Количество антропогенной ртути, поступающей в поверхностные водные экосистемы, составляет величину порядка 57 тыс. т, что в 10 раз превышает поступление из природных источников [3]. В водных экосистемах катионы ртути Нg2+ образуют большое количество устойчивых комплексных соединений с различными органическими и неорганическими лигандами . Особую роль, в частности, играют комплексы неорганических солей ртути с природными гуминовыми веществами, в частности, с гуминовыми и фульвокислотами [8]. Так как в природных водах ртуть интенсивно связывается с твердыми взвешенными частицами, то процессы сорбции-десорбции являются ключевыми для судьбы ртути в водных экосистемах. В удалении ртути из водных масс решающую роль играют ее сорбция и последующая седиментация.
В сточных водах многих промышленных предприятий более 65% ртутьсодержащих частиц связаны с органическими макромолекулами и имеют молекулярные веса более 10 тыс. Около 50% ртути, содержащейся в сточных водах, выпадает в осадок в отстойниках очистных сооружений и в природных водоемах.
Примеч. ред.: лиганд – ион, находящийся в соединении с центральным атомом в молекуле.
152

Глобальное загрязнение окружающей среды ртутью и ее соединениями
В почву ртуть и ее соединения могут попадать как из воздуха в виде твердых или жидких осадков, так и через воду [23]. При этом особенно эффективно задерживают ртуть лесные массивы с их развитой контактирующей поверхностью. Определяющую роль в миграции ртути в почвах играют состав почв (в частности, количество гуминовых веществ) и их кислотность. Следует отметить, что загрязнение почв ртутью изучено слабее, чем других объектов окружающей среды. По-видимому, именно этим объясняется отсутствие в нормативных документах требований, регламентирующих содержание ртути и ее соединений в почвах и грунтах населенных пунктов (значения предельно допустимых концентраций (ПДК) определены только для сельскохозяйственных угодий) [7].
Промышленные предприятия России ежегодно используют около 1800 т ртути, тогда как объем производства этого металла в стране не превосходит 200 т (ранее
вСоветском Союзе производилось более 1200 т, но, в основном, вне территории Российской Федерации) [12]. В целом, антропогенное поступление ртути в окружающую среду в Российской Федерации оценивается в 200–250 т (в том числе 3–5 т
врезультате аварий).
При производстве металлической ртути ее выбросы в атмосферу составляют от 5 до 7% общего объема производства, а производство 1 т черновой меди сопровождается выбросами в атмосферу более 2 т пыли с содержанием ртути до 4% [26]. В сточных водах этих предприятий содержится до 0,01 мг/л ртути.
Выбросы металлической ртути с заводов, производящих каустическую соду и хлор, на которых она используется в качестве электродов, составляют 150–250 г на 1 т хлора. В некоторых антиобрастающих покрытиях, используемых для покраски днищ морских судов, содержание производных ртути составляет 2–5% веса краски, и в конце концов вся ртуть вымывается в водную среду, из которой попадает или в водную биоту, или в донные отложения. В бытовых красках, по понятной причине, содержание соединений ртути значительно ниже – 0,001–0,05%.
Каждая из флуоресцентных ламп содержит около 150 мг ртути и, будучи выброшенной на свалку и лишившись герметичности, загрязняет на уровне ПДК для рабочих зон (0,1 мг/м3) [33, 34] 500 тыс. м3 воздуха (для жилых районов ПДК составляет 0,0003 мг/м3). Человек, к сожалению, ощутить присутствие паров ртути в воздухе не может и поэтому подвергается опасности, не имея об этом никакого представления. Следовательно, контроль за содержанием ртути в атмосфере должен осуществляться государственными органами.
В качестве фунгицидов (в основном для протравливания семян зерновых) широко использовались метилмеркуриодид СН3НgI, этилмеркурхлорид С2Н5HgCl, этилмеркурфосфат (С2Н5Нg)3PO, этилмеркурацетат С2Н5НgOCOCH3 и некоторые другие ртутьорганические соединения, которые в последние годы запрещены к производству и применениям.
Такая же судьба постигла использовавшиеся ранее для медицинских целей дициандиамид метилртути (паноген, сильный антисептик), оксихинолинат метил ртути (мочегонное средство) и хлормеркурбензоат (эффективный препарат против сифилиса и гонореи).
Метилртутные соединения в значительных количествах образуются в окружающей среде в результате химического и биологического метилирования неорганических производных двухвалентной ртути Нg2+ [29]. Метилирование может про-
153

Россия в окружающем мире: 2006
текать как в аэробной, так и в анаэробной среде, однако максимальные скорости наблюдаются в окислительной анаэробной зоне, в области редокс-потенциалов от –100 до +150 мВ, в которой наиболее широко распространены различные микроорганизмы [49].
Метилирование может происходить в почве и донных отложениях, но лучше всего биотическое и абиотическое метилирование протекает в водных экосистемах, в которых ртуть примерно на 85% присутствует в виде метилртути. Основными факторами, способствующими метилированию ртути, являются: общая концентрация неорганической ртути, значение рН, температура, редокс-потенциал, природа присутствующих микроорганизмов, содержание сульфидов (последние в значительной мере способствуют образованию в экосистемах диметилртути). В качестве химических метилирующих агентов в окружающей среде могут выступать йодистый метил, диметилсульфид, триметилсульфониевый катион и метилкобаламин. В живых организмах, в том числе и в организме человека, основным метилирующим агентом является одна из незаменимых аминокислот – метионин СH3SCH2CH2CH(NH2)COOH [14].
В морских анаэробных условиях, в частности, в отложениях отмерших водорослей, ртуть может присоединять водород и превращаться в летучие гидриды.
Содержание ртути и ее соединений в объектах окружающей среды
Атмосфера. По оценке 1995 г., в атмосферу из различных антропогенных источников (производство цемента, стали, чугуна, цветных металлов; добыча золота; захоронение отходов; работа стационарных печей) ежегодно поступает всего до 2200 т ртути [31]. Ее среднее содержание в атмосфере колеблется от 0,5 до 2,0 нг/м3 (ПДК = 0,0003 мг/м3). Соотношение вкладов природных и антропогенных источников в суммарное загрязнение атмосферного воздуха зависит от конкретного региона. Результаты региональной оценки 1995 г. приведены в
таблице 8–2.
Таблица 8–2
Антропогенные выбросы ртути в атмосферу в различных регионах Земного шара в 1995 г.
Регион |
Доля общемировых выбросов, % |
Азия |
57 |
Европа |
13 |
Африка |
11 |
Северная Америка |
11 |
Австралия и Океания |
5 |
Южная Америка |
3 |
154

Глобальное загрязнение окружающей среды ртутью и ее соединениями
ВАрктике из общего количества ртути (6100 т), поступающего ежегодно в ее воздушное пространство (вследствие «полярной дистилляции» – трансграничного переноса, преимущественно из Евразии), 60% приходится на антропогенные,
а40% – на природные источники [9]. Ввиду того, что время нахождения ртутных паров в атмосфере колеблется от 0,4 до 3 лет, очевидно, что эти пары распространяются по всему миру. Образующиеся в результате окисления и других превраще-
ний катионы Нg2+ и СН Hg+ (рис. 8–1) имеют времена жизни порядка нескольких недель и поэтому переносятся3 только на короткие расстояния.
Ватмосфере ртуть содержится примерно в равных количествах в виде паров и в сорбированном аэрозолями состоянии [21]. Равновесие между парообразной и аэрозольной формами при неизменных условиях достигается за 5 суток.
Вслабозагрязненном воздухе концентрации ртути составляют 0,8–1,2 нг/м3, в районах крупных ртутных месторождений – до 240 нг/м3, в районах газовых месторождений – до 70 тыс. нг/м3. Содержание ртути в воздухе вокруг предприятий (на расстоянии до 2 км), производящих или потребляющих ртуть, может превышать ПДК в 4–5 и более раз [22]. В то же время показано [21], что в радиусе 5 км от организованного источника выброса выпадает не более 6–10% валового выброса ртути,
аоколо 60% переносится на расстояния до 100 км.
Что касается метилртутных соединений, то наиболее типичные концентрации [29], характеризующие их содержание в атмосфере, находятся в пределах от 2 до 6 нг/м3.
В Санкт-Петербурге в 1991–1992 гг. было проведено обследование детских дошкольныхучрежденийишколнасодержаниепаровртутиввоздухе[7].Превышения ПДК в десятки и сотни раз были зарегистрированы примерно в каждом четвертом детском дошкольном учреждении и в каждой второй школе. При этом установлено, что причинами такого интенсивного загрязнения воздуха ртутью является длительное, бесконтрольное применение ртутных приборов, ламп, термометров и т.п.
Литосфера. Среднее содержание неорганических производных ртути в земной коре составляет около 50 мкг/кг. В почвах природное содержание ртути обычно принимается в среднем равным 10 нг/кг, однако в загрязненных районах значения концентраций ртути могут быть на два-три порядка выше.
Различныесоединенияртутивпочвеннойсреденаходятсявсостояниидинамического равновесия, в котором значительную роль играют обусловленные присутствием микроорганизмов процессы метилирования неорганических производных ртути
идеметилирования метилртутных соединений. Образование метильных производных ртути приводит к существенному возрастанию летучести (давление насыщенных паров метилртути примерно в 10 тыс. раз больше соответствующего параметра для металлической ртути) [9]. При этом оказывается, что скорость улетучивания соединений ртути с поверхности почвы зависит от ее природы. Например, при одинаковой исходной концентрации (1 мг/кг) за 6 суток с поверхности песчаной и глинистой почв улетучилось, соответственно, 25 и 43% соединений ртути. В отличие от кадмия
ицинка, являющихся соседями ртути по II группе таблицы Менделеева, ртуть не увеличивает своей подвижности при закислении почвы, что объясняется прочным связыванием с содержащимися в почве гуминовыми веществами [8].
Метилртутные соединения обычно присутствуют в почвах в концентрациях
0,02–0,4 мкг/г [29].
155

Россия в окружающем мире: 2006
Гидросфера. Считается, что в Мировом океане к концу второго тысячелетия накопилось около 50 млн т соединений ртути, а естественный вынос ртути в океан в результате эрозии составляет примерно 5 тыс. т в год [9]. При ПДК для поверхностных вод 0,0005 мг/л концентрации растворенной ртути в природных водах могут варьировать от нанограммов до микрограммов в литре (для незагрязненных водных экосистем, в частности, для Арктического региона типичной средней концентрацией считается С(Нg) < 1 мкг/л) [21]. При этом в хорошо аэрируемых водах, для которых окислительно-восстановительный потенциал среды Eh > 0,5, будет преобладать двухвалентная ртуть (в виде Нg2+ или СН3Нg+), а при восстановительных условиях будет превалировать Нg0.
Интенсивное связывание ртути с твердыми взвешенными частицами приводит к тому, что фактор концентрирования составляет величину порядка 1,3–1,8×105, т.е. доля ртути, связанной со взвешенными частицами (размером менее 0,45 мкм), в 10 тыс. раз больше, чем растворенная доля [9]. Сорбция наиболее активно протекает на тех участках донных отложений, которые обогащены сульфид-ионами (рис. 8–1). В донных отложениях ртуть практически полностью связана с фракцией частиц диаметром менее 20 мкм. Факторы, обусловливающие эффективность связывания ртути в донных отложениях, располагаются по значимости в следующем порядке: содержание гуминовых веществ > размеры частиц > ионообменная способность катионов > площадь поверхности частиц. Учитывая, что гуминовые вещества в значительной мере связывают растворенные в водных экосистемах соединения ртути, переводя их из растворенного во взвешенное состояние, среднее фоновое содержание в реках и озерах России растворенной ртути – 0,09 мкг/л и взвешенной ртути – 0,23 мкг/г. Соответствующие антропогенные показатели –
10 мкг/л и 6 мкг/г [27].
Исследование экосистемы Черного моря показало, что имеет место значительное концентрирование ртути в поверхностном микрослое (ПМС, толщиной не более 1 мм) по сравнению с нижележащими слоями воды. Во многих случаях концентрации ртути в ПМС превышают 1 мкг/л, а в западной части моря существенно превышают эту величину. По мере удаления от шельфа эти концентрации незначительно уменьшаются. Оценочные расчеты показывают, что всего в ПМС Черного моря содержится около 263 т ртути [19].
Из имеющихся в литературе немногочисленных данных по загрязнению водных экосистем соединениями ртути бесспорный интерес представляют результаты изучения влияния сточных вод Северобайкальского отделения Байкало-Амурской магистрали на загрязнение озера Байкал [11]. В этом исследовании показано, что в водах Северного Байкала и рек Тыи и Кичеры ртутьсодержащие соединения находятся в концентрации 0,1–0,2 мкг/л. Существенный вклад в загрязнение Байкала ртутью с начала производства на Байкальском целлюлозно-бумажном комбинате (БЦБК) дают сточные воды этого комбината. Показано, что ртуть в сточных водах БЦБК в основном присутствует в виде комплексов с хлорид-ионами (НgСl3–, HgCl42– и т.д.) [4]. Сочетание механических, биологических и химических методов очистки сточных вод БЦБК позволяет снизить содержание в них ртути до 0,0005 мг/л, что соответствует современным эколого-гигиеническим стандартам. В образующемся при этом и обезвоженном шлам-лигнине содержание ртути может достигать весьма высоких концентраций (до 4 мкг/кг) [5].
156

Глобальное загрязнение окружающей среды ртутью и ее соединениями
Исследование накопления ртути в верхних слоях озерных донных отложений (седиментов) в Арктике показывает [21], что концентрации ртути в этих слоях за столетний период увеличились от 0,03 до 0,11 мкг/г. В России самое сильное загрязнение наблюдается вблизи металлургических комбинатов на Кольском полуострове и в Норильске, где соответствующие концентрации превышают фоновые уровни в десятки, а кое-где и в сотни раз. Вследствие того, что озерные седименты являются превосходными накопителями тяжелых металлов, возможно, что эти уровни загрязнения останутся высокими в течение многих десятилетий.
Количества ртути во времени увеличиваются не только в озерных, но и в морских донных отложениях. Даже на Северном полюсе в седиментах с глубин от 22 до 3 м концентрации ртути возрастают от 0,03 до 0,13 мкг/кг. Эти данные указывают на увеличивающийся глобальный поток ртути, которая в Арктике осаждается изза «полярной дистилляции» (см. выше).
Растения. Ртуть, поступающая из атмосферы в виде паров, сорбируется хвоей
ипрочно удерживается ею [6]. Миграции в другие органы растения при этом не происходит. При введении ртути в крону в виде аэрогидрозоля дальнейшее ее поведение определяется степенью общей минерализации аэрогидрозоля, а не концентрацией в нем ртути. При низкой минерализации ртуть ведет себя так же, как газообразная; если же минерализация достаточно высока, то ртуть, связанная хвоей, быстро распределяется по всему растению и уже через сутки поступает в заметных количествах в почву, а из почвы – снова в атмосферу. Основное количество ртути фиксируется тканями вблизи места введения.
Согласно действующим в РФ санитарным нормам ПДК соединений ртути в сельскохозяйственных растениях (картофель, овощи, зерновые) утвержден на уровне 0,02–0,03 мг/кг [2]. В то же время наши исследования показали, что органические
инеорганические производные ртути при таких концентрациях вызывают у растений различные негативные экотоксические эффекты – ингибирование клеточного дыхания, понижение ферментной активности и др. [16, 32].
Живые организмы. Отметим, прежде всего, что вышеупомянутая болезнь Минамата была зарегистрирована сперва лишь у 121 жителя побережья этого залива, из которых более 40 вскоре скончались (хотя поначалу у них были зарегистрированы лишь ломота в суставах и нарушения слуха и зрения). В специальном исследовании было установлено, что болезнь Минамата обусловлена экотоксикологическими эффектами метилртутных соединений, образующихся в водных экосистемах при биологическом и химическом метилировании неорганических производных ртути. При этом бионакопление соединений ртути в морской биоте достигает значительных уровней (в заливе Минамата концентрации ртути составляли: в крабах – 35,7 мг/кг, в рыбе – 20,0 мг/кг, в креветках – 5,6 мг/кг при японском норма-
тиве 0,4 мг/кг) [38].
В последнее двадцатилетие показано, что очень высокие концентрации ртути накоплены в морской биоте Средиземноморья (от 2 до 4 раз выше, чем в большинстве других морей) [44]. Эти факты объясняются тем, что 65% мировых запасов ртути сосредоточено в средиземноморском регионе (занимающем лишь 1% поверхности нашей планеты), а также тем, что обмен водой с Атлантическим океаном через про-
157

Россия в окружающем мире: 2006
лив Гибралтар затруднен. Анализ для 6 видов рыб Тирренского моря у побережья Тосканы (где в городке Росиньяно Сольвей был завод по производству каустической соды и хлора с ртутными электродами) показал, что концентрации ртути в печени (2,42–17,00 мг/кг) и почках (2,09–29,80 мг/кг) рыб существенно выше, чем в мышечных тканях этих же рыб (1,65–4,64 мг/кг) [45].
Рыбы Братского водохранилища (плотва, карась, лещ и окунь) также содержат значительные количества ртути – от 2 до 6 мг/кг, что, по мнению сибирских специалистов, обусловлено значительным загрязнением ртутью и ее соединениями донных отложений этой водной экосистемы [24]. По мнению Комитета по охране окружающей среды Иркутской области, ответственными за это загрязнение являются промышленные предприятия Иркутска, Ангарска, Усолья-Сибирского и Зимы, некоторые из которых за последние 20–30 лет сбросили со сточными водами по 1,5–2,0 тыс. т ртути.
Пресноводные рыбы (голец, налим и сиг) в арктических водах России содержат ртуть на уровне 0,01 мкг/г сырой массы (отметим для сравнения, что соответствующие значения для вод Норвегии, Финляндии, Гренландии и Канады составляют 0,25, 0,32, 0,99 и 2,49 мкг/г) [21]. В том же исследовании биоаккумуляции тяжелых металлов в арктической биоте показано, что, например, у куропаток ртуть и кадмий накапливаются преимущественно в почках. При этом кадмий обнаруживают в концентрациях (47–524 мкг/г), превышающих содержание ртути в сотни и даже в тысячи раз (0,07–0,75 мкг/г).
В хищных птицах России уровень содержания ртути выше, чем в птицах, питающихся только растительным кормом.
Концентрации ртути у тюленей и китов нередко превышают 0,5 мкг/г мышечной ткани (особенно у старых особей). Из самых высоких (до сих пор полученных) значений следует отметить концентрации ртути в печени кольчатых нерп из западных районов Канадской Арктики (205 мкг/г) и печени китов у Фарерских островов (280 мкг/г). Что же касается белых медведей, то в их мехе содержание ртути колеблется от 1,6–1,7 мкг/г (в устье Лены и на острове Врангеля) до 18,5 мкг/г в заливе Амундсена (опять же у северного побережья Канады, вероятно, как следствие существования в этом регионе естественных геологических источников). Следует отметить, что биоаккумуляция ртути обычно увеличивается с ростом температуры в пределах нормальных физиологических процессов, как это показано, например, для моллюсков [48].
Важно иметь в виду, что значительная часть ртути, содержащаяся в водной биоте, обычно присутствует в виде метилртути. В качестве примера можно привести результаты исследования содержания ртути и метилртути в морских организмах Средней Адриатики, в котором показано, что в период с 1950 по 1985 г. в шести представителях водной биоты (кальмар, мидия, карась, султанка, пагелла и мерлуза) в заливе Каштела, в который ежедневно сбрасывалось по несколько килограммов ртути (с предприятия по производству хлора и щелочи), содержание ртути составляло от 0,14 до 9,0 мг/кг. После начала очистки сточных вод в 1985 г. ежедневные сбросы ртути уменьшились до 120 г, в результате чего и в морской биоте содержание ртути в 1988–1989 гг. уже составляло от 0,10 до 1,07 мг/кг. При этом содержание метилртути в тех же образцах в 1988–1989 гг. составляло от 0,05 до
0,96 мг/кг, т.е. от 50 до 90% [15].
158
