
Минералогия_2 / Бетехтин / betehtin_2
.pdfРаздел V
КИСЛОРОДНЫЕ СОЛИ (ОКСИСОЛИ)
Общие замечания. В этом последнем разделе неорганических мине ралов мы рассмотрим сложные соединения, с химической точки зрения представляющие собой соли различных кислородных кислот. По коли чественному составу этот раздел является наибольшим — к нему отно сятся почти две трети всех известных минералов. Этим определяется зна чение указанных соединений в минералогии.
Господствующее положение среди них занимают силикаты. Весьма мно гочисленны также сульфаты и фосфаты. Все они в земной коре распростране ны, естественно, только в твердом состоянии и являются продуктами хими ческих реакций, протекающих в самых различных геологических условиях.
Мы не будем подробно останавливаться на характеристике химиче ских особенностей кислородных солей вообще. Они детально разбира ются в курсах химии, и природные соли ничем принципиально от них не отличаются.
Напомним лишь, что среди солей прежде всего различают соли без водные и водные (т. е. содержащие в своем составе молекулы Н2О). Среди тех и других важно также различать:
1.кислые соли (например, NaHCO3 — нахколит, кислый карбонат натрия),
т.е. соли, содержащие вместо одного металлического катиона протон Н+1. В природных условиях кислые соли встречаются сравнительно редко;
2.нормальные, или средние, соли, пользующиеся наибольшим распро
странением в природе. Примеры: Са[СО3] — кальцит (известковый шпат), Ca[SO4] . 2H2O — гипс;
3.основные соли, т. е. соли, содержащие в своем составе ионы гидро ксила [ОН]1–, нейтрализующие избыточный положительный заряд кати онов. Эти соли широко распространены в природе. Примерами могут слу
жить: Cu2[CO3][OН]2 — малахит и Al2[SO4][ОН]4 . 7Н2О — алюминит. В основных солях анион [ОН]1–, как это устанавливается на целом
ряде примеров, может быть частично или полностью заменен другими анионами, чаще всего равновеликим анионом F1–, иногда O2– и Cl1– (без изменения общей структуры соединения). Все такие соли, включая и соли с OH, мы будем называть солями с добавочными анионами.
Двойные и более сложные соли как определенные соединения от прос тых солей отличаются тем, что катионы или анионы, или те и другие вме сте, представлены разными ионами, изоморфно не замещающими или
Раздел V. Кислородные соли (оксисоли) |
387 |
ограниченно замещающими друг друга. Примеры: CaMg[CO3]2 — доло мит, Na6Mg2[CO3]4[SO4] — тихит и др.
В солях переменного состава имеет место как изовалентный, так и гете ровалентный изоморфизм. В последнем случае всегда устанавливается уравновешивание положительных и отрицательных зарядов в соединени ях. Примеры: (Mn,Fe)[CO3] — Fe родохрозит, Са5[PO4,SiO4,SO4]3[F,ОН] — силико сульфатный фторапатит (вилькеит) и др.
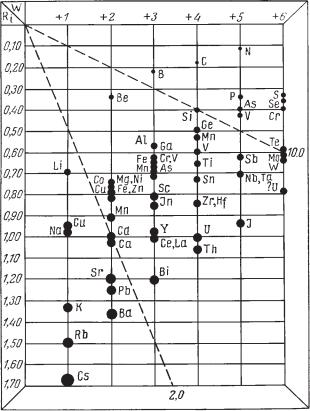
Кристаллохимические особенности соединений. Характерной осо бенностью кристаллохимии кислородных солей является наличие в их кристаллических структурах комплексных анионов: [NO3]1–, [СО3]2–, [SO4]2–, [РО4]3– и т. д. Катионы, располагающиеся в центрах этих групп, обладают малыми размерами ионных радиусов, высокими зарядами (рис. 206) и ковалентно связаны с ионами кислорода.
Рис. 206. Диаграмма главнейших катионов, распространенных в природных соединениях
Очень важно обратить внимание в этих группах на прочность связи ионов кислорода с центральным катионом, определяемую так называемой электростатической валентностью, т. е. величиной заряда, приходящегося
388 |
Описательная часть |
от катиона на каждый окружающий его ион кислорода. Так, в комплекс ном анионе [NO3]1–, состоящем из N5+ и трех окружающих ионов О2–, каж дый кислород получает пай заряда 5 : 3, в анионе [СО3]2– эта величина составляет 4 : 3, анионе [SO4]2– — 6 : 4, анионе [РО4]3– — 5 : 4 и т. д.
Как видим, это отношение всюду превышает 1 (т. е. больше половины валентности кислорода уходит на связь с центральным катионом), и толь ко для [ВО3]3– и [SiO4]4– оно равно 1. Это означает, что ионы кислорода прочнее связаны с малыми катионами внутри комплексов, чем с катио нами, расположенными в кристаллических структурах вне комплексных анионов. В этом отношении кислородные соли весьма существенно от личаются от сложных окислов, для которых величины электростатиче ской валентности связи между катионами и окружающими их ионами кис лорода всегда меньше 1.
Таким образом, комплексные анионы представляют собой прочно связанные в одно целое компактные группы, участвующие в кристал лических структурах как самостоятельные структурные единицы. Са мостоятельность их подчеркивается тем, что эти группы не распадают ся и при растворении солей. От простых анионов они существенно отличаются по форме и, естественно, по размерам. Анионы типа XO4 имеют тетраэдрическую координацию и по форме близки к изометри ческим телам. Анионы типа ХO3 обладают формой плоских треуголь ников (СО3, ВО3), реже тупых пирамид (AsO3 и др.), в которых ионы кислорода «сидят» по углам треугольника, а связывающий их катион — над центром этого треугольника.
Кроме простых по конфигурации комплексных анионов, как мы по том увидим, существуют и более сложные радикалы. Характерно, что они свойственны боратам и силикатам, т. е. солям наиболее слабых кислот.
Соли других, более сильных кислот характеризуются кристалличе скими структурами с типичной ионной связью, подобно тому, как это име ет место в галогенидах, с той только разницей, что роль простых анионов здесь играют комплексные анионы. Поэтому неудивительно, что они по ряду физических свойств очень близко напоминают минералы, относя щиеся к хлоридам и фторидам.
Список главнейших простых по строению комплексных анионов, рас пространенных в природных кислородных солях, приведен в табл. 10, в порядке увеличения значений ВЭКов или ионных потенциалов. Там же приведены и размеры анионов в виде ионных «радиусов» (по А. Е. Ферс ману). Необходимо заметить, что в буквальном смысле о каких либо ра диусах комплексных анионов не может быть и речи. Приведенные в таб лице значения получены А. Е. Ферсманом путем расчета и сугубо приблизительны. Однако для общих соображений о свойствах минера лов эти ориентировочные величины являются полезными, особенно если учесть, что такие свойства, связанные с энергией кристаллической струк
|
|
|
|
Раздел V. Кислородные соли (оксисоли) |
389 |
|||
|
|
|
|
|
|
|
Таблица 10 |
|
|
|
Комплексные анионы важнейших природных кислородных солей |
||||||
|
|
|
|
|
|
|
|
|
Анионы |
«Ri» |
ВЭК |
Ионный |
Форма аниона |
|
|||
потенциал |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[NO |
|
]1– |
2,57 |
0,19 |
0,39 |
Треугольник |
|
|
3 |
|
|
3,00 |
0,34 |
0,67 |
Тетраэдр |
|
|
[CrO ]2– |
|
|||||||
[SO |
|
4 |
2,95 |
0,34 |
0,68 |
>> |
|
|
]2– |
|
|||||||
4 |
|
|
|
2,57 |
0,39 |
0,78 |
Треугольник |
|
[CO ]2– |
|
|||||||
3 |
|
|
3,00 |
0,50 |
1,00 |
Тетраэдр |
|
|
[PO ]3– |
|
|||||||
4 |
|
]3– |
2,95 |
0,51 |
1,02 |
>> |
|
|
[AsO |
|
|||||||
[BO |
|
4 |
|
2,68 |
0,56 |
1,12 |
Треугольник |
|
|
]3– |
|
||||||
3 |
|
|
2,90 |
0,69 |
1,38 |
Тетраэдр |
|
|
[SiO ]4– |
|
|||||||
4 |
|
|
|
|
|
|
||
туры, как твердость, плавкость, летучесть, относительная растворимость
идр., мы практически расцениваем по очень грубым шкалам.
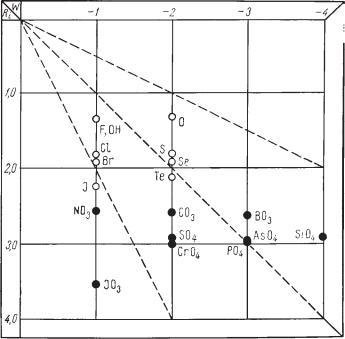
Вболее наглядной форме приведенные в таблице значения показаны на диаграмме (рис. 207). Для сравнения нанесены в виде полых кружков также одновалентные простые анионы ранее рассмотренных галогенидов
идвухвалентные простые анионы, входящие в состав окислов, сульфи дов, селенидов и теллуридов.
Рис. 207. Приблизительные размеры комплексных анионов (черные кружки) в сравне нии с размерами простых анионов, распространенных в природных соединениях
390 |
Описательная часть |
Так как подавляющая масса кислородных солей представляет собой типичные ионные соединения, то естественно, что устойчивость кристал лических структур в значительной мере должна зависеть от соотноше ний размеров катионов и анионов как структурных единиц. Для кисло родных солей эти соотношения невозможно выразить в каких либо цифровых значениях, так как размеры комплексных анионов мы не мо жем выразить в радиусах в силу того, что они по своей конфигурации существенно отличаются от шаровой формы, которую мы условно при писываем простым ионам.
Однако не может быть никакого сомнения в том, что такие изометри ческие комплексные анионы, как [SO4]2–, [PO4]3– , [SiO4]4– и др., по своим размерам должны быть существенно больше, чем простые анионы (напри мер, O2–). Поэтому не случайно, что эти анионы в простых соединениях типа АХ (где X представлен комплексным анионом) наиболее устойчивые кристаллические структуры дают только в сочетании с крупными катио нами. Эти соединения действительно являются труднорастворимыми, труд ноплавкими и труднолетучими. Обратимся к примерам.
Двухвалентный анион [SO4]2– в соединениях типа АХ (т. е. с соотно шением катион : анион, равным 1 : 1) образует следующие наиболее ус тойчивые соединения (сульфаты): BaSO4 — барит и PbSO4 — англезит, т. е. в сочетании с самыми крупными двухвалентными катионами (см. ко лонку двухвалентных катионов на рис. 206). С этой точки зрения понят ной становится также изоморфная примесь Ra2+ и Ва2+, устанавливаемая иногда в баритах (ионный радиус Ra2+ несколько больше, чем Ва2+). Не удивительно, что в зонах окисления урановых месторождений, содержа щих сульфиды в условиях действия сульфатных вод, концентрация ра дия по отношению к урану выше, чем это имеет место в зоне первичных руд (соединения шестивалентного урана в этих условиях значительно более растворимы по сравнению с сульфатом радия).
Что касается двухвалентных катионов с малыми ионными радиуса ми, то они в природных условиях могут образовывать только водные суль фаты, кристаллизующиеся при низких температурах и притом в послед ние стадии кристаллизации растворов. В большинстве случаев водные соли содержат 2, 4, 6 и 7 молекул H2O. Рентгенометрические исследова ния соединения Ni[SO4] . 6H2O показали, что катион Ni2+ в кристалли ческой структуре непосредственно окружен шестью электрически нейт ральными (т. е. не погашающими заряд катиона) молекулами воды. Вследствие этого объем таких гидратированных катионов как бы искус ственно увеличивается, благодаря чему и становится возможной построй ка кристаллической структуры с участием таких крупных анионов, как [SO4]2–. С кристаллохимической точки зрения формулу этого соедине ния было бы правильнее писать так: [Ni(H2O)6][SO4]. Такие водные соли обладают явно повышенной или высокой растворимостью и легко под

Раздел V. Кислородные соли (оксисоли) |
391 |
вергаются обезвоживанию, причем кристаллические структуры их пре терпевают перестройки или вовсе разрушаются.
Интересно отметить, что средний по размерам катион Ca2+ (см. рис. 206) хотя и способен в известных условиях образовать безводный суль фат Ca[SO4] (ангидрит), однако в присутствии воды он переходит в бо лее устойчивое водное соединение Ca[SO4] . 2H2O (гипс)1. Последний, по рентгенометрическим данным, обладает слоистой структурой, в которой молекулы Н2О располагаются между листами, сложенными ионами Са2+ и [SO4]2 . Этим обусловлена весьма совершенная спайность кристаллов гипса в данном направлении.
Если мы перейдем к трехвалентному аниону [РО4]3–, то увидим ана логичную сульфатам картину. Среди трехвалентных катионов (см. рис. 206) наиболее крупными, могущими образовывать с этим ионом устой чивые кристаллические структуры, являются редкие земли (Се...) и La. В природе действительно распространен очень стойкий фосфат редких земель — (Ce,La...) [РО4] (монацит). При разрушении горных пород он как весьма устойчивый химически минерал переходит в россыпи. Не слу чайно, что главные концентрации редкоземельных элементов связаны именно с этим минералом. Реже встречается другой, менее стойкий фос фат Y[РО4] (ксенотим). Фосфаты малых трехвалентных катионов (Al, Fe3+, Mn3+) в природе представлены водными солями.
Замечательно, что для аниона [SiO4]4– наиболее стойкими являются соединения с крупными четырехвалентными катионами (Zr4+, Th4+ не редко с изоморфной примесью урана U4+): циркон — Zr[SiO4] и торит — (Th,U)[SiO4].
Кристаллические структуры торита и его разновидностей разруша ются лишь вследствие радиоактивного распада. Циркон, не содержащий радиоактивных элементов,— весьма стойкий минерал, свидетельством чему является широкая распространенность его в виде окатанных зерен в россыпях и осадочных образованиях самых различных возрастов. В ви де этого минерала выделяется главная масса циркония в земной коре. Лишь в магмах, бедных кремнеземом и богатых щелочами, он способен образовывать другие минералы.
Классификация кислородных солей. Систематику солей принято да вать по кислотным радикалам или, что то же самое, по комплексным анио нам. Порядок расположения можно принять тот, который намечается по величинам ВЭКов или ионных потенциалов (см. табл. 10). Рассмотрение кислородных солей вслед за окислами, в частности минералами группы кварца, следовало бы начать с более близких к ним в кристаллохимическом отношении силикатов и боратов и кончить иодатами, т. е. в порядке пони жения ионных потенциалов анионов. Однако в целях лучшего усвоения
1 С меньшим количеством молекул Н2О, нежели в предыдущем случае.

392 Описательная часть
материала мы примем обратный порядок изучения относящихся сюда ми нералов, исходя из принципа «от простого к сложному» (причем карбона ты рассмотрим до сульфатов).
Таким образом, среди минералов, представляющих кислородные соли,
выделим следующие классы. |
|
||
1. |
Нитраты. |
5. Молибдаты и вольфраматы. |
|
2. |
Карбонаты. |
6. |
Фосфаты, арсенаты и ванадаты. |
3. |
Сульфаты. |
7. |
Бораты. |
4. Хроматы. |
8. Силикаты и алюмосиликты. |
||
КЛАСС 1. НИТРАТЫ
Общие замечания. Азот в земной коре известен исключительно в виде комплексных ионов [NO3]1–, [NH4]1+ и газа в атмосфере.
Нитраты, как легкорастворимые в воде соли сильной азотной кислоты — HNO3, распространены почти исключительно в современных образовани ях в жарких пустынных странах. Источником азота в них является азот воздуха. Реакции окисления этого элемента имеют по преимуществу био генный характер, т. е. связаны с бактериальными процессами в почвах, или же, возможно, с разрядами атмосферного электричества (на высоких плос когорьях). Наиболее важное значение имеют нитраты щелочей — K и Na. Подчиненную роль играют нитраты щелочных земель — Mg, Ca и Ba. В зо нах окисления медных месторождений в условиях пустынного выветрива ния встречаются редкие нитраты Cu сложного состава. Известны также соединения нитратов с гидратами и солями других кислот.
|
НАТРИЕВАЯ СЕЛИТРА — Na[NO3]. Синоним: чилийская селитра. |
||
|
Химический состав. Na2O — 36,5 %, N2O5 — 63,5 %. |
||
|
Сингония тригональная; дитригонально скаленоэдрический в. с. |
||
L3 |
– |
). a = 5,07; с = 16,81. Изоструктурен с кальци |
|
3L23PC. Пр. гр. R3c(D6 |
|||
6 |
3d |
0 |
0 |
том. Кристаллизируется в ромбоэдрах, очень близких по полярному углу к
ромбоэдрам кальцита. Характерно, что и ряд других свойств сходен с каль |
||
– |
– |
– |
цитом. Двойники по (0112), |
а также по (0001), (0221), (1011). Обычно на |
|
блюдается в сплошных зернистых массах в виде корок или выцветов. Цвет белый, серый, красновато бурый, лимонно желтый. Блеск стек
лянный. Nm = 1,585.
Твердость 1,5–2. Хрупка. Спайность по ромбоэдру {1011} совершен ная. Уд. вес 2,24–2,29.
Диагностические признаки. П. п. тр. на угле дает вспышку; легко пла вится, окрашивая пламя в желтый цвет (Na). Легко растворяется в воде. Вкус слегка солоноватый, охлаждающий.
Происхождение и месторождения. Образуется в сухих жарких об ластях, лишенных растительности, при биохимическом разложении (окислении) азотсодержащих органических веществ (гуано и прочие от
Раздел V. Кислородные соли (оксисоли) |
393 |
бросы птиц и животных), а также микроводорослей, нитробактерий и пр. Редко выпадающие атмосферные осадки смывают образовавшуюся се литру в ложбины, где с течением времени образуются селитряные солон чаки или даже сплошные скопления селитры.
В парагенезисе с селитрой встречаются: гипс, мирабилит (водный сульфат натрия), галит, изредка иодаты и другие минералы.
Исключительно крупные залежи натриевой селитры находятся на высокогорном плато в Чили у подножия горной цепи Кордильер. Эта об ласть в течение многих миллионов лет, начиная с позднемеловой эпохи, представляет собой пустыню с чрезвычайно жарким сухим климатом (дожди выпадают один раз в течение 4–5 лет).
Небольшие селитряные месторождения, главным образом калиевой селитры, в виде пухлых селитряных солончаков на холмах и в ложбинах, довольно широко распространены в Казахстане (Закаспий) и в Средней Азии. Корки и выцветы селитры появляются периодически в засушли вые месяцы. Ее образования являются результатом процессов разложе ния и нитрификации отбросов древних городов и крепостей, а также тех микроводорослей и нитробактерий, которые развиваются на глинобит ных стенах древних построек. В горных частях Алтая, Крыма и в других местах скопления селитры явно животного происхождения связаны с пастбищами и стойбищами скота.
Практическое значение: 1) селитра является лучшим из минераль ных удобрений; 2) как сильный окислитель используется в металлургии при переработке никелевых руд; 3) в стекольной промышленности упо требляется для очистки стекла; 4) в пищевой промышленности — при кон сервировании рыбы, мяса и пр.; 5) применяется для изготовления черно го пороха и различных взрывчатых веществ.
Существует промышленный способ получения синтетическим путем азотистых соединений (аммиака и азотной кислоты) из азота воздуха в присутствии катализаторов. В связи с этим добыча селитры в разных стра нах резко упала. Однако для удовлетворения нужд местной промышлен ности месторождения селитры не потеряли своего значения.
КАЛИЕВАЯ СЕЛИТРА — KNO3. Синоним: индийская селитра. Сингония ромбическая, ромбо дипирамидальный в. с. Пр. гр. Рпта.
а0 = 5,42; b0 = 9,17; с0 = 6,45. Встречается в виде рыхлых белых корочек и выцветов аналогично натриевой селитре. Nт = 1,505. Твердость 2. Спай8 ность по (011) совершенная. Уд. вес 1,99. П. п. тр. ведет себя аналогично натриевой селитре.
Калиевая селитра имеет более широкое распространение, чем на триевая селитра. Раньше в значительных количествах она добывалась в Индии (месторождения выработаны). В виде выцветов и корок ши роко распространена большей частью в тех же районах, что и натрие вая селитра.
394 |
Описательная часть |
КЛАСС 2. КАРБОНАТЫ
Общие замечания. В этом классе мы встречаем уже весьма значитель ное число минеральных видов, многие из которых пользуются сравни тельно широким распространением в природе. Особенно это относится к Са[СО3], который нередко слагает огромные толщи осадочно морского происхождения. Часто карбонаты являются также спутниками рудных минералов в месторождениях, а в ряде случаев сами представляют про мышленный интерес как источники ряда важных металлов, например, марганца (в виде родохрозита) и железа (в виде сидерита).
Анион [СО3]2– способен давать более или менее устойчивые соедине ния с катионами двухвалентных металлов, обладающими средними и большими ионными радиусами. Число таких металлов невелико. Глав нейшие из них Mg, Fe, Zn Mn, Ca, Sr, Pb, Ba, а также Cu, Zn, Mn и др. с дополнительными анионами [ОН]1– и Cl1–.
Близкие к ним по размерам одновалентные катионы (Na, К, NH4) мо гут образовывать безводные карбонаты лишь при условии, если вместе с ними в кристаллическую структуру входит катион Н1+, т. е. в виде кис лых солей. Водные карбонаты характерны и для катиона Mg2+, вообще склонного к гидратации в водных средах.
Карбонаты трехвалентных металлов известны для редких земель с дополнительным анионом F1–. Из числа малых трехвалентных катио нов в карбонатах изредка встречается лишь Аl3+ и то в виде двойных и притом водных солей в сочетании с двухвалентными металлами (Cu, Pb).
Карбонатов четырех и пятивалентных металлов не существует. Ше стивалентный уран дает редкий безводный карбонат с добавочным анио ном О2– — UO2(CO3) (рёзерфордит). Остальные известные карбонаты урана являются водными.
Из особенностей физических свойств карбонатов отметим следующие. Твердость безводных карбонатов никогда не бывает высокой. Обычно она колеблется от 3 до 5. Растворимость карбонатов в воде повышенная. Осо бенно это свойственно карбонатам щелочей и бикарбонатам тех элемен тов, катионы которых обладают либо относительно малыми ионными ра диусами (например, Mg2+, Co2+), либо, наоборот, очень большими размерами (например, Ва2+). Карбонат Cu2+ встречается только в виде ос новных солей, что связано, очевидно, с особенностями строения самого катиона. Этим же, вероятно, объясняются и интенсивные окраски карбо натов меди в зеленый и синий цвета. Все остальные карбонаты либо бес цветны, либо окрашены в бледные тона. Из оптических свойств для кар бонатов очень характерным является весьма высокое двупреломление (Ng–Np), обусловленное плоской формой аниона СО3.
Среди минералов этого класса мы прежде всего должны различать безводные и водные карбонаты. Среди тех и других выделим соответству ющие группы по типам изоструктурных химических соединений. Осталь

Раздел V. Кислородные соли (оксисоли) |
395 |
ные карбонаты, представленные единичными минеральными видами, сгруппируем по катионам.
Безводные карбонаты
1. Семейство кальцита
Это семейство включает большое число минеральных видов, представ ляющих карбонаты двухвалентных металлов, образующих следующий морфотропный ряд (в порядке возрастания ионных радиусов): Mg, Zn, Fe2+, Mn2+, Ca, Sr, Pb и Ba. Характерно, что ионы с меньшим радиусом, чем Са, образуют широкие изоморфные ряды минералов, кристаллизующихся в тригональной сингонии, а ионы с большим радиусом, чем у Са, образуют карбонаты ромбической сингонии. Карбонат самого кальция является ди морфным, т. е. может кристаллизоваться в той и другой сингониях.
Карбонаты: |
|
|
|
|
|
|
|
тригональной сингонии Mg |
Zn |
Fe2+ |
Mn2+ |
Ca |
|
|
|
0,74 |
0,83 |
0,80 |
0,91 |
1,04 |
|
|
|
ромбической сингонии |
|
|
|
Ca |
Sr |
Pb |
Ba |
|
|
|
|
1,04 |
1,20 |
1,26 |
1,38 |
Кристаллическая структура тригональной модификации Са[СО3] изображена на рис. 208 и 209.
Если кубическую структуру NaCl сдавить вдоль тройной оси на столько, что углы между гранями станут равными 101°55′, то получится
Рис. 208. Расположение ионов в ячейке |
Рис. 209. Модель кристаллической |
спайного ромбоэдра {1011}. Оба вида |
структуры кальцита. Черные шарики — |
ионов располагаются как в гранецентриро |
катионы кальция; светлые треугольники — |
ванных структурах |
анионы СО3 |
