
акушерство, гинекология и биотехника размножения
.pdfженные во время стадии возбуждения, усиливаются при приближении быка (Н. И. Полянцев). Исследования пока-
зали, что введение во влагалище коро-
вам и телкам секретов придаточных половых желез вазэктомированного быка также активизирует моторику матки
(Г. В. Сидоркин).
У разных млекопитающих переме-
щение спермиев от места эякуляции до
труб происходит от 15 с до 1...3 ч. У с о б а к и, как у животного с маточным
типом осеменения, уже через 25 с пос-
ле начала эякуляции спермии достига-
ют верхушек рогов. У о в ц ы спермии
проникают |
â |
яйцепроводы |
через |
|
0,5...1 ÷ (ïî |
данным некоторых |
àâòî- |
||
ров, через 6 мин) после осеменения. |
||||
|
В. Д. Нагаев обнаруживал спермиев |
|||
â |
яйцепроводах |
ê î ð î â û |
через |
|
3... |
14 ч; по других данным, они дости- |
|||
гают труб через 2,5 мин. |
|
|||
|
Ó ê î á û ë û |
спермии достигают |
||
яйцепровода |
через 30...60 мин |
после |
||
осеменения. |
|
|
|
|
|
Скорость продвижения спермиев по |
|||
половым путям самки зависит от пери-
ода стадии возбуждения, в который
производится естественное осемене-
ние, и от метода осеменения. Быстрее и в бó льшем количестве спермии попадают в верхушки рогов матки при осе-
менении в период половой охоты, ког-
да преобладают антиперистальтические сокращения матки, а после овуляции канал шейки матки суживается, становится более извилистым; в это время
преобладают перистальтические сокра-
щения матки, замедляющие продвижение спермиев.
На скорость продвижения спермиев влияет коитус. Так, при естественном осеменении спермии у свиней попада-
ют к яйцепроводам через 15 мин и про-
никают в них через 0,5...1 ч, а при искусственном — соответственно через
45 мин и выявляются в их просвете че-
рез 1,5...2 ч после осеменения.
Сроки переживаемости спермиев в
половом аппарате самки. Овуляция часто не совпадает во времени с проявле-
нием течки и полового возбуждения,
поэтому осеменение может не привести к оплодотворению из-за того, что спермии вводятся в половые органы
самки слишком рано (до овуляции)
или значительно позднее ее, т. е. когда
яйцеклетка еще не выделилась или уже
потеряла способность участвовать в оплодотворении. Очень важно иметь кон-
кретные сведения о сроках жизни
спермиев в половой сфере в зависимо-
сти от наличия и степени проявления
течки и других феноменов стадии возбуждения.
Известно, что наиболее неблагопри-
ятные для жизни спермиев условия
имеются во влагалище: максимальная
продолжительность жизни спермиев во влагалище кобыл 4...4,5 ч, во влагали-
ще овец и коров 1...6 ч.
Шейка матки у самок с влагалищным
осеменением — наиболее благоприят-
ный для жизни спермиев отдел половой системы. Спермии в шейке матки овцы
могут жить до 48 ч, а коровы — до 30 ч.
Но при введении спермы в шейку матки
после окончания охоты спермии погибают уже через 2...4 ч и не достигают вершины рогов матки. У свиней и ко-
был спермии живут в матке до 30...48 ч.
Экспериментально доказано, что у крольчих при искусственном осеменении высококачественной спермой с последующим коитусом через 8 ч с ва-
зэктомированным самцом в 90,9 %
случаев наступает беременность; при коитусе с вазэктомированным самцом через 20 ч после искусственного осеменения оплодотворение — в 12,9 % слу- чаев. Коитус через 30 ч после искусст-
венного осеменения не сопровождался
беременностью. Учитывая, что у кроль- чих овуляция происходит через 10 ч
после полового акта, приведенные дан-
ные можно расценивать как доказа-
101
тельство гибели через 40 ч всех спермиев, введенных в половой аппарат самок (30 ч от осеменения до коитуса с вазэк-
томированным самцом + 10 ч от коиту-
са до овуляции).
Результаты экспериментальных исследований и практических наблюде-
ний за эффективностью осеменения в зависимости от интервала между осеменением и овуляцией позволяют счи-
тать, что оплодотворяющая способ-
ность спермиев в половом аппарате самок млекопитающих сохраняется максимум в течение 36...48 ч.
3.1.2. ПРОДВИЖЕНИЕ ЯЙЦЕКЛЕТКИ
Эффективность осеменения зависит не только от спермия, но и от судьбы
яйцеклетки после ее выделения из
фолликула. В момент овуляции яйцек-
летка, окруженная лучистой короной
(клетки фолликулярного эпителия) (рис. 3.1.), вместе с фолликулярной
жидкостью выделяется в брюшную по-
лость.
Вследствие тесной связи яйцепрово-
да с яичником яйцеклетка обычно попадает на ответвления бахромки. Этому
же способствует помимо анатомичес-
ких особенностей динамические свой-
ства бахромки и яйцепровода.
У кобылы, свиньи, собаки и у некоторых других животных яичник заклю-
чен в бахромку, или складку, яйцепро-
вода; таким образом создаются такие
взаимоотношения, при которых выде-
лившаяся яйцеклетка, как правило, попадает непосредственно на бахромку. У
коровы, овцы, козы бахромка развита
сравнительно слабо и не может охва-
тить овуляционный участок яичника,
поэтому нельзя объяснить проникновение яйца в яйцепровод исключитель-
но эректильным состоянием бахромки.
Процесс этот некоторые исследователи
объясняют токами жидкости из брюш-
ной полости в матку. Возбудителем этих токов В. С. Груздев считает колебания
ресничек эпителия бахромки и яйцеп-
ровода. К. К. Скробанский объясняет
возникновение токов жидкости еще и сокращением брюшного пресса, повышающим внутрибрюшное давление в момент овуляции.
Сроки продвижения яйцевых клеток
по яйцепроводам, по-видимому, могут
11.Сроки жизни яйцеклеток, продвижения зигот и имплантации зародышей (по Р. Х.Хантеру)
|
Максималь- |
Поступле- |
Освобож- |
Начало |
|
ное время |
дение |
||
Животное |
жизни |
ние зигот |
зигот от |
имплан- |
яйцеклетки |
в матку |
прозрач- |
тации |
|
|
после ову- |
зароды- |
||
|
после |
ляции, ч |
íîé îáî- |
øåé, ñóò |
|
овуляции, ч |
|
лочки, сут |
|
|
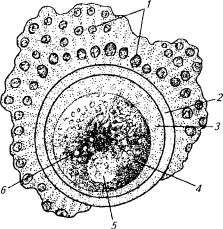
Рис. 3.1. Схема строения яйцевой клетки: |
Корова |
10... |
12 |
72... |
84 |
9... |
11 |
22 |
1 |
— клетки лучистого венца; 2 — прозрачная оболочка; |
Îâöà |
10... |
15 |
66... |
72 |
7... |
8 |
15 |
Свинья |
8 |
12 |
46 |
48 |
|
6 |
18 |
||
3 |
— перивителлиновое пространство; 4 — цитоплазма; |
|
|||||||
Лошадь |
8 |
10 |
140 |
144 |
|
8 |
37 |
||
5 |
— ÿäðî; 6 — желточные зерна |
|
102
сильно |
варьировать. |
Специальные |
цеклетки происходит медленно — при- |
опыты и клинические наблюдения по- |
мерно около 0,1 см в 1 ч. После овуля- |
||
зволяют |
допустить, что |
прохождение |
ции яйцеклетка способна к оплодотво- |
яйцеклетки по яйцепроводам у всех |
рению в течение 4...6 ч. |
||
животных составляет 1...3 сут. У коров |
Время жизни яйцеклеток у некото- |
||
яйцеклетка в течение первых 6...12 ч |
рых животных и поступление зигот в |
||
после овуляции проходит треть яйцеп- |
матку приведены в табл. 11. |
||
ровода. Дальнейшее продвижение яй- |
|
||
3.1.3. ОПЛОДОТВОРЕНИЕ И РАЗВИТИЕ ЗИГОТЫ
Оплодотворение — физиологичес-
кий процесс, заключающийся в слия-
нии яйцеклетки и спермиев. Во время
оплодотворения происходит взаимная ассимиляция (assimilatio — взаимопо-
глощение) и диссимиляция (dessimilatio — расподобление) яйцеклетки и
спермия, в результате которых уже не
существует ни яйцеклетки, ни спермия, а образуется новая, третья клет-
êà — зигота (от гр. zygotes — соединен-
ный вместе), не тождественная ее двум
первоисточникам.
Сложный процесс оплодотворения происходит в верхней трети яйцепро-
вода. Спермии быка непосредственно
перед оплодотворением должны не ме-
нее 6 ч находиться в абдоминальной части яйцепровода. За это время они «созревают» и становятся способными оплодотворять (см. иммунологические
отношения при оплодотворении). Опло-
дотворение может произойти только при достаточном скоплении спермиев. Количество их значительно колеблется даже у животных одного и того же вида.
Спермии ожидают яйцеклетку, кото-
рая, как и спермии, должна «дозреть». Этот процесс также происходит в яйцепроводе, куда яйцеклетка попадает в
стадии овоцита. Там она при наличии
активных спермиев выделяет направительные тельца и созревает. Сколько
времени требуется для «дозревания»
яйцеклетки, пока неясно. У овец, ви-
димо, не более 2 ч.
Оплодотворение включает несколь-
ко стадий.
П е р в а я с т а д и я — денудация — характеризуется тем, что яйцеклетка,
проходя по яйцепроводу, освобождает-
ся от окружающих ее фолликулярных
клеток (лучистого венца). Основная
роль в денудации принадлежит спермиям, которые, внедряясь между клет-
ками фолликулярного эпителия, выде-
ляют ферменты, главным образом гиа-
луронидазу. За счет этих ферментов и
неизвестных еще факторов разжижается гиалуроновая кислота, входящая в
состав студенистого вещества, связыва-
ющего клетки лучистого венца.
В т о р а я с т а д и я — процесс про-
никновения спермиев через прозрачную
оболочку яйцеклетки в околожелточ- ное пространство. Для оплодотворения
не обязательно полное освобождение
яйцеклетки от клеток лучистого венца. Данная стадия более видоспецифична. В это время заканчивается созревание яйцеклетки (выделение второго напра-
вительного тельца). Ядро, содержащее
гаплоидное число хромосом, превращается в женский пронуклеус.
Т р е т ь я с т а д и я оплодотворения характеризуется тем, что один, реже несколько спермиев проникают через
желточную оболочку яйцеклетки в ее
цитоплазму. Это уже строго специфи-
ческий процесс, поскольку в яйцеклет-
ку могут проникать только спермии своего вида. При этом проникает не
103

весь спермий, а лишь его головка и шейка. Внедрившись в цитоплазму яйцеклетки, спермий претерпевает боль-
шие изменения. Головка спермия быс-
тро увеличивается в десятки раз; вследствие ассимиляции цитоплазмой яйцеклетки она достигает размера ядра
яйцеклетки и превращается в мужской пронуклеус, имеющий, как и женский
пронуклеус, половинный набор хромо-
ñîì.
Ч е т в е р т а я с т а д и я характери-
зуется тем, что пронуклеусы (ядра яй-
цеклетки и спермия) постепенно сбли-
жаются, вступают в тесный контакт,
быстро уменьшаются и полностью сливаются. Этот процесс, основной в опло-
дотворении, еще недостаточно изучен.
Образуется качественно новая клетка
(зигота), ядро которой содержит дипло-
идное число хромосом. Образовавшаяся зигота, таким образом, имеет двойную
наследственность. Она получает могу-
чий стимул для дальнейшего развития и начинает быстро дробиться (рис. 3.2).
После первого деления зиготы обра-
зуются два бластомера (дочерние клет-
ки); оба бластомера дают четырех вну- чатых, а четыре внучатых — восемь правнучатых бластомеров и т. д. У мле-
копитающих такой закономерности
нет: число бластомеров у них даже в
начальных стадиях не всегда бывает
четным. В отличие от деления одноклеточных организмов, клетки, образую-
щиеся в результате деления зиготы, не
расходятся, а остаются соединенными;
в первый период общий размер заро-
дыша не изменяется, поэтому деление зиготы называется дроблением. Дробле-
ние зиготы коровы длится около 8 сут.
В течение первых 4 сут дробление про-
исходит в яйцепроводе, а затем в одном
из рогов матки. Уже через 48 ч после овуляции зигота состоит из двух блас-
томеров, через 72 ч — из трех, через
Рис. 3.2. Схема оплодотворения и продвижения зародыша по яй˝цепроводу в матку:
1 — яичник; 2 — лопнувший зрелый фолликул; 3 — воронка яйцепровода; 4 — яйцо с лучистым венцом; 5 — яйцо, освобожденное от лучистого венца; 6 — проникновение спермия через прозрачную оболочку яйц˝а;7 — образование зиготы (слияние мужского и женского пронуклеусов); 8 — яйцепровод; 9 — стадия двух бластомеров; 10 — стадия че- тырех бластомеров; 11 — стадия восьми бластомеров; 12 — стадия морулы; 13 — верхушка рога матки; 14 — стадия бластоцисты
104

84 ч — из шести и через 96 ч она поступает в стадии морулы в рог матки. Зигота по размеру равна яйцеклетке или
незначительно превышает ее, так как с
каждым дроблением при увеличении числа бластомеров размер каждого из них соответственно уменьшается.
Наружный слой бластомеров, прилегающий к прозрачной оболочке, называется трофобластом (питающим
листком); бластомеры, заключенные в
трофобласт, образуют эмбриобласт (зародышевый листок).
3.2. ТРАНСПЛАНТАЦИЯ ЗАРОДЫШЕЙ
Трансплантация зародышей — пере- |
в США от коровы-донора за год полу- |
нос зародышей из половых органов |
чено 136 телят, во Франции — 80, в |
животных-доноров в половые органы |
Германии — 57; в Российской Федера- |
животных-реципиентов. При этом в |
ции (ВИЖ) от 44 доноров — 261 теле- |
организме реципиентов наступает нор- |
нок; на Украине (НИИЖЛиП) от 6 до- |
мальная беременность с развитием за- |
норов — 71 теленок. |
родышей, а затем и плодов. |
Современные методы суперовуляции |
В области трансплантации зароды- |
позволяют увеличить в 10...20 раз число |
шей достигнуты рекордные результаты: |
образующихся в яичниках яйцеклеток: у |
Рис. 3.3. Схема пересадки зародышей
105
коров и овец — до 25, у свиней — до 40...45, у лошадей — до 5. Длительное сохранение зародышей позволяет созда-
вать запасы (банки зародышей) ценного
генетического фонда и экспортировать или импортировать зародышей высокопродуктивных и редких пород живот-
ных. Пересадка зародышей животных
мясных пород молочным коровам имеет
неоспоримое преимущество по сравне-
нию со скрещиванием мясных быков с такими коровами.
Работа по трансплантации складывается из следующих этапов: отбор доноров и реципиентов; вызывание мно-
жественной овуляции (суперовуляции)
у доноров и их осеменение; получение зародышей от доноров; оценка, культивирование и хранение зародышей; син-
хронизация полового цикла реципиен-
тов с половым циклом доноров; пере-
садка зародышей на стадии морулы или
бластулы реципиентам (рис. 3.3).
3.2.1. ОТБОР ДОНОРОВ |
|
|
|
Донор — это высокоценное, выдаю- |
осложнений при родах и в послеродо- |
||
щиеся животное, от которого после |
вой период. Первая стадия возбужде- |
||
гормонального вызывания полиовуля- |
ния полового цикла после родов долж- |
||
ции и осеменения спермой проверен- |
на быть синхронной и полноценной, с |
||
ного производителя-улучшателя полу- |
ярко выраженными феноменами: теч- |
||
чают несколько зародышей. Отбирают |
ки, полового возбуждения и охоты. |
||
только тех животных, которые облада- |
Операция |
пересадки |
зародышей |
ют способностью к множественной |
экономически выгодна только в том |
||
овуляции и дают в течение длительного |
случае, когда в качестве доноров берут |
||
срока их использования большое коли- |
выдающихся в племенном отношении |
||
чество зародышей, пригодных к пере- |
животных. В некоторых случаях для |
||
садке. В качестве доноров лучше ис- |
получения |
зародышей |
рекомендуют |
пользовать здоровых коров в возрасте |
использовать ценных в племенном от- |
||
4…5 лет с хорошо развитой молочной |
ношении коров в заключительные сро- |
||
железой, пригодной к машинному дое- |
ки их продуктивной жизни, чтобы по- |
||
нию, и у которых не было каких-либо |
лучить от них больше потомков. |
||
3.2.2. ВЫЗЫВАНИЕ СУПЕРОВУЛЯЦИИ |
|
||
Под способом вызывания суперову- |
овуляции, или полиовуляции, у коров, |
||
ляции яичников у коров подразумева- |
ремонтных телок и у молодых телочек |
||
ют последовательность (схему) воздей- |
до наступления половой зрелости; вто- |
||
ствия на организм донора биологи- |
рой подход — изыскание способов из- |
||
чески активными веществами, в ре- |
влечения яйцеклеток непосредственно |
||
зультате чего в яичнике созревает не |
из яичников с дальнейшим созданием |
||
1…2 яйцеклетки, а значительно больше |
условий для их созревания и оплодот- |
||
(20…30), что многократно увеличивает |
ворения in vitro. В настоящее время ис- |
||
воспроизводительную способность ко- |
пользуется в основном первый способ. |
||
ров-доноров. |
Животным, обычно в середине полово- |
||
В решении данной задачи имеются |
го цикла, вводят препараты гонадот- |
||
два принципиальных подхода: пер- |
ропных гомонов, вызывающих усилен- |
||
вый — это обеспечение множественной |
ный рост и развитие многих пузырча- |
||
106
тых фолликулов и их овуляцию на фоне обратного развития желтого тела.
Суперовуляцию считают достигну-
той, если произошло выделение не ме-
нее трех яйцеклеток (в отдельных случа- ях у животных их овулирует 100 и более). Однако основная цель гормональной
обработки — получение в результате су-
перовуляции 10...20 яйцеклеток.
У коров и телок для вызывания мно-
жественной овуляции раньше применяли гонадотропины гипофизарного и
плацентарного происхождения; для об-
работки используют разнообразные
схемы. Исследованиями последних лет
(А. М. Петров) установлено, что гонадотропный препарат СЖК за счет вы-
сокого содержания сиаловой кислоты
имеет период полураспада 6 сут, тогда
как охота у коров продолжается в сред-
нем 17 ч, а овуляция наступает через 12 ч; становится очевидным, что препа-
рат СЖК все еще воздействует на яич-
ники, вызывая выработку эстрогенов.
Наблюдения над экспериментальными
животными показали, что препарат СЖК приводит к кистозному перерож-
дению яичников, вызывая нимфома-
нию у коров. Кроме того, СЖК как
белковый продукт при воздействии на организм служит антигеном, вызывает выработку антител к СЖК. Поэтому
яичники коров-доноров, обработанных
СЖК, оказываются нечувствительными к повторным инъекциям данного препарата. Бесконтрольное применение препарата приводит к иммунному
бесплодию коров, так как на каждую
инъекцию СЖК в крови коров-доно- ров образуются антитела к СЖК.
С целью вызывания множественной овуляции в настоящее время применяют препараты фолликулостимулирую-
щего гормона (ФСГ). Суперовуляцию
можно вызывать ФСГ, получаемыми из гипофизов свиней и овец. Эти препа-
раты имеют короткий период активно-
сти. Так, период полураспада ФСГ из
гипофиза овец составляет 5 ч. По этой причине их назначают в снижающейся дозировке по 2 раза в день в течение
5 сут (в первый и второй дни утром и
вечером по 5 мг, третий день — соответственно по 4 мг, четвертый — по 3 мг и пятый — по 2 мг), всего 10 доз.
Вводить ФСГ обычно начинают с 9-х
по 11-е сутки полового цикла. В ряде
стран ФСГ используют в комбинации с
лютеинизирующим гормоном (ЛГ) в соотношении 5 : 1 или в сочетании с про-
стагландинами, которые инъецируют на
третий день после начала обработки; в
среднем через 48 ч после их введения у
животных-доноров проявляется стадия возбуждения полового цикла.
По некоторым сообщениям, после
применения препаратов ФСГ получают
больше зародышей, пригодных к пере-
садке, чем при использовании ГСЖК (А. М. Петров, 1996).
Также предлагают при использова-
нии ФСГ упростить стандартную схему
обработки и вместо двукратных прово-
дить одноразовые инъекции в течение 5 сут. Этим достигается снижение зат-
рат труда, уменьшение стрессорных
влияний обработок на донора и повы-
шается число овуляций с 6,4 до 8,1. При различных режимах обработки
число овулировавших фолликулов у
разных животных очень сильно варьи-
рует. Это зависит от индивидуальных особенностей животных и многих других факторов.
Коровы-доноры должны всегда по-
лучать полноценный рацион. Имеются
доказательства, что недостаточное кормление коров-доноров в период после введения ГСЖК заметно уменьшает количество овуляций. Исследования с помощью лапароскопа показали, что
множественная овуляция у коров и
телок является длительным процессом и после общепринятой обработки
(ÃÑÆÊ, ÔÑÃ + ÏÃÔ2) продолжается
24 ч и более.
107
3.2.3. ОСЕМЕНЕНИЕ ДОНОРОВ
Для осеменения доноров использу-
ют сперму выдающихся быков-произ-
водителей, проверенных по качеству потомства и признанных улучшателями продуктивности. Отбор быков и ра-
боту со спермой проводят с соблюде-
нием ветеринарно-санитарных правил
èсогласно действующей инструкции
по искусственному осеменению коров
èтелок. После гормональной обработ-
ки доноров у них с помощью быков-
пробников выявляют половую охоту не
менее 2 раз в день. Примерно у
10...12 % животных признаки стадии возбуждения полового цикла не прояв-
ляются. Осеменение животных, у кото-
рых обнаружена охота, проводят не-
сколько раз с 12-часовыми интервала-
ми до ее окончания, иногда его повто-
ряют 3...4 раза. В каждой дозе спермы должно быть не менее 40...50 млн живых подвижных спермиев. Чаще ис-
пользуют способ осеменения с рек-
тальной фиксацией шейки матки,
сперму вводят в ее канал.
Некоторые зарубежные авторы
предлагают вводить сперму в полость
тела матки. Имеются также рекомендации вводить одну порцию спермы в ле-
вый, а вторую — в правый рог матки.
Свежие спермии сохраняют жизнеспо-
собность в половых путях самок доль-
ше, чем замороженные и оттаянные. Поэтому при использовании свежей
спермы в течение охоты можно прово-
дить 1...2 осеменения. При этом дости-
гается более высокая степень оплодот-
воряемости.
3.2.4. ИЗВЛЕЧЕНИЕ ЗАРОДЫШЕЙ
Оплодотворение яйцеклеток проис-
ходит в яйцепроводе. Образовавшиеся зиготы подвергаются дроблению и
большинство из них у крупного рога-
того скота попадают в матку на 4-е
сутки. Зародыши целесообразно извлекать у коров на 7...8-е сутки, а у овец — на 5...6-е сутки после первого осеменения (до освобождения зароды-
ша от прозрачной оболочки). Для из-
влечения зародышей используют два
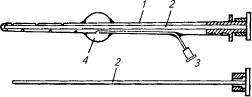
3.4.Катетер для извлечения зародышей:
1 — корпус катетера; 2 — мандрен; 3 — труба для нагнетания воздуха; 4 — баллончик для воздуха
способа: нехирургический и хирурги-
ческий.
Ïðè |
í å õ è ð ó ð ã è ÷ å ñ ê î ì ñ ï î - |
ñ î á å |
извлечения зародышей живот- |
ных фиксируют в станке. Прямую
кишку освобождают от содержимого и проводят тщательное ректальное ис-
следование. Определяют, сколько жел-
тых тел находится в каждом яичнике. Хвост с помощью тесемки фиксируют. Проводят туалет и дезинфекцию наружных половых органов и промежно-
сти. Для прекращения перистальтики
прямой кишки эпидурально водят 10 мл 2 %-го раствора новокаина.
Для вымывания зародышей из матки применяют различные инструменты. Чаще используют гибкий однохо-
довой катетер Фолея с упругим мандре-
íîì è |
надувным |
баллончиком |
(ðèñ. 3.4). |
Инструмент |
должен быть |
стерильным. Сперва катетер вводят во влагалище по верхнему его своду и
108
проводят под ректальным контролем через канал шейки матки в рог матки (рис. 3.5). Для более полного извлече-
ния зародышей нужно, не травмируя
слизистую оболочку, как можно глубже ввести инструмент в рог матки. После того как катетер достигнет в роге матки
необходимого положения, мандрен уда-
ляют и в баллончик катетера накачива-
ют 10...15 мл воздуха. При этом катетер
фиксируется в роге матки и промывная жидкость не вытекает мимо катетера.
Закрепив катетер, промывают по-
лость матки с помощью шприца Люэра
вместимостью 50...60 мл. В рог матки в
зависимости от его размера вводят порциями 40…60 мл промывной жидкости,
затрачивая на промывание каждого
рога не более 500 мл. Наполнение мат-
ки промывной средой и степень ее от-
тока контролируют ректально.
Для более полного извлечения заро-
дышей верхушку рога матки приподни-
мают и выпрямляют. Некоторые авто-
ры рекомендуют яйцепровод вблизи
верхушки рога матки осторожно зажать большим и указательным пальцами.
При этом предотвращается поступле-
ние в брюшную полость жидкости, со-
держащей зародыши. Однако практика показывает, что поступление в брюшную полость жидкости из рога матки
возможно только при наличии большо-
го давления в матке, поэтому яйцепровод можно не зажимать. Перед извле- чением катетера следует удалить воздух из баллончика. Таким же образом про-
мывают и второй рог.
В качестве среды для промывания используют фосфатно-буферный со-
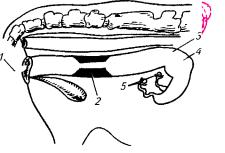
Рис. 3.5. Извлечение зародышей нехирургическим способом:
1 — катетер для извлечения зародышей; 2 — шейка и 3 — рог матки; 4 — надувной баллончик; 5 — яичники
левой раствор (ФБС) Дюльбекко (табл. 12).
Раствор готовят на тридистиллиро-
ванной воде. Первые четыре вещества
растворяют в 800 мл, а 5-е и 6-е — каждое
отдельно в 100 мл. В итоге получают три раствора, которые автоклавируют, а за-
тем смешивают. В таком виде их можно
хранить при 4 °С до 2 нед. Непосред-
ственно перед употреблением в ФБС
вводят следующие компоненты (в расче- те на 1 л): альбумин бычьей сыворотки —
4 г; глюкоза — 1 г (5,56 ммоль); натрий пируват — 0,036 г (0,33 ммоль); пеницил-
лин (калиевая соль) — 100 тыс. ЕД.
Собранную в цилиндр промывную жидкость отстаивают 20...35 мин при 20...37 °С, чтобы зародыши опустились на дно, после чего верхний слой удаля-
ют с помощью сифона. Нижний слой
жидкости порционно по 20...30 мл для обнаружения зародышей исследуют в больших часовых стеклах или чашках
12. Состав фосфатно-буферного солевого раствора Дюльбекко˝
Вещество |
ã íà 1 ë |
ммоль |
Вещество |
ã íà 1 ë |
ммоль |
|
|
|
|
|
|
NaCl |
8,00 |
136,87 |
KH2PO4 |
0,20 |
1,47 |
KCl |
0,20 |
2,68 |
CaCl2 · 2H2O |
0,13 |
0,90 |
Na2HPO4 · 12H2O |
2,90 |
8,09 |
MgCl2 · 6H2O |
0,10 |
0,49 |
109
Петри под бинокулярной лупой при |
бирают через катетер. При этом методе |
|
10...50-кратном увеличении. Найден- |
получают до 70 % жизнеспособных за- |
|
ных зародышей с помощью пастеровс- |
родышей. У кролика, свиньи, овцы, |
|
кой пипетки переносят в среду для |
коровы и кобылы можно извлекать за- |
|
кратковременного хранения |
(среда |
родышей непосредственно из яйцепро- |
Дюльбекко с добавлением 20 % феталь- |
вода (в течение первых 4 сут после осе- |
|
ной сыворотки теленка). После оценки |
менения). Однако хирургический спо- |
|
зародышей их культивируют при 37 °С |
соб, по мнению многих специалистов, |
|
до момента пересадки или оставляют |
имеет лишь научное значение. Он тру- |
|
для хранения. |
|
доемок, требует больших расходов, и |
Ïðè õ è ð ó ð ã è ÷ å ñ ê î ì |
ñ ï î ñ î - |
поэтому его применяют только у мел- |
б е зародышей извлекают при общем |
ких животных (овец, коз и др.). После |
|
или местном обезболивании. Разреза- |
операции у животного значительно |
|
ют брюшную стенку по белой линии |
снижается уровень молочной продук- |
|
или чаще в области голодной ямки |
тивности, имеется риск потери высо- |
|
справа или слева, подтягивают рог мат- |
коценного донора при общем обезбо- |
|
ки к поверхности раны, делают разрез |
ливании. Ее нельзя часто повторять, |
|
вблизи его основания и вставляют спе- |
так как в послеоперационный период |
|
циальный катетер. Затем через иглу, |
образуются спайки, из-за чего возника- |
|
введенную в полость рога у его верхуш- |
ют трудности в извлечении зародышей, |
|
ки, или через канюлю, вставленную в |
а затем могут развиваться необратимые |
|
яйцепровод, вводят специальную сре- |
изменения, приводящие к бесплодию |
|
ду, которую вместе с зародышами со- |
доноров. |
|
3.2.5. ОЦЕНКА, КУЛЬТИВИРОВАНИЕ И ХРАНЕНИЕ ЗАРОДЫШЕЙ
Частота отклонений от нормы у яй-
цеклеток, выделившихся во время су-
перовуляции, более высокая, чем при овуляции у животных без гормональных обработок. Поэтому после суперовуляции оплодотворяются не все яйцеклетки, а из оплодотворившихся яй-
цеклеток не всегда развиваются полно-
ценные зародыши, пригодные к пересадке. В связи с этим для достижения высоких результатов отбирают зародышей, способных к дальнейшему
развитию в организме реципиента.
Наиболее широкое распространение получили способы оценки качества и жизнеспособности зародышей по мор-
фологическим признакам и по резуль-
татам их культивирования.
Морфологическую оценку зароды-
шей проводят с использованием инвертированного микроскопа МБИ-13.
При этом учитывают соответствие ста-
дии развития зародыша его возрасту,
целостность и форму прозрачной оболочки, равномерность дробления бластомеров и состояние их цитоплазмы, величину и прозрачность перивителлинового пространства. Зародыши с при-
знаками дегенерации, уродств и недо-
развития для пересадок не пригодны. (Подробно методика изложена в «Практикуме по акушерству, гинекологии и биотехнике размножения живот-
íûõ»).
После морфологической оценки зародыши до пересадки можно кратковременно хранить в термостате при
37 °С. При этом их помещают на часо-
вое стекло в 0,5 мл среды Дюльбекко с
добавлением 20 % фетальной сыворот-
ки крови теленка или овцы. Часовые стекла с зародышами ставят в чашки
110
