Реакции катионов группы - 1-6
.doc|
|
Катионы группа |
Груп. реагент |
Р-ция, эффект, избыток группового реагента |
Специфические реакции |
|
I |
К+ |
– |
– |
1. К+ + HС4Н4О6– = КНС4Н4О6 белый крист; р-цию обнаружения ионов К+ выполняют в нейтр. среде Растворимость осадка увелич. при повыш. темпер, поэтому его осажд. способствует охлаждение исследуемого р-ра. Потирание внутри стенки пробирки стекл. палочкой ускоряет выпадение осадка 2. H2C4H4O6 + K+ = KHC4H6O6 + H+ NН4+ мешают определению ионов калия (тоже образ. аналогичн. осадок) 3. 2К+ + Na+ + [Со(NO2)6]3– =К2Na[Со(NO2)6] Желтый крист. ос, раств. в мин. к-тах, образован нестойк. к-ты при pH<4 NН4+ 4. 2К+ + РЬ2+ + [Сu(NО2)6]4– (нейтр. ср) = К2РЬ[Сu(NO2)6] NН4+ 5. соли калия окрашив бесцветное пламя горелки в фиолетовый цвет, а при рассмотрении через синее стекло – в пурпурно красный |
|
I |
Na+ |
– |
– |
1. Na+ + [SЬ(ОН)6] – = Na[SЬ(ОН)6] белый крист. ос, охлажд. р-ра и потирание стекл. палочкой внутр стенки пробирки, в сильнощел. среде осад. не образ [SЬ(ОН)6] – + H+ = H[SЬ(ОН)6] в кислой ср. реагент разлаг. с образ. б.а.осадка метасурьмяной к-ты HSЬО3, нейтрал или слабощел среда NН4+ H[SЬ(ОН)6] = HSЬО3 + 3H2O белый аморфный ос 2. соли натрия окрашив бесцветное пламя горелки в желтый цвет |
|
I |
NН4+ |
– |
– |
1. NН4+ + OH– = NН4OH = NН3 + H2O газообразный аммиак можно опред: по запаху, по окраш влажной красной лакмус. бумажки в синий цвет (лакмус бумажка не должна касаться стенок пробирки). Р-ция чувствительна и специфична. Определению ионов аммония не мешают другие катионы 2.
NН4+
+ 2[НgІ4]2–
+
4OH–
=
желто-бурый или красно-бурый аморфн ос. В кислой среде реагент разруш с образ. красн.осад. НgS2, поэтому р-цию провод. в нейтр или щелочн среде. Эта р-ция чрезвыч. чувствит и потому её использ в фарм анализе при опрделен ионов аммония и аммиака как примесей |
|
II |
Ag+ |
НCl |
1. Аg+ + Cl– = AgCl белый твор. AgCl + Cl– = [AgCl2] – образ комплексн.ион 2. AgCl + 2NН3*Н2О = [Ag(NН3)2]+ +2Н2О + Cl– серебра хлорид в отлич. от ртути (I) раст-сь в р-ре аммиака. Эту р-цию испол для отделен. AgCl от Hg2Cl2. Не рекоменд. добавл. изб. гр. реагента |
1. Аg+ + 2I– = AgI2 малораств. соедин. желтого цв 2. 2 Аg+ + CrO42– = Аg2CrO4 кирпично-красного цвета Аg2CrO4 + 4NН3*Н2О = 2[Ag(NН3)2]+ + CrO42– + Н2О легко раств. в р-ре аммиака 2Аg2CrO4 + 2Н+ = 4Аg+ + Cr2O7– + Н2О хроматы кат II гр. раств. в азотной к-те 3. 2Аg+ + SO42– = Аg2SO4 белый цв. соли, малораств в воде 4. Аg+ + ОН– = АgOН белый ос 2АgOН = Аg2О + Н2О быстро буреет вследств. разлож. с образ. Аg2О |
|
II |
Нg22+ |
1. Нg22+ + 2Cl– = Hg2Cl2 белый Hg2Cl2 + Cl– = [Hg2Cl3] – – обр. комн. Не рекоменд. добавл. изб. гр. реагента 2. Нg2Cl2 + 2NН3*Н2О = [NН2Hg2]Cl + NН4+ + Cl– + 2H2O [NН2Hg2]Cl2 = NН2HgCl + Hg Чернеет вследств. образ. мелко дисперсной металлической ртути. Эти р-ции испол. Для обнар. ионов Нg22+ |
1. Нg22+ + 2ОН– = Нg2O+ Н2О все гидрокс. и оксиды катионов II гр. раств. в азотной к-те 2. Нg22+ + 2S– = Нg2S2 ртуть(I) йодид реагир. с избыт. реагента с образ. растворимого компл. И черн.осад. метеллич. ртути: Нg2S2 + 2S– = [НgS4]2– + Hg 3. Нg22+ + CrO42– = Hg2CrO4 4. Нg22+ + SO42– = Нg2SO4 соль белого цв., малораств в воде |
|
|
II |
Pb2+ |
Pb2+ + 2Cl– = PbCl2 белый ос Осад. хлоридов катионов II гр. частично раств. в избытке конц. хлороводород. к-ты с образ. компл.: PbCl2 + 2Cl– = [PbCl3] – – в связи с этим не рекоменд. добавл. изб. гр. реагента PbCl2 - растворяется в горячей воде |
1. Pb2+ + 2I– = PbI2 Золотисто-желтого цвета, раств. в горячей воде и уксусной к-те 2. Pb2+ + CrO42– = Pb2CrO4 желтого цв. Pb2CrO4 + 4РЬ(ОН)2 = [РЬ(ОН)4] 2– + CrO42– раствор. в р-рах NaOH или KOH 3. Pb2+ + SO42– = PbSO4 соль белого цв., малораств в воде PbSO4 + 4ОН– = [РЬ(ОН)4] 2– + SO42– раствор. в к-тах и 30% р-ре аммония ацетата: PbSO4 + 2CH3COO– = [Pb(CH3COO)2 * PbSO4] + SO42– 4. РЬ(ОН)2 + 2ОН– = [РЬ(ОН)4] 2– –имеет аморфн. св-ва и раствор. в избытке реагента |
|
|
III |
Ва2+ |
H2SO4 + C2H5OH
|
Ba2+ + SO42– = BaSO4 белый крист. не растворяется в кислотах и щелочах |
1. Ba2+ + CrO42– = BaCrO4 2BaCrO4+ 2H+ = 2Ва2+ + Cr2O72– + Н2О растворяется в сильных кислотах (HCl) 2. Ba2+ + C2O42– = BaC2O4 белый крист. ос BaC2O4+ 2H+ = Ва2+ + Н2C2O4 все осад. III гр. раствор. в сильн. к-тах, но не раств в разб. уксусн. к-те. Эти св-ва испол. для обнаруж ионов Ca2+. Обнаруж. мешают ионы Ва2+ и Sr2+ 3. соли бария окраш. пламя в желто-зеленый цвет 2Ba2+ + Cr2O72– + Н2О = 2BaCrO4+ 2H+ - только на катионы Ba2+ (Cr2O7) |
|
III |
Sr2+ |
Sr2+ + SO42– = SrSO4 белый крист. не растворяется в кислотах и щелочах |
1. Sr2+ + CrO42– = SrCrO4 2SrCrO4+ 2H+ = 2Sr2+ + Cr2O72– + Н2О SrCrO4 + CH3COOH = Sr2+ + НCrO4– + CH3COO– – это св-во использ. Для отделения и обнаруж. катиона Ba2+ а присутств. катионов Sr2+ и Ca2+ В уксусн. к-те при действ. р-ра K2CrO4 на смесь кат. III ан. гр. образ. только осад. BaCrO4 2. Sr2+ + C2O42– = SrC2O4 белый крист. ос 3. соли стронция окраш. пламя в карминово-красный цвет |
|
|
III |
Ca2+ |
Ca2+ + SO42– = CaSO4 белый крист. (крупн) раств. в (NH4)2SO4: CaSO4 + SO42– = [Ca(SO4)2] 2– Использ. для отдел. ионов Ca2+ |
1. Ca2+ + C2O42– = CaC2O4 белый крист. 2. соли кальция окраш. пламя в кирпично-красный цвет Кальция хромат хорошо раствор в Н2О (SCaSO4 = 2,7*10–2 моль/дм3) |
|
|
Катионы группа |
Груп. реагент |
Р-ция, эффект, избыток группового реагента |
Специфические реакции |
|
|
IV |
Al3+ |
NaOH + H2O2 |
Al3+ + 3OH− = Al(OH)3 белый осадок Al(OH)3 + 3OH− = [Al(OH)6]3−
|
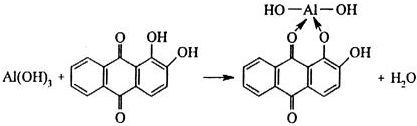
1. Действие ализарина
"Алюминиевый лак", соль ярко-красного цвета 2. Al3+ + CH3COO– = Al(OH)2CH3COO белый осадок при нагревании 3. 4Al(OH)3 + 2Co(NO3)2 = 2Co(AlO2)2 + 4NO2 + O2 + 6SO3 «тенарова синь» сухой способ [Al(OH)6]3− + 3NH4+ = Al(OH)3 + 3NH3*H2O |
Обнаруживают ионы Al3+ после отделен. их от др. кат
|
|
IV |
Sn2+ |
Sn2+ + 2OH− = Sn(OH)2 белый, раств в избытке Sn(OH)2 + 4OH− изб = [Sn(OH)6]4− белый р-р [Sn(OH)6]4− + H2O2 = [Sn(OH)6]2− + 2OH− |
[Sn(OH)6]4– + 4H2O =H4[Sn(OH)6]2– + 4OH− нестойк, разруш При кипячен. нитрат гидролиз |
||
|
IV |
Sn(IV) |
[SnCl6]2− + 4OH− = Sn(OH)4 + 6Cl– белый р-р
|
– |
||
|
IV |
As(III) |
AsO33– + H2O2 = AsO43– + H2O бесц. р-р |
6Ag+ + AsH3 +3H2O = AsO33– + 6Ag + 9H+ 3H3PO2 + 2AsO33– +6H+ = 2As + 3H3PO3 + 3H2O Ф.р |
||
|
IV
|
As(V) |
– |
1. AsO43– + 4Zn0 + 11H+ = AsH3 + 4Zn2+ + 4H2O 2. AsH3 + HgCl2 = AsH2(HgCl) + H+ +Cl– AsH3 + 2HgCl2 = AsH(HgCl)2 + 2H+ +2Cl– AsH3 + 3HgCl2 = As(HgCl)3 + 3H+ +3Cl– Продукты от желтого до бурого цвета 3. AsH3 + As(HgCl)3 = As2Hg3 + 3H+ +3Cl– Реакция высоко чувствительная |
||
|
IV |
Cr3+ |
Cr3+ + 3OH− = Cr(OH)3 Cr(OH)3 + 3OH− изб = [Cr(OH)6]3− 2[Cr(OH)6]3− + 3H2O2 = 2CrO42− + 8H2O + 2OH− |
1. [Cr(OH)6]3− + 3H2O = H3[Cr(OH)6] + 3OH− При кипячении гидролизуется 2. Cr2O72– + 4H2O2 + 2H+ = 2H2CrO6 + 3H2O 3. 3Na2B4O7 + 2Cr(OH)3 = 2Cr(BO2)3 + 6NaBO2 + 3H2O перлы изумрудно-зел. |
||
|
IV |
Zn2+ |
Zn2+ + 2OH− = Zn(OH)2 белый осадок, Zn(OH)2 + 2OH− изб = [Zn(OH)4]2− бесцвет. |
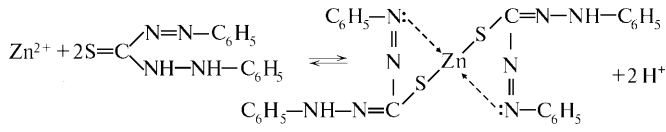
1. [Zn(OH)4]2− + 2NH4+ = Zn(OH)2 + 2NH3*H2O Zn(OH)2 + 4NH3*H2O = [Zn(NH3)4]2+ + 4H2O + 2OH− 2. 3Zn2+ + 2K+ + 2[Fe(CN)6] 4- = K2Zn[Fe(CN)6] 2 Белый ос, раств в HCl для обнаруж Zn2+ в присутв ионов алюминия, кот. С этим р-ром образ осадок 3. Действие дитизона
Соль ярко- красного цвета |
||
|
V |
Mg2+ |
NH3*Н2О |
1. Mg2+ + 2NH3*Н2О = Mg(OH)2 + 2NH4+ белый 2. Mg2+ + НРО42– + NH3*H2O = MgNH4PO4 + Н2О Белый кристаллический осадок |
1. Mg2+ + 2ОН– = Mg(OH)2 белый осадок 2. Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3*Н2О Гидроксиды магния, марганца ll и Fe2+ раствор в насыщ. р-ре HCl Р-ция отделения катионов Mg2+ от других катионов V гр |
|
|
V |
Sb (lll) |
подвергаются гидролизу |
1. [SbCl6]3−+ 3NH3*Н2О = Sb(OH)3 + 6Cl– + 3NH4+ 2. [SbCl6]3– + H2O = SbOCl¯ + 5Cl– + 2H+ Раствор. в к-тах, белый осад. основных солей |
1. [SbCl6]3−+ 3OH– = Sb(OH)3 + 6Cl– белый осад, все гидр. V гр. раств в к-тах 2. Sb(OH)3 + 3OH– изб = [SbCl6]3− [Sb(OH)5] + OH– = [SbCl6]− |
|
|
V |
Sb (V) |
1. [SbCl6]−+ 5NH3*Н2О = HSbO3 + 6Cl– + 5NH4+ +2H2O 2. [SbCl6]– + 2H2O = SbO7Cl + 5Cl– + 4H+ Раствор. в к-тах, белый осад. основных солей |
1. [SbCl6]−+ 5OH– = Sb(OH)5 + 6Cl– Белый амф осадок 2. Sb(OH)5 = HSbO3 + 2Н2О белый осадок |
||
|
V |
Bi3+ |
1. Bi3+ +2NH3*H2O + Cl− = Bi(OH)2Cl + 2NH4+ Bi(OH)2Cl = BiOCl + H2O белый осадок 2. Bi3+ + H2O + NO3− = BiONO3 + 2H+ белый ос Раствор. в к-тах |
Bi3+ + 3OH− = Bi(OH)3 белый аморфн осадок 2Bi(OH)3 + 3[Sn(OH)6]4− = 2Bi+ 3[Sn(OH)6]2− +6OH− |
||
|
V |
Fe2+ |
Fe2++ 2NH3*Н2О = Fe(OH)2 + 2NH4+
|
1. Fe2+ + 2ОН– = Fe(OH)2 2. 3Fe2+ + 2[Fe(CN)6]3– = Fe3[Fe(CN6)]2 синий осадок «турнбулевой сини» Fe3[Fe(CN)6]2 + 6ОН– = 3Fe(OH)2 + 2[Fe(CN)6)]3– Осадок в к-тах не раств. , в щелочах разлагается |
||
|
V |
Fe3+ |
Fe3+ + 3NH3*Н2О = Fe(OH)3 + 3NH4+
|
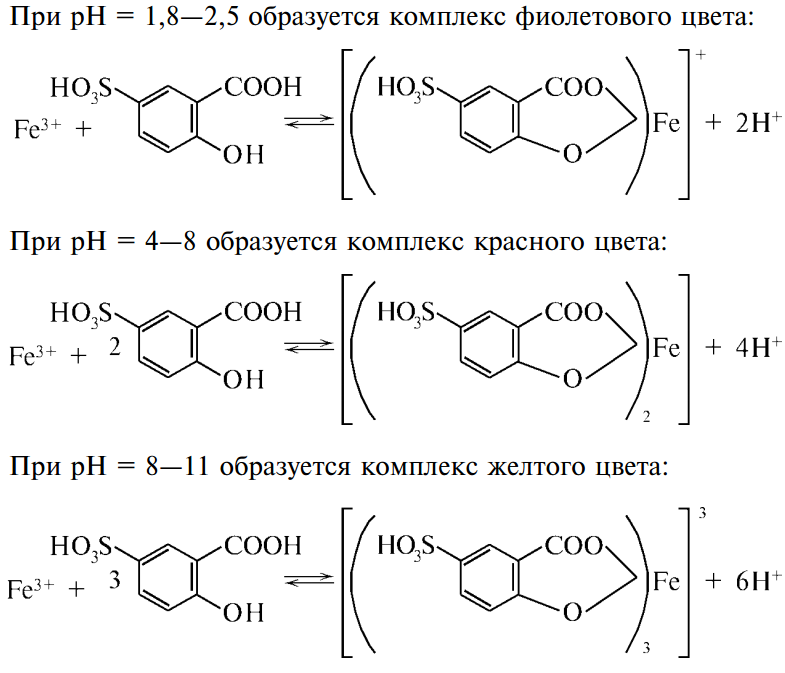
1. Fe3+ + 3ОН– = Fe(OH)3 красно-бурый ос Fe(OH)3 + 3Н+ = Fe3+ + 3Н2О 2. 4Fe3+ + 3[Fe(CN)6]4– = Fe4[Fe(CN)6]3 темно-синий ос. «берлинской лазури» pH=3 Fe4[Fe(CN)6]3 + 12OH– = 4Fe(OH)3 + 3[Fe(CN)6]4– в щелочах- разлаг 3. Fe3+ + 3NCS– [Fe(NCS)3] 4. при pH= 1,8-2,5 + при pH= 4-8 – при pH= 8-11 3–
|
||
|
V |
Mn2+ |
|
Mn2+ + 2NH3*Н2О = Mn(OH)2 + 2NH4+ |
Mn2+ + 2ОН– = Mn(OH)2 белый аморфн осадок |
|
|
|
Катионы группа |
Груп. реагент |
Р-ция, эффект, избыток группового реагента |
Специфические реакции |
|
VI |
Cu2+ |
NH3*H2O или NH3OH |
1. 2Cu2+ + 2NH3*H2O + SО42– = (CuОH)2SО4 + 2NH4+ (CuOH)2SO4 + 8NH3*H2O = 2[Cu(NH3)4]2+ + SO42– + 2OН– + 8H2О Синий р-р [Cu(NH3)4]2+ +4Н+ = Cu2+ +4NH4+ При действии к-т аммиачные комплексы VI гр разрушаются 2. Cu(OH)2 + 2OH– изб= [Cu(OH)4]2– + 2H2O Частично раств |
1. 2Cu2+ + 2OH– = Cu(OH)2 голубой цв 2. S2O32– + H2O = H2S + SO42– 2Cu2+ + H2S + = Cu2S + S + 4Н+ 2Cu2+ + 2S2O32– + 2H2O = Cu2S + S + 2SO42– + 4Н+ S раств в HNO2 3Сu2S + 4NO3– + 16H+ = 6Cu2+ + 3S+ 4NO + 8H2O Р-р при нагрев с этой реакц отделяют Сu2S от HgS |
|
VI |
Hg2+ |
1. Hg2+ + 2NH3*H2О + Cl– = [NH2Нg]Cl + NH4+ + 2H2О 2. [NH2Hg]Cl + 3NH3*H2O = [Hg(NH)3)]2+ + Cl– + OH– + 2H2O Бесцветный р-р
|
1. Hg2+ + 2OH– = Hg(OH)2 Белого цв Hg(OH)2 = HgO + Н2О 2. Hg2+ + S2O32– + Н2O = HgS + SO42– + 2H+ HgS + Br2 + 2Cl– = [HgCl2] + 2Br– + S 3. Hg2+ + 2І– = HgІ2 оранж-красного цв HgІ2 + 2І– = [HgІ4]2– К = 1,5*10–39 |
|
|
VI |
Co2+ |
Co2+ + NH3*H2O + Сl – = Со(ОH)Cl + NH4+ Со(ОН)Cl + 6NH3*H2O доб.изб = [Co(NH3)6]2+ + Cl– + ОН– + 6H2O Оранжево-коричневый р-р |
1. Cо2+ + Cl– + OH– = Co(OH)Cl Co(OH)Cl + OH– изб= Co(OH)2 + Cl– 2. 2NH4+ + Со2+ + 4NCS– = (NH4)2[Cо(NCS)4] синяя окр |
|
|
VI |
Ni2+ |
2Ni2+ + 2NH3*H2О + SO42– = (NiOH)2SO4 + 2NH4+ (NiOH)2SO4 + 12NH3*H2O = 2[Ni(NH3)6]2+ + SO42– + 2OН – + 12H2О
|
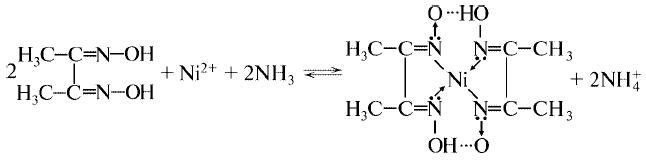
1. Ni2+ + 2OH– = Ni(OH)2 Ni(OH)2 + 2H+ = Ni2+ + 2H2O Все гидрокс. VI гр раств в к-тах 2. действие реактива Чугаева (Диметилглиоксима): Силективная р-я для опред катионов Ni2+
красный осадок соли
|