Реакции катионов группы
.doc
|
Действие некоторых реагентов на катионы I аналитической группы |
||||
|
|
К+ |
Na+ |
Lі+ |
NН4+ |
|
КОН, NaOН |
|
|
|
NН4+ + OH– = NН4OH = H2O + NН3 Запах; окрашивание влажной лакмусовой бумаги |
|
К2СО3, Nа2СО3 |
|
|
белый кристалл. осадок Lі2СО3 растворяется в кислотах |
Выделяется NН3 (при нагревании) |
|
NaНС4Н4О6 Натрий гидротартрат
|
К+ + NaHС4Н4О6 = КНС4Н4О6 + Na+ белый кристаллич. осадок, раств. в кислотах и щелочах |
|
|
NН4+ + HC4H4O6– = NН4НС4Н4О6 белый кристалл. осадок, растворяется в кислотах и щелочах |
|
Nаз[Со(NO2)6] натрий гексанитрокобальтат (III) |
2К+ + Na+ + [Со(NO2)6]3– =К2Na[Со(NO2)6] Желтый кристаллич. осадок, раств. в минеральных к-тах |
|
Желтый кристалл. осадок Li3[Со(NО2)6] раств. в минеральных кислотах |
2 NН4+ + Na+ + [Со(NO2)6]3– = (NН4)2Na[Со(NO2)6] Желтый кристаллич. осадок, растворяется в минеральных к-тах |
|
Nа2РЬ[Сu(NО2)6 динатрийплюмбум (II) гексанитрокупрат (II) |
2К+ + РЬ2+ + [Сu(NО2)6]4– = К2РЬ[Сu(NO2)6] Черный кристаллич. осадок |
|
|
2NН4+ + РЬ2+ + [Сu(NО2)6]4– = (NН4)2РЬ[Сu(NО2)6] Черный кристаллич. осадок |
|
К[SЬ(ОН)6] Калий гексагидроксостибат(V) |
|
Na+ + [SЬ(ОН)6] – = Na[SЬ(ОН)6] белый кристалл. осадок |
белый кристалл. осадок (из конц р-ров) Li[SЬ(ОН)6] |
Белый аморфный осадок НSЬО3 |
|
Zn(UO2)3(СН3СОО)8 цинктриуранилуоктаацетат
|
|
Na+ + Zn2 + + ЗUO22+ + 8СН3СОО– + 9Н2О + СН3СООН = NаZn(UO2)3(СН3СОО)9 *9Н2О + H+ Желтый кристаллич. ос. |
Зеленый кристалл. осадок LiZn(UO2)3(СН3СОО)9 |
|
|
К2[НgІ4] + КОН реактив Несслера |
|
|
|
NН4+ + 2[НgІ4]2– + 4OH– = [Hg2NН2O]I + 7I– + H2O красно-бурый или желто-бурый ос. |
|
Окрашивание
пламени |
фиолетовый цвет |
желтый цвет |
|
|
|
Действие некоторых реагентов на катионы II аналитической группы |
|||
|
|
Ag+ |
Нg22+ |
Pb2+ |
|
НCl |
Аg+ + Cl– = AgCl белый раств. в воде |
Нg22+ + 2Cl– = Hg2Cl2 белый |
Pb2+ + 2Cl– = PbCl2белый растворяется в горячей воде |
|
Nа2S |
Аg+ + ОН– = АgOН белый 2АgOН = Аg2О + Н2О бурый раств. в HNO3 |
Нg22+ + S2– = НgS + Hg Черный раств. в царской водке |
Pb2+ + S2– = РbS Черный раств. в HNO3 |
|
NaОН или КОН |
Аg+ + ОН– = АgOН бурый раств. в аммиаке и HNO3 |
Нg22+ + 2ОН– = Нg2O+ Н2О Черный раств. в HNO3 |
Pb2+ + 2ОН– = РЬ(ОН)2 белый РЬ(ОН)2 + ОН- = РЬ(ОН)3–, раств. в щелочах и HNO3 |
|
КI |
Аg+ + 2I– = AgI2 Желтый не раств. в аммиаке |
Нg22+ + 2I– = Нg2I2 зеленый раств. в избытке реагента |
Pb2+ + 2I– = PbI2 Золотисто-желтый раств. в горячей воде и избытке реагента |
|
NН3*Н2О |
Аg+ + NН3*Н2О = АgOН + NН4+ белый 2АgOН = Ag2O + H2O бурый Ag2O + 4NН3*Н2О = 2[Ag(NН3)2]+ +3Н2О + 2OH– раств. в кислой среде [Ag(NН3)2]+ +2Н+ = Аg+ + 2NН4+ |
2Нg22+ + NO3– + 4NН3*Н2О = [Hg2NН2O]NO3 + 3NН4+ + 3H2O + 2Hg черный осадок |
Pb2+ + 2NН3*Н2О = РЬ(ОН)2 + 2NН4+ Белый осадок, не раствор. в избытке реагента |
|
Действие некоторых реагентов на катионы III аналитической группы |
|||
|
|
Ва2+ |
Sr2+ |
Ca2+ |
|
H2SO4 |
Ba2+ + SO42– = BaSO4 белый |
Sr2+ + SO42– = SrSO4 белый |
Ca2+ + SO42– = CaSO4 белый |
|
не растворяется в кислотах и щелочах |
Частично раств. в воде. Растворяется в конц. р-ре (NH4)2SO4 CaSO4 + SO42– = [Ca(SO4)2] 2– |
||
|
Насыщ.р-р CaSO4 (гипсовая вода) |
Ba2+ + SO42– = BaSO4 белый образуется быстро |
Sr2+ + SO42– = SrSO4 белый образуется постепенно при нагревании |
_____ |
|
Na2CO3, K2CO3, (NH4)2CO3 |
Ba2+ + CO32– = ВаСО3 белый |
Sr2+ + CO32– = SrCO3 белый |
Ca2+ + CO32– = СаСО3 белый |
|
растворяется в сильных кислотах: ВаСО3 + 2H+ = Ва2+ + Н2О + CO2 растворяется в уксусной кислоте: ВаСО3 + CH3COOH = Ва2+ + Н2О + CO2 + 2CH3COO– |
|||
|
K2CrO4 |
Ba2+ + CrO42– = BaCrO4 желтый |
Sr2+ + CrO42– = SrCrO4 желтый |
________ |
|
растворяется в сильных кислотах 2BaCrO4+ 2H+ = 2Ва2+ + Cr2O72– + Н2О не растворяется в уксусной кислоте |
раств. в сильных кислотах SrCrO4+ CH3COOH = Sr2+ + HCrO4– + CH3COO– раств. в уксусной кислоте |
_____ |
|
|
(NH4)2C2O4 |
Ba2+ + C2O42– = BaC2O4 белый |
Sr2+ + C2O42– = SrC2O4 белый |
Ca2+ + C2O42– = CaC2O4 белый |
|
растворяется в сильных кислотах: BaC2O4+ 2H+ = Ва2+ + Н2C2O4 не растворяется в уксусной кислоте |
|||
|
Окрашивание
пламени
|
Желто-зеленый |
Карминово-красный |
Кирпично-красный |
|
Действие некоторых реагентов на катионы IV аналитической группы |
|||
|
|
As(III) AsO33– |
As(V) AsO43– |
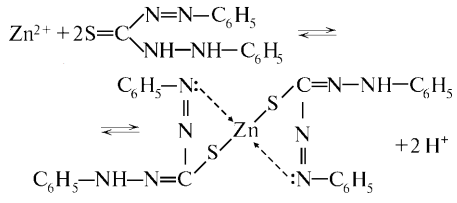
Zn2+ |
|
KOH или NaOH |
- |
- |
Zn2+ + 2OH− = Zn(OH)2 белый осадок, Zn(OH)2 + 2OH− = [Zn(OH)4]2ˉ растворяется в избытке реагента |
|
Восстановление |
6Ag+ + AsH3 + 3H2O = AsO33– + 6Ag + 9H+ AsO33– + H2O2 = AsO43– + H2O
H2PO2– + H+ = H3PO2 3H3PO2 + 2AsO33– +6H+ = 2As + 3H3PO3 + 3H2O Черный ос. и окраска р-ра в коричневый цвет |
AsO43– + 4Zn0 + 11H+ = AsH3 + 4Zn2+ + 4H2O Почернение фильтрованной бумаги AsH3 + HgCl2 = AsH2(HgCl) + H+ +Cl– AsH3 + 2HgCl2 = AsH(HgCl)2 + 2H+ +2Cl– AsH3 + 3HgCl2 = As(HgCl)3 + 3H+ +3Cl– AsH3 + As(HgCl)3 = As2Hg3 + 3H+ +3Cl– Продукты от желтого до бурого цвета |
[Zn(OH)4]2ˉ + 2H+ = Zn(OH)2 + 2H2O Zn(OH)2 +2H+ = Zn2+ + 2H2O бесцветный раствор |
|
H2O2 |
AsO33– + H2O2 = AsO43– + H2O AsO33– бесцветный раствор |
AsO43– бесцветный раствор |
|
|
Конц. р-р NH4Cl |
- |
- |
[Zn(OH)4]2ˉ + 4NH4+ = Zn(OH)2 + 2NH3*H2O Zn(OH)2 + 4NH3*H2O = [Zn(NH3)4]2+ + 4H2O + 2OH ˉ |
|
K4[Fe(CN)6] |
- |
- |
3Zn2+ + 2K+ + 2[Fe(CN)6] 4- = K2Zn[Fe(CN)6] 2 Белый осадок |
|
Дитизон в CCl4 или в CHCl3 |
- |
- |
Цинк дитизонат. Раствор ярко- красного цвета |
|
Действие некоторых реагентов на катионы IV аналитической группы |
|||
|
|
Cr3+ |
Sn2+ |
Al3+ |
|
KOH или NaOH |
Cr3+ + 3OH− = Cr(OH)3 зеленый осадок, Cr(OH)3 + 3OH− = [Cr(OH)6]3− растворяется в избытке реагента |
Sn2+ + 2OH− = Sn(OH)2 белый осадок, Sn(OH)4 + 2OH− = [Sn(OH)6]2ˉ Sn(OH)2 + 4OH− = [Sn(OH)6]4ˉ [SnCl6]2− + 4OH− = Sn(OH)4 + 6Cl– растворяется в избытке реагента |
Al3+ + 3OH− = Al(OH)3 белый осадок, Al(OH)3 + 3OH− = [Al(OH)6]3− растворяется в избытке реагента |
|
H2O2 в щелочной среде |
- |
[Sn(OH)6]2ˉ + 2H+ = Sn(OH)4 + 2H2O [Sn(OH)6]4ˉ + 4H+ = Sn(OH)2 + 4H2O Sn(OH)4 + 2H+ = Sn2+ + 2H2O Sn(OH)2 + 4H+ + 6Cl– = [Sn(OH)6]2ˉ + 4H2O бесцветный раствор |
[Al(OH)6]3− + 3H+ = Al(OH)3 + 3H2O Al(OH)3 +3H+ = Al3+ + 3H2O бесцветный раствор |
|
H2O2 в кислой среде |
Cr2O72– + 4H2O2 + 2H+ = 2H2CrO6 + 3H2O надхромовая кислота синего цвета |
|
- |
|
H2O2 |
2[Cr(OH)6]3− + 3H2O2 = 2CrO42− + 8H2O + 2OH− желтый раствор |
[Sn(OH)6]4ˉ + H2O2 = [Sn(OH)6]2ˉ + 2OH−
|
- |
|
Конц. р-р NH4Cl |
[Cr(OH)6]3− + 3NH4+ = Cr(OH)3 + 3NH3*H2O |
[Sn(OH)6]2ˉ + 4NH4+ = Sn(OH)2 + 4NH3*H2O |
[Al(OH)6]3− + 3NH4+ = Al(OH)3 + 3NH3*H2O |
|
Нагревание гидроксоанионов |
[Cr(OH)6]3− + 3H2O = H3[Cr(OH)6] + 3OH− H3[Cr(OH)6] = Cr(OH)3 + 3H2O |
[Sn(OH)6]4ˉ + 3H2O = H4[Sn(OH)6] + 4OH− H4[Sn(OH)6] = Sn(OH)2 + 4H2O |
|
|
Co(NO3)2
|
- |
- |
4Al(OH)3 + 2Co(NO3)2 = 2Co(AlO2)2 + 4NO2 + O2 + 6SO3 «тенарова синь» |
|
HgCl2 |
- |
2Hg2+ + Sn2+ + 8Cl– = Hg2Cl2 + [SnCl6]2– Sn2+ + 2Hg2Cl2 + 4Cl– = 2Hg + [SnCl6]2– Hg2Cl2 Hg из белого в черный осадок |
- |
|
CH3COONa Натрий ацетат |
- |
- |
Al3+ + CH3COO– = Al(OH)2CH3COO белый ос. растворяется в кислотах и щелочах |
|
Ализарин |
- |
- |
«Алюминиевый лак», осадок ярко-красного цвета |
|
Na2B4O7 *10H2O Натрия тетраборат |
3Na2B4O7 + 2Cr(OH)3 = 2Cr(BO2)3 + 6NaBO2 + 3H2O Окрашенные хрома метабората изумрудно-зеленый осадок |
- |
|
|
Действие некоторых реагентов на катионы V аналитической группы |
|||
|
|
Bi3+ |
[SbCl6]3− |
[SbCl6] − |
|
NaOH; KOH |
Bi3+ + 3OH− = Bi(OH)3 белый осадок |
[SbCl6]3−+ 3OH– = Sb(OH)3 + 6Cl– Sb(OH)3 белый осадок |
[SbCl6]−+ 5OH– = Sb(OH)5 + 6Cl– Sb(OH)5 = HSbO3 + 2Н2О HSbO3 белый осадок |
|
|
Осадки растворяются в HCl и щелочах |
Осадки растворяются в HCl и щелочах |
Осадки растворяются в HCl и щелочах |
|
NH3*H2O |
Bi3+ +2NH3*H2O + Cl− = Bi(OH)2Cl + 2NH4+ Bi(OH)2Cl = BiOCl + H2O белый осадок |
[SbCl6]3−+ 3NH3*Н2О = Sb(OH)3 + 6Cl– + 3NH4+ Sb(OH)3 белый осадок |
[SbCl6]−+ 5NH3*Н2О = HSbO3 + 6Cl– + 5NH4+ +2H2O HSbO3 белый осадок |
|
|
Осадки растворяются в HCl и щелочах |
Осадки растворяются в HCl и щелочах |
Осадки растворяются в HCl и щелочах |
|
Na2S |
2BiOCl + 3S− + H2O = Bi2S3 + Cl− + 4OH− Bi3+ + 3S− = Bi2S3 коричневый осадок |
2[SbCl6]3- + 3Na2S = Sb2S3¯ + 6Na+ + 12Cl− оранжево-красный осадок |
2[SbCl6]– + 5Na2S = Sb2S5¯ + 10Na+ + 12Cl− оранжево-красный осадок |
|
|
|
растворяется в изб. Na2S и щелочах Sb2S3¯ + 3S2¯ = 2SbS33¯ Sb2S3¯ + 6OH– = SbO33¯ + SbS33¯ + H2O |
растворяется в изб. Na2S и щелочах Sb2S5¯ + 3S2¯ = 2SbS43¯ 4Sb2S5¯ + 24OH– = 3SbO43¯ + 5SbS33¯ + 12H2O |
|
Na2HPO4 + NH4OH |
Bi3+ + HPO42−+ NH4OH = BiPO4+ 2 NH4+ + H2O BiPO4 белый осадок, не раст-ся в уксусной к-те и разб HNO3 |
|
|
|
Na2S2O3 Натрий тиосульфат |
|
SbCl3 + 2Na2S2O3 + 3H2O = Sb2ОS2¯ + 2Na2SO4 + 6HCl красный осадок Sb2ОS2 („сурьмяная киноварь”) |
|
|
NaOH+SnCl2 Натрий гексагидроксостанит (II) Na4[Sn(OH)6] |
Sn2+ + 2OH– = Sn(OH)2¯ Sn(OH)2 + 4OH– = [Sn(OH)6]4– Bi3+ + 3OH– = Bi(OH)3¯ белый осадок 2Bi(OH)3 + 3[Sn(OH)6]4ˉ = 2Bi+ 3[Sn(OH)6]2ˉ +6OH− черный осадок Bi |
|
|
|
(NH2)2CS тиомочевина |
Bi3+ + 3(NH2)2CS = [Bi{(NH2)2CS}3]3+ Комплексы желто-лимонного цвета |
|
|
|
KI |
Bi3+ + 3I– = BiІ3¯ черный осадок BiІ3¯ + I– = [BiІ4]– оранжевый раствор При разведении водой: [BiІ4]– = BiІ3¯ + I– черный осадок BiІ3 + H2O = BiOI¯ + 2H+ + 2I– оранжевый осадок |
|
|
|
гидролиз |
|
[SbCl6]3– + H2O = SbOCl¯ + 5Cl– + 2H+ белый аморфный осадок |
[SbCl6]– + 2H2O = SbО2Cl¯ + 5Cl– + 4H+ белый аморфный осадок |
|
|
|
растворяется в ррах HCl : SbOCl + 2НCl + Cl¯ = [SbCl4]– + H2O SbOCl + Н2С4Н4О6 = [SbО(С4Н4О6)]– + 2Н+ + Cl¯ или SbOCl + Н2С4Н4О6 = [SbОН(С4Н4О6)] + Н+ + Cl¯ |
SbО2Cl растворяется в изб.HCl
|
|
Zn (+никелевая пластинка) |
|
2[SbCl6]3− +3Zn = 2 Sb + 3Zn2+ + 12Cl− Не раств. HCl, но разб в HNO3 3 Sb + 5NO3− + 5H+ = 3HSbO3 + 5NO + H2O |
|
|
Действие некоторых реагентов на катионы V аналитической группы |
||||
|
|
Fe2+ |
Fe3+ |
Mg2+ |
Mn2+ |
|
NaOH; KOH |
Fe2+ + 2ОН– = Fe(OH)2 зеленый осадок |
Fe3+ + 3ОН– = Fe(OH)3 красно-бурый осадок |
Mg2+ + 2ОН– = Mg(OH)2 белый осадок |
Mn2+ + 2ОН– = Mn(OH)2 = MnO2*nH2O белый осадок, становится бурым на воздухе вследст образ MnO2*nH2O |
|
Осадки раств-ся в кислотах и в растворе NH4Cl (кроме Fe(OH)3) |
Fe(OH)2 + 2Н+ = Fe2+ + 2Н2О Fe(OH)2 + 2NH4+ = Fe2+ + 2NH3*Н2О |
Fe(OH)3 + 3Н+ = Fe3+ + 3Н2О - |
Mg(OH)2 + 2Н+ = Mg2+ + 2Н2О Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3*Н2О |
Mn(OH)2 + 2Н+ = Mn2+ + 2Н2О Mn(OH)2 + 2NH4+ = Mn2+ + 2NH3*Н2О |
|
NH3*H2O |
Fe2++ 2NH3*Н2О = Fe(OH)2 + 2NH4+ зеленый осадок |
Fe3+ + 3NH3*Н2О = Fe(OH)3 + 3NH4+ красно-бурый осадок |
Mg2+ + 2NH3*Н2О = Mg(OH)2 + 2NH4+ белый осадок |
Mn2+ + 2NH3*Н2О = Mn(OH)2 + 2NH4+ белый осадок, становится бурым на воздухе вследст образ-ния MnO2*nH2O |
|
Na2HPO4 + NH4OH |
3Fe2+ + 2HPO42–+ 2NH3 = Fe3(PO4)2 + 2NH4+ |
Fe3+ + HPO42–+ NH3 = FePO4 + NH4+ |
Mg2+ + НРО42– + NH3*H2O = MgNH4PO4 + Н2О Белый кристаллический осадок Осадок растворяется в сильных кислотах и ацетатной кислоте: MgNH4PO4+ 3H+ = Mg2+ + NH4+ + H3PO4 2MgNH4PO4+ 4CH3COOH = Mg(H2PO4)2 + 2CH3COONH4+ Mg(CH3COO)2 2MgNH4PO4+ 4CH3COOH = 2Mg2+ + 2H2PO42– + 4CH3COO– + 2NH4+ |
2HPO42– + 2NH4OH + 3Mn2+ = Mn3(PO4)2 + 2NH4+ + 2H2O |
|
Белые осадки, растворяются в минеральных кислотах, не растворяются в уксусной кислоте |
||||
|
[Fe(CN)6]3– калий гексацианоферрат (III) |
3Fe2+ + 2[Fe(CN)6]3– = Fe3[Fe(CN6)]2 синий осадок «турнбулевой сини» Осадок нерастворим в кислотах, но в щелочах он разлагается: Fe3[Fe(CN)6]2 + 6ОН– = 3Fe(OH)2 + 2[Fe(CN)6)]3– |
4Fe3+ + 3[Fe(CN)6]4– = Fe4[Fe(CN)6]3 темно-синий ос. «берлинской лазури» Осадок не раств. в разб. минеральных кислотах; разлагаются в щелочах Fe4[Fe(CN)6]3 + 12OH– = 4Fe(OH)3 + 3[Fe(CN)6]4–
|
|
|
|
KSCN или NH4SCN Тиоцианат-ионы |
|
Fe3+ + 3NCS– [Fe(NCS)3] красный р-р |
|
|
|
(NH4)2S |
Fe2+ + S2– = FeS черный |
2Fe3+ + 2S2– = Fe2S3 черный |
|
Mn2+ + S2– = MnS |
|
Действие раствора тиогликолевой кислоты (HSCH2COOH) |
Катионы Fe2+ окисляются кислородом воздуха до Fe3+ и также образуют окрашенные комплексные анионы |
Fe3+ + 2HSCH2COOH + 5NH3*H2O [FeOH(SCH2COO)2]2– + 5NH4+ + 4H2O Комплексные анионы красного цвета (розовый р-р) |
|
|
|
Спец. реакции |
Реакция с диацетилдиоксимом
железа (II) диацетилдиоксимат |
|
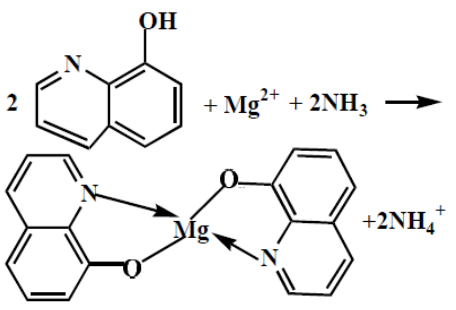
Реакция с 8-Оксихинолином
желто-зеленый осадок магний оксихинолината |
Реакции с окислителями:
Мn(ОН)2: Мn(ОН)2 + H2O2 = Н2МnO3 + H2O темно-бурый осадок (МnО2*nН2O):
Н2МnO3: Н2МnO3 + H2O2 + 2H+ = Мn2+ + O2 + 3H2O
Бромная или хлорная вода Mn2+ + Br2 + 4OH– = MnО(OH)2¯ + 2Br– + H2O осадок черного цвета
(NH4)2S2O8: 2Мn2+ + 5S2O82– + 8H2O =2МnО4– + 16H+ + 10SO42– Р-р окраш. в малиново-фиолетовый (красн) цв.
NaBiО3: 2Mn2+ + 5BiО3– + 14H+ = 2MnО4– + 5Bi3+ + 7H2O Р-р окраш. в малиново-фиолетовый цвет
РbО2: 2MnSO4 + 5РbО2+ 6НNО3 = 2НМnO4 + 2PbSO4 + 3Рb(NО3)2+ 2Н2O смесь окрашивается в малиновый цвет
[Ag(NH3)2] –: MnSO4+ 2[Ag(NH3)2]Cl + 2H2O = MnO2 + 2Ag + 2NH4Cl + (NH4)4SO4 Черный осадок МnО2 и Ag
NaBrO: 5NaBrO + 2MnSO4 + 6NaOH = 2NaMnO4 + 2Na2SO4 + 5NaBr + 3H2O |
|
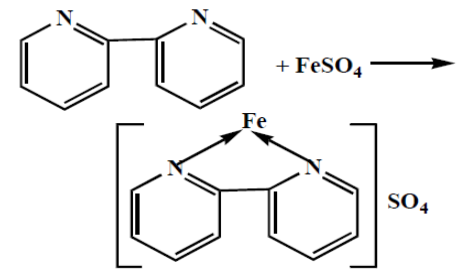
Реакция с 2,2-дипиридилом (о-фенантролин) в кислой среде
комплексное соединение темно-красного цвета |
|
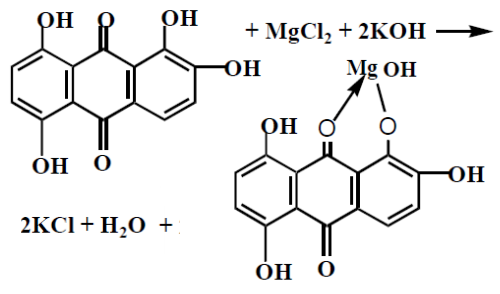
В кислой среде с Хинализарином
осадок хинализарината магния василькового цвета |
||
|
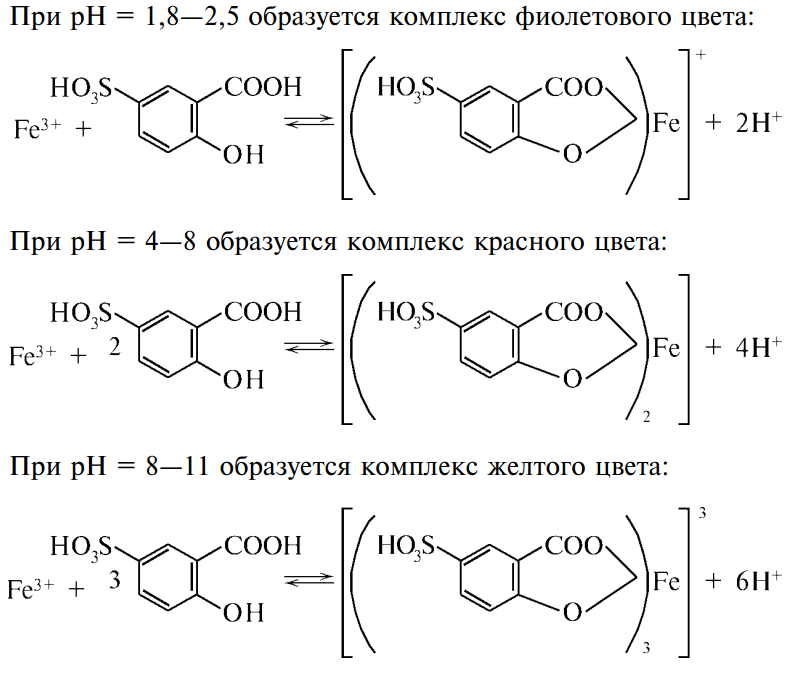
Железо (III), а также железо(II) -катионы образуют с сульфосалициловой кислотой комплексы различного цвета в зависимости от рН раствора.
|
|
|||


 карминно-красный
комплекс
карминно-красный
комплекс