
- •2.Стехиометрические законы химии
- •3.Скорость химических реакций
- •4.Зависимость скорости от температуры. Понятие об энергии активации. Катализ.
- •5.Химическое равновесие
- •6.Тепловые эффекты химических реакций. Энтальпия. Закон Гесса.
- •7.Энтропия. Свободная энергия Гиббса. Термодинамический критерий направленности химического процесса.
- •11.Растворение как физико-химический процесс. Химическая теория растворов Менделеева.
- •9.Концентрация растворов. Растворимость, насыщенные и ненасыщенные растворы.
- •10.Идеальные растворы
- •11.Электролиты и неэлектролиты. Электролитическая диссоциация
- •12.Степень электролитической диссоциации
- •13.Ионное произведение воды
- •14.Кислотно-основные свойства веществ.Кислоты, основания и соли с точки зрения теории элд
- •15.Обменные реакции между ионами
- •16.Гидролиз солей
- •17.Электронная теория окисления-восстановления
- •18.Электродные потенциалы.Гальванический элемент
- •19.Электролиз расплавов и растворов
- •20.Электронное строение атома,эектронные формулы и квантовые ячейки.
- •21.Квантовые числа. Принцип Паули, принцип наименьшей энернии, правило Гунда
- •22.Ковалентная связь
- •23.Понятие о гибридизации связей. Кратные связи. Поляризация ковалентной связи. Электроотрицательность
- •24.Метод молекулярных орбиталей
- •25.Ионная связь как одна из составляющих реальной химической связи
- •26.Межмолекулярное взаимодействие
1.Атомно-молекулярная теория Ломоносова.
Лишь в середине ХVIII века великий русский учёный М.В. Ломоносовобосновал атомно-молекулярные представления в химии. Основные положения его учения изложены в работе «Элементы математической химии» (1741 г.) и ряде других. Ломоносов назвал теориюкорпускулярно-кинетической теорией.
М.В. Ломоносов четко разграничивал две ступени в строении вещества: элементы (в современном понимании – атомы) и корпускулы (молекулы). В основе его корпускулярно-кинетической теории (современного атомно-молекулярного учения) лежит принцип прерывности строения (дискретности) вещества: любое вещество состоит из отдельных частиц.
Молекула является наименьшей частицей вещества, обладающей всеми его химическими свойствами.Вещества, имеющиемолекулярную структуру,состоят из молекул (большинство неметаллов, органические вещества).Значительная часть неорганических веществ состоит из атомов (атомная решётка кристалла) или ионов (ионная структура). К таким веществам относятся оксиды, сульфиды, различные соли, алмаз, металлы, графит и др. Носителем химических свойств в этих веществах является комбинация элементарных частиц (ионы или атомы), то есть кристалл представляет собой гигантскую молекулу.
Молекулы состоят из атомов. Атом – мельчайшая, далее химически неделимая составная часть молекулы.
Получается, молекулярная теория объясняет физические явления, которые происходят с веществами. Учение об атомах приходит на помощь молекулярной теории при объяснении химических явлений. Обе эти теории – молекулярная и атомная – объединяются в атомно-молекулярное учение. Сущность этого учения можно сформулировать в виде нескольких законов и положений:
вещества состоят из атомов;
при взаимодействии атомов образуются простые и сложные молекулы;
при физических явлениях молекулы сохраняются, их состав не изменяется; при химических – разрушаются, их состав изменяется;
молекулы веществ состоят из атомов; при химических реакциях атомы в отличие от молекул сохраняются;
атомы одного элемента сходны друг с другом, но отличаются от атомов любого другого элемента;
химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества.
Благодаря своей атомно-молекулярной теории М.В. Ломоносов по праву считается родоначальником научной химии.
Относительная шкала атомных и молекулярных масс.Моль.
атомная (элементная) масса – среднее значение массы атома химического элемента, выраженное в атомных единицах массы. Молекулярная масса – масса молекулы, выраженная в атомных единицах массы; она равна сумме масс всех атомов, из которых состоит молекул(молекулярная масса в действительности представляет собой среднюю массу молекулы с учетом изотопного состава элементов, образующих данное соединение).
Закон постоянства состава.Состав молекулярного соединения остается постоянным независимо от способа его получения. В отсутствие молекулярной структуры его состав зависит от условий получения и предыдущей обработки. Возьмем, к примеру, аммиак (NH3). Независимо от способов получения (прямой синтез из простых веществ, разложение аммонийных солей, действие кислот на нитриды активных металлов и т.п.), состав молекулы аммиака всегда постоянен и неизменен: на атом азота приходится три атома водорода. А для оксида титана (+2) состав соединения зависит от условий получения и предыдущей обработки. В молекуле аммиака, состоящей лишь из четырех атомов, исключается изменчивость состава.
Оксид же титана (+2) представляет собой фазу, состоящую из огромного числа атомов (порядка постоянной Авогадро), которая и определяет свойства этого соединения. Это ярчайший пример перехода количества в качество: коллектив из колоссального числа частиц обладает уже новым качеством – непостоянством состава.
Закон эквивалентов. Вещества вступают в химические реакции в строго определенных массовых соотношениях, пропорциональных их эквивалентам.
Эквивалентом называется реальная или условная частица вещества, которая в кислотно-основных реакциях эквивалентна одному иону водорода, а в окислительно-восстановительных реакциях – одному электрону.
В химии обычно пользуются понятием эквивалентная масса (mэ), т.е. массой 1 эквивалента вещества. Размерность эквивалентной массы – г/моль. Эквивалентная масса элемента определяется как отношение атомной массы к его валентности:
![]() .
.
Так, эквивалентная масса серы в SO2и в SO3определяется как 32/4 и 32/6 г/моль.
Эквивалентная масса кислоты равна отношению молярной массы кислоты к числу атомов водорода в ней, которые она способна отдавать в раствор при диссоциации:
![]() =
98/2 = 49 г/моль;
=
98/2 = 49 г/моль;![]() =
36,5/1 = 36,5 г/моль.
=
36,5/1 = 36,5 г/моль.
![]() г/моль
(СН3СООН ↔СН3СОО-+
Н+).
г/моль
(СН3СООН ↔СН3СОО-+
Н+).
Эквивалентная масса гидроксида равна отношению молярной массы к числу гидроксильных групп:
![]() =
40/1 = 40 г/моль ;
=
40/1 = 40 г/моль ;![]() =
74 г/моль.
=
74 г/моль.
Эквивалентная масса оксида и соли определяется как отношение молярной массы соединения к произведению числа атомов элемента на его валентность:
![]() =
44/1×4 = 11 г/моль;
=
44/1×4 = 11 г/моль;![]() =
342/2×3 = 57 г/моль.
=
342/2×3 = 57 г/моль.
![]() =
197,82/2×3 = 32,97 г/моль.
=
197,82/2×3 = 32,97 г/моль.
Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, може т иметь различные значения и зависят от того, в какую реакцию вступает это вещества. Так, в реакции Са(ОН)2+HCl =СаOHCl+H2O участвует только один атом водорода, поэтому
![]() =
74/1 = 74 г/моль,
=
74/1 = 74 г/моль,
а в реакции 2NaOH + H3PO4=Na2HPO4+ 2H2O;
![]() =
98/2 = 49 г/моль, так как в ней участвует
только 2 катиона водорода из трех.
=
98/2 = 49 г/моль, так как в ней участвует
только 2 катиона водорода из трех.
Математические выражения закона эквивалентов записываются следующим образом:
![]() или
или![]() ,
,
где m1и m2– масса 1-го и 2-го вещества;
![]() –
эквивалентная масса 1-го и 2-го вещества;
–
эквивалентная масса 1-го и 2-го вещества;
V2и Vэ(2)– объем и эквивалентный объем 2-го вещества.
Второе выражение применяется, когда одно из реагирующих веществ находится в газообразном состоянии. При этом эквивалентный объем для водорода равен 11,2 дм3/моль, а для кислорода – 5,6 дм3/моль, исходя из молярного объема газа 22,4 дм3при нормальных условиях.
Молярная масса и молярный объём.
Молярная масса – масса моля вещества. Она рассчитывается через массу и количество вещества по формуле: Мв = К· Мr (1) где: К – коэффициент пропорциональности, равный 1г/моль. В самом деле, для изотопа углерода 126С Аr = 12, а молярная масса атомов (по определению понятия «моль») равна 12г/моль. Следовательно, численные значения двух масс совпадают, а значит, К = 1. Отсюда следует, чтомолярная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная(атомная)масса.Так, молярная масса атомарного водорода равна 1,008г/моль, молекулярного водорода – 2,016г/моль, молекулярного кислорода – 31,999г/моль. Согласно закону Авогадро одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует, что при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.Отношение объема, занимаемого веществом, к его к его количеству называется молярным объемом вещества. При нормальных условиях (101,325 кПа; 273 К) молярный объем любого газа равен 22,4 л/моль(точнее, Vn = 22,4 л/моль). Это утверждение справедливо для такого газа, когда другими видами взаимодействия его молекул между собой, кроме их упругого столкновения, можно пренебречь. Такие газы называют идеальными. Для неидеальных газов, называемых реальными, молярные объемы различны и несколько отличаются от точного значения. Однако в большинстве случаев различие сказывается лишь в четвертой и последующих значащих цифрах. Измерения объемов газа обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля – Мариотта и Гей – Люссака: pV / T = p0V0/ T0где: V – объем газа при давлении p и температуре T; V0– объем газа при нормальном давлении p0(101,325 кПа) и температуре T0(273,15 К). Молярные массы газов можно вычислить также, пользуясь уравнением состояния идеального газа – уравнением Клапейрона – Менделеева: pV = mB RT / MB, где: p – давление газа, Па; V – его объем, м3; mB - масса вещества, г; MB– его молярная масса, г/моль; Т – абсолютная температура, К; R – универсальная газовая постоянная, равная 8,314 Дж / (моль·К). Если объем и давление газа выражены в других единицах измерения, то значение газовой постоянной в уравнении Клапейрона – Менделеева примет другое значение. Оно может быть рассчитано по формуле, вытекающей из объединенного закона газового состояния для моля вещества при нормальных условиях для одного моля газа: R = (p0 · V0/ T0)
2.Стехиометрические законы химии
Закон сохранения массы
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки. Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым. Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.
Р.Бойль показал, что при обжигании металлов увеличивается вес их, и объяснял это увеличение веса соединением с металлами весомой части пламени, материи огня.
Закон постоянства состава
Всякое химически чистое соединение независимо от способа его получения имеет вполне определенный состав.
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н2О, СН4, С2Н5ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения. Наряду с веществами, имеющими постоянный состав, существуют вещества переменного состава. К ним относятся соединения, в которых чередование нераздельных структурных единиц (атомов, ионов) осуществляется с нарушением периодичности.
В связи с наличием соединений переменного состава современная формулировка закона постоянства состава содержит уточнения:
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
C + O2 = CO2
CO + 1/2O2 = CO2
Закон эквивалентов
Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам.
Еще до создания атомно–молекулярного учения было установлено, что простые и сложные вещества вступают в химические реакции в строго определенных массовых соотношениях. Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Закон кратных отношений
Кратных отношений закон закон Дальтона, один из основных законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие. К. о. з. открыт в 1803 Дж. Дальтоном и истолкован им с позиций атомизма.
3.Скорость химических реакций
Химическая
кинетика – это наука, которая исследует
скорость хим. реакций и факторы, влияющие
на нее.Скорость химической реакции
— это количество элементарных
актов взаимодействия в единицу времени.
Так как при взаимодействии изменяются
концентрации реагирующих веществ, то
скорость реакции обычно измеряют
изменением концентрации реагентов или
продуктов реакции в единицу времени. А
+ В = АВ.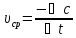 .
Чем меньше интервал времени△t,
тем ближе значение средней скорости
процесса к ее истинному значению в
момент времениt.Важно
знатьистиннуюскорость хим. реакции,
а к истинной скорости мы приближаемся
при
.
Чем меньше интервал времени△t,
тем ближе значение средней скорости
процесса к ее истинному значению в
момент времениt.Важно
знатьистиннуюскорость хим. реакции,
а к истинной скорости мы приближаемся
при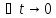 .И
.И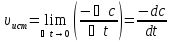 .
Выражение для истинной скорости может
быть записано в виде закона действующих
масс.H2+I2= 2HI. Истин.скорость хим.
реакции прямопропорциональна произведению
концентрации реагирующих веществ
.
Выражение для истинной скорости может
быть записано в виде закона действующих
масс.H2+I2= 2HI. Истин.скорость хим.
реакции прямопропорциональна произведению
концентрации реагирующих веществ .
.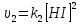 ,
где
,
где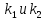 =constυ этих реакций.Физ.
смысл этих константсостоит в том,
что они равны скоростям реакций
=constυ этих реакций.Физ.
смысл этих константсостоит в том,
что они равны скоростям реакций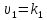 ,
,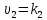 ,
когда концентрации реагирующих веществ
равны 1.Факторы:Т,с,Р,Sсоприк,природа.
,
когда концентрации реагирующих веществ
равны 1.Факторы:Т,с,Р,Sсоприк,природа.
Закон действующих масс. Константа скорости.
Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс. Этот закон установлен норвежскими учеными Гульдбергом и Вааге в 1867 г. Он формулируется следующим образом: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для химической реакции, протекающей по уравнению, записанному в общем виде
аА + bВ = сС + dD, (3)
математическое выражение закона действующих масс, называемое кинетическим уравнением химической реакции, имеет вид
V = k · CAa· CBb, (4)
где V – скорость химической реакции; CA, CB– молярные концентрации реагентов А и В; а и b – стехиометрические коэффициенты для реагентов А и В в уравнении реакции; k – коэффициент пропорциональности, называемый константой скорости химической реакции.
В случае гетерогенных реакций в математическое выражение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе.Вещества, находящиеся в конденсированном состоянии (твердом или жидком), реагируют лишь на поверхности раздела фаз, которая остается неизменной, поэтому концентрация веществ (поверхностная) постоянна и входит в константу скорости. Например, для реакции горения угля:
С(тв.)+ О2(г)= СО2(г)
закон действующих масс запишется так:
V = k'·Cc·CО2 = k·CО2,
где k = k'·Cc.
