
- •Билет 1.
- •Билет № 2
- •Химическое равновесие
- •Понятие об активном комплексе.
- •2.Серная кислота
- •Билет №3.
- •2. Современная химическая атомистика:
- •Билет 4.
- •1.Осмос и осмотическое давление. Закон Вант-Гоффа.
- •2. Сера. Её физические и химические свойства. Биологическая роль.
- •Билет 5.
- •Билет 8.
- •Хим. Свойства
- •Билет 12.
- •Химические свойства:
- •Билет 13
- •Билет 14
- •2. Координационная теория вернера Альфред Вернер ввёл в химию представления о соединениях высшего порядка и назвал их комплексными соединениями.
- •Билет 15.
- •1 Периодич.Закон д. И. Менделеева
- •2. Окислы азота
- •Билет 16.
- •Билет 19
- •1.Мышьяк. Его хим. И физ. Св-ва
Билет 1.
1.Теория Бора. Атом состоит из ядра и электронов , а ядро включает в себя протоны и нейтроны. Описание строения атома начнем с модели Резерфорда. Положение: -в центре атома находится положительно заряженное ядро, объем которого несравнимо меньше объема всего атома -вокруг ядра по круговым орбитам вращаются электроны , общее число которых равно положительному заряду ядра. -сила электростатического притяжения между ядром и электронами уравновешена центробежной силой вращения электронов.
Противоречия: -электрон, как и всякая другая заряженная частица , при вращении вокруг положительного заряда должна излучать энергию в виде электромагнитных волн. Это приводит к уменьшению радиуса вращения , что в конце приводит к не существованию атома. -непрерывное изменение энергии и частоты вращения должно соответствовать непрерывным оптическим спектрам излучения.
Теория о квантовании энергии электрона в атоме. (Бор) Для устойчивого состояния электрона его энергия в атоме должна быть квантована, т.е. может принимать определенное значение. Определенные основания для такого предложения -линейчатые спектры испускания атома водорода.
Момент количества движения электрона относительно ядра- векторное произведение импульса р=мv , т.е. M=mvr
Квантовый постулат Бора: mvr=nh/2π=nh(перечеркнутая) , где м-масса электрона , v-его скорость, r-радиус орбиты, n-любое целое число от 1 до ∞ , h/2π=h(перечеркнутая)-постоянная Планка в формуле кругового движения.
Бор
использовал уравнение центробежной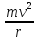 и центростремительной
и центростремительной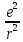 сил вращательных частиц.
сил вращательных частиц.
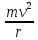 =
=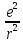
Энергия
электрона: En=
-
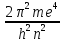
Если электрон находится в основном состоянии , то он имеет знак «-»-это значит , что электрон связан с ядром. Если электрон находится в положении выше 0 , т.е. знак «+» , то связь с ядром разрывается( т.е. происходит ионизация атома водорода и электрон становится свободным.
2.Кремний и его соединения. Биологическая роль. Кремний — элемент главной подгруппы четвёртой группы третьего периода , с атомным номером 14, является р-элементом. твердое вещ-во ,
В группе где находится кремний происходит следующие изменения различных свойства. Сверху вниз: увеличение радиуса атома(увеличение метал. И основных свойств), уменьшение энергии ионизации (уменьшение электроотрицательности), уменьшается роль неподеленной электр. пары особенность кремния явл. , то что в образовании хим. Связи могут участв. Не только s-p подуровни , но и 3d подуровень.
Физический св-ва: темно-серое, тугоплавкое , проводит ток.
В невозбужденном состоянии у него 2 неспаренных электрона.
Sp3 – гибридизация ,коордиц. число = 6 , 1s2 2s2 2p6 3s2 3p2 , атомная решетка-куб , ковалентная неполярная связь , неметалл . Проявляет степени окисления -4(силанSiH4 , силициды металлов Mg 2Si ) 0(Si), +2(SiO), +4 ( оксид кремния 4 , кремниевая кислота и силикаты)
Получение: 1.в промышленности :Si02+ С = Si+ 2СО 2. в лаборатории: Si02+ 2Mg= 2MgO+ Si, 3Si02+ 4A1 = 2A1203+ 3Si.
Химические свойства:
Восстановитель: Si+2KOH+H2O=K2SiO3+2H2↑, Si+ 2F2 = SiF4, Si+ O2=SiO2, 3Si + 2N2=Si3 N4 Si+ 4HF= SiF4+2 H2, 2MgO + Si = 2Mg+ SiO2
Окислитель : Si+ 4HNOэ(конц.) = Si02+ 4N02+ 2Н20.С металлами Si +2 Mg= Mg2Si– силициды
SiO
– смолоподобное вещество, при обычных
условиях устойчивое к О2, в природе в
свободном состоянии не выявлено Получение
:![]() ,
,
![]() SiO+
2NaOH=Na2SiO⁴
+ H2
SiO+
2NaOH=Na2SiO⁴
+ H2
SiO2
- не взаимодействует с водой
![]() ,
,
![]() ,
,
![]() Получение
: Si + O2=SiO2,
H2SiO2=
SiO2+ H2O
Получение
: Si + O2=SiO2,
H2SiO2=
SiO2+ H2O
Кремневые кислоты очень слабые , мало растворимые в воде .
H2SiO⁴
- метакремниевая кислота (силикаты)
Получение:![]() , H2Si03
= SiO2 +H2O
, H2Si03
= SiO2 +H2O
H4 SiO4 – ортокремневая кислота(ортосиликаты) SiS2 + 4 H2O= H4SiO4 + 2H2S
Биологическая роль: Кремний относится к условно жизненным необходимым микроэлементам. В теле человека он везде , больше всего в костях, хрящах , влияет на их формирование и рост. Недостаток кремния приводит к снижению прочности и эластичности эпителиальных и соединительных образований.(атеросклероз и сердечно сосудистые заболевания) . С его дифицитом связывают возникновение гипертонической болезни, малокровия. Повышенное содержание(больше 500мг) приводит к болезни артрозу , силикозу.(нарушение деятельности легких)
