- •1.Комплексные соединения. Координационная теория Вернера. Классификация комплексных соединений.
- •3.Природа химической связи в комплексных соединениях. Метод валентных связей. Пространственное строение и магнитные свойства комплексов.
- •4.Теория кристаллического поля. Окраска комплексных соединений. Понятие о ммо.
- •5.Периодический закон как основа химической систематики. Групповая, типовая, полная электронная аналогия. Большие и малые периоды.
- •6.Водород. Положение в периодической системе. Физические и химические свойства.
- •7.Вода. Строение, особенности физических и химических свойств. Пероксид водорода.
- •14.Аммиак,его строение и свойства.Гидразин.Гидроксиламин.
- •17.Общая характеристика 4 группы. Углерод, его физические и химические свойства. Характеристическое соединения углерода.
- •18.Общая характеристика галогенов. Характеристические соединения галогенов.
- •Получение галогенов.
- •19.Металлы в периодической системе. Электрохимический ряд напряжений. Общие свойства металлов.
- •21.Общая характеристика s-элементов II группы. Магний, кальций.
- •22.Общая характеристика переходных металлов, d-элементы iIгруппы. Цинк.
1.Комплексные соединения. Координационная теория Вернера. Классификация комплексных соединений.
Комплексное соединение-соединение, полученное соединением отдельных групп, ионов, нейтральных молекул, способных к самостоятельному существованию.
Координационная теория Вернера-рассматривает строение комплексных соединений.
В комплексных соединениях выделяют внутреннюю и внешнюю сферу.
Внутренняя сфера-прочное, единое целое и в процессах диссоциации и химических реакций.
Внешняя сфера-вне=за :[ ]. Вне внутренней сферы.
Центральный атом-комплексообразователь. Его роль выполняют нейтральные или заряженные ионы, как правило, Ме.
Лиганды-окружают комплексообразователь.
Координационное число- число связей, которые комплексообразователь образует с лигандами.
Дентатность- число связей, которое лиганд образует с комплексообразователем. В качестве лигандов выступают нейтральные молекулы, ионы.
Амбидентатные- лиганды, образующие связи с комплексообразователем с помощью атомов.
Классификация комплексных соединений:
1)По природе лиганда:
Однородный комплекс-если один вид лиганда.
Смешанный комплекс-если несколько лигандов.
Однородные делятся на:
Аква-кмопл.(H2O)
Аммиакаты(NH3)
Ацидокомплексы(NO3,SO2)
Гидроксомплесы(OH)
2)По заряду комплекса:
Катионные компл.
Анионные компл.
Нейтральные компл.
Сложные компл.(и катион и анион)
3)По принадлежности к классу соединений комплексные:
Соли Na3[Al(OH)6]
Кислоты H2[PtCl4]
Основания [Ag(NH3)2]OH
4) По числу комплексообр.: полиядерные компл. И моноядерн.компл.
Кластер- полиядерн.компл, в котором имеется связь между комплексообр.. Комплексообр. Ссвязаны между собой.
В других полиядерн.компл. связаны через лиганд и назыв.-мостиковые.
5)По структуре комплекса различают простые и циклически компл.
Хелаты-образуют всегда полидентатный лиганд. Хилаты отлич. Особой прочностью.
Внутрикомплекс.соед.-хелаты, захватывывающие комплексообр.лиганды , образуются обычным путем и донорно-акцепторным путем.
2. Изомерия координационных соединений. Устойчивость комплексных соединений. Константа нестойкости.
Внутрисферная и межсферная изомерия.
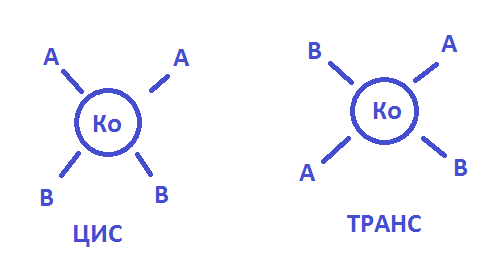
Внутрисферная- геометрическая(пространственная изомерия)
[Pt(NH3)2Cl2]

Транс-изомер цис-изомер
Ко-комплексообр. АВ-лиганды
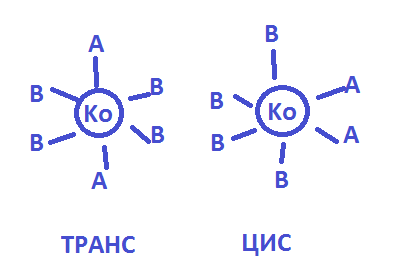
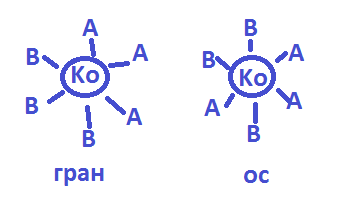
Зеркальная(оптическая) изомерия-для компл. Тетраэдрич.строения
Изомерия связи(солевая)
[Co(NH3)5NCS]Cl2
[Co(NH3)5SCN]Cl5
Межсферная изомерия-перераспределение частиц между внутренней и внешней сферой комплекса
Сольватная изомерия
[Cr(H2O)6]Cl3
[Cr(H2O)5]Cl2*H2O
[Cr(H2O)4]Cl*2H2O
Ионизационная изомерия
[Pt(NH3)4Br2]Cl2
[Pt(NH3)4Cl2]Br2
Координационная изомерия
[Pt(NH3)4][PdCl4]
[Pd(NH3)4][PtCl4]
Устойчивость комплексных соединений
Kуст=1/Кнест
Константа нестойкости
Kрасп=[Cr^3+][H2O]^6/[Cr(H2O)^3+ 6]
[Cr(H2O)6]Cl3=[Cr(H2O)6]^3+ + 3Cl^-
[Cr(H2O)6]^3+=Cr^3+ +6H2O
3.Природа химической связи в комплексных соединениях. Метод валентных связей. Пространственное строение и магнитные свойства комплексов.
Электростатическая теория Косселя Магнуса.:
Электростатическая теория-взаимодействие между комплексообразователем и ионными (или полярными) лигандами подчиняется закону Кулона.
Исходя из теории Косселя, чем вые заряд комплексообр., чем меньше радиус, тем прочнее компплекс.
[Cu(NH3)2Cl]
Для описания хим.связи сущ. 3 способа:
МВС(метод валентных связей)
ТКП(теория кристаллического поля)
ММО(метод молекулярных орбиталей)
МВС основывается:
между комплексоообр. И лигандами образуется ковалентная связь по донорно-акцепторному механизму ,причем лиганд-донор,комплексообр.-акцептор( свобод орбиталь)
Высокоспиновый комплекс- много неспаренных параллельных спиновых.
Низскоспиновый комплекс- орбитали с низкой энергией полностью заполняются до того, как начинается заполнение орбиталей с высокой энергией.
Диамагнетик-магнитные свойства не выражены. Если есть спаренные
Парамагнетик-магнитные свойства выражены. Если есть неспаренные.
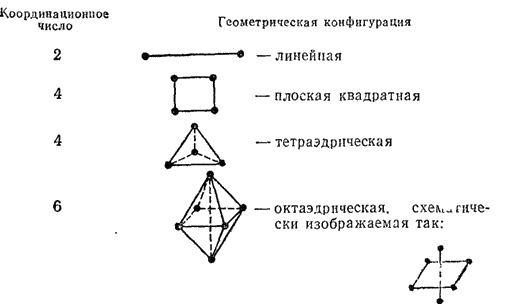
sp-линейная
sp^3-тетраэдр
dsp^2-квадрат
d^2sp^3;sp^3d^2-октаэдр
ТКП-под взаимодействием лигандов меняется энергия орбиталей комплексообразователя.