
модульный урок по теме кальций и его соединения
.docxМодульный урок по химии в 9 классе.
Комбинированная дидактическая цель(КДЦ): изучение свойств металлов IA-IIIA-групп периодической таблицы химических элементов Менделеева.
Интегрирующая дидактическая цель(ИДЦ): расширить и углубить знания о щелочноземельных металлах и образуемых ими простых и сложных веществах на примере кальция; показать области применения кальция его основных соединений; изучить его физико-химические свойства; учить записывать уравнения химических реакций;
Частные дидактические цели(ЧДЦ):
1.Положение кальция в периодической таблице химических элементов, строение его атома.
2.Нахождение в природе.
3.Получение.
4.Физико-химические свойства.
5.Применение.
6.Важнейшие соединения кальция, получаемые в промышленности.
7.Решение экспериментальных задач.
Ход урока:
1.Организационный момент:
Постановка целей и задач урока.
Ознакомление учащихся с учебными элементами модуля.
Работа ученика: записать число и тему урока.
2.Учебная деятельность:
Учебный элемент-0(УЭ-0)
Входной контроль:
1. Вспомнить, что такое металлы?
2.Где находятся металлы в ПСХЭ?
3.Кем являются металлы? Окислителями или восстановителями?
4.Характерные химические свойства металлов?
5.Какой тип связи характерен для металлов? Их соединений?
УЭ-1
Цель: знать положение кальция в ПСХЭ, схему строения атома, распределение электронов по орбиталям, степень окисления, которую проявляет кальций.
Задание: прочитать §40 учебника.
Провести опрос учащихся о ЩЗМ и заполнить таблицу:
Работа ученика:
|
Что знаем? |
Ответ |
|
1.Положение ПСХЭ
2. Строение атома
3.Изменение свойств по группе сверху вниз |
1. Кальций в ПСХЭ находится во II-группе, главной подгруппе. 2.ЩЗМ
имеют большой радиус, так как находятся
почти в начале периодов. На внешнем
уровне имеют 2 электрона,
как следствие проявляет степень
окисления:+2.
-число элетронных слоев увеличивается -радиус увеличивается -ЭО уменьшается -металлические свойства усиливаются |
УЭ-2
Цель: знать нахождение кальция в природе.
Рассказ учителя: Кальций принадлежит к числу самых распространённых в природе элементов. В земной коре его содержится приблизительно 3% (масс.). Из-за своей химической активности в чистом виде кальций в природе не встречается, встречается только в виде соединений (солей).
Задание 1: с помощью учебника заполнить таблицу(§41,стр.120)
Задание 2: составьте уравнение химической реакции в молекулярном и ионном виде взаимодействия карбоната кальция с раствором соляной кислоты.
Работа ученика:
Из-за высокой химической активности,
кальций в природе встречается только
в виде соединений:
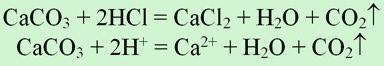
Промежуточный контроль:
Вызвать ученика к доске по желанию для заполнения таблицы и написания реакций.
Рассказ учителя:
Кальций (его минеральные соли) является основным компонентом костей скелета и зубов животных и человека, обеспечивает правильное развитие костной ткани. Недостаток кальция в организме на фоне нарушения фосфорно-кальциевого обмена приводит к развитию рахита. Из карбоната кальция построен скелет кораллов и моллюсков (раковины). Ионы кальция стимулируют сердечную деятельность. В виде солей лимонной и фосфорной кислот кальций входит в состав сыворотки крови и обеспечивает ее свертываемость. Многие соли кальция плохо растворимы в воде, при старении организма они осаждаются из крови на стенках сосудов, что приводит к развитию различных заболеваний (желчекаменной болезни, катаракты и др.).
УЭ-3
Цель: знать получение кальция.
Задание: самостоятельно в учебнике изучить получение кальция (§41,стр.120).
Работа ученика: кальций в промышленности получают путем электролиза расплавов хлоридов.
УЭ-4
Цель: знать физико-химические свойства кальция.
Задание: самостоятельно в учебнике изучить физико-химические свойства кальция (§41,стр.120).
Работа ученика: кальций-металл серебристо-белого цвета,очень легкий, плотность=1,555 г/см3,температура плавления=851оС.
Является сильным восстановителем.
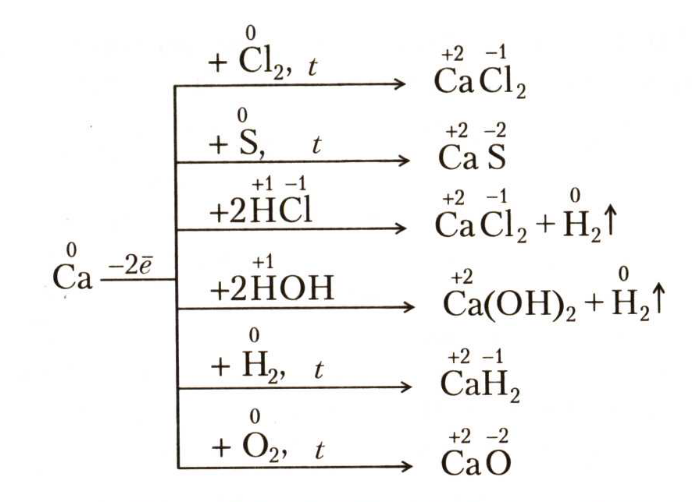
Соединения кальция окрашивают пламя в кирпично-красный цвет. Как и щелочные металлы хранят под слоем керосина.
УЭ-5
Цель: знать применение кальция.
Задание: самостоятельно в учебнике изучить применение кальция (§41, стр.120).
Работа ученика: металлический кальций из-за большой химической активности применяют для восстановления некоторых тугоплавких металлов (титан, цирконий и др.) из их оксидов. Используют также в производстве стали и чугуна.
Промежуточный контроль:
Ответить на вопросы 3-6 стр.125.
УЭ-6
Цель: знать важнейшие соединения кальция, получаемые в промышленности.
Рассказ учителя:
Оксид кальция. СаО - негашеная известь, жженая известь. Белое тугоплавкое вещество, очень гигроскопичное.
Получают в виде рыхлого аморфного порошка прокаливанием известняка, мрамора:
При температуре: 800°С
СаСОз = СаО + С02|
Типичный основный оксид, взаимодействует с водой, образуя щелочь:
СаО + Н20 = Са(ОН)2 ( гашеная известь, известковое молоко, известковая вода)
Как основный оксид, реагирует с кислотными оксидами и кислотами:
СаО + С02| = СаС03; СаО + S03 = CaS04
Сплавление: СаО + Si02 = CaSi03
СаО + 2НС1 = СаС12 + Н20
Практически значимой реакцией является взаимодействие с коксом:
СаО + ЗС = СаС2 + CO2 ( карбид кальция СаС2 )
СаО, или негашеная известь, применяется для освобождения газов одновременно от воды и С02.
Гидроксид кальция Са(ОН)2 - гашеная известь.
Пылеобразный аморфный порошок белого цвета («пушонка»), малорастворимый в воде (1,7 г в 1 л Н20 при 18 °С). Получают растворением жженой извести в воде (гашение извести). Насыщенный раствор Са(ОН)2 в воде называют известковой водой, а взвесь его в воде носит название «известковое молоко. В присутствии солей щелочных металлов, и особенно NH4CI, растворимость Са(ОН)2 увеличивается.
Известковая вода - реактив для обнаружения С02, при пропускании которого раствор сначала мутнеет из-за образования нерастворимого СаСОз, а потом становится прозрачным из-за образования кислой соли Са(НС03)2:
Са(ОН)2 + С02 = СаСОз! + Н20
Са(ОН)2 + 2С02 = Са(НС03)2 гидрокарбонат кальция
Гидроксид кальция - сильное основание (щелочь). В растворе практически полностью диссоциирует:
Са(ОН)2 = Са2+ + 2ОН -
Как сильное основание, проявляет все характерные для этого класса соединений свойства:
1)реагирует с кислотными оксидами:
Са(ОН)2 + С02 = СаС03| + Н20
(избыток карбоната кальция)
Са(ОН)2 + 2С02 = Са(НС03)2 гидрокарбонат кальция
2) реагирует с кислотами:
Са(ОН)2 + H2S04 = CaS04 + 2H20
3) реагирует с растворимыми солями металлов, гидроксиды, которых нерастворимы в Н20, например:
FeCl2 + Са(ОН)2 = Fe(OH)2 + СаС12
Гипс. Различают следующие виды гипса: природный – CaSO4 ∙ 2H2O, жженый(полуводный, алебастр) – (CaSO4)2 ∙ H2O, безводный – CaSO4.
Если смешать порошок алебастра с водой, то образуется полужидкая пластическая масса, которая быстро твердеет. Процесс затвердевания объясняется присоединением воды:
(CaSO4)2 ∙ H2O + 3H2O → 2 [CaSO4 ∙ 2H2O]
Свойство жженого гипса затвердевать используют на практике. Так, например, алебастр в смеси с известью, песком и водой применяют в качестве штукатурки. Из чистого алебастра изготавливают художественные изделия, а в медицине его используют для накладывания гипсовых повязок.
Если природный гипс CaSO4 ∙ 2H2O нагревать при более высокой температуре, то выделяется вся вода:
CaSO4 ∙ 2H2O → CaSO4 + 2H2O↑
Образовавшийся безводный гипс CaSO4 уже не способен присоединить воду, и поэтому его назвали мертвым гипсом.
Выходной
контроль:
4. В какой цвет соединения кальций окрашивают
пламя горелки?
а) зеленый
б) фиолетовый
в) голубой
г) кирпично-красный
УЭ-7
Решение экспериментальных задач.
-
В четырех пробирках для двух вариантов даны следующие кристаллические вещества: А. а) хлорид кальция; б) гидроксид натрия; в) карбонат калия; г) хлорид стронция. Б. а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) хлорид калия. Опытным путем определите, в какой пробирке находится какое вещество. Пользуясь таблицей 3 (с. 14—15), напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде.
2. Проделайте следующие превращения:
а) СаС12 —► Са(ОН)2 —* СаСОз —► Са(НСОз)2 —* СаСОз —*■ СэС12
Составьте уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде.
Домашнее задание: письменно ответить на вопросы 7-12, задачи 1-2 (стр. 125), §40-41, стр.119-123.

