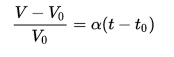- •Оглавление
- •2. Химические свойства Металлов и Неметаллов
- •4. Коррозия Металлов, способы устранения коррозии
- •5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение)
- •6. Химические свойства солей, получение, применение, классификация, номенклатура
- •1. Реакция нейтрализации
- •7. Химические свойства оксидов, определение, свойства, получение, номенклатура.
- •8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды
- •10.Дисперсные системы. Строение мицелл. Воздействие на систему.
- •11. Скорость химической реакции. Факторы, влияющие на скорость.
- •12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции
- •13. Окислительно-восстановительные реакции. Основные окислители и восстановители
- •14. Электролиз
- •15. Алканы, алкены, алкины. Химические свойства, применение.
- •16. Реакции полимеризации и поликонденсации
- •17. Химическая связь. Типы химической связи
- •18. Гидролиз и электрическая диссоциация
- •19. Способы выражения концентрации раствора. Растворы
- •20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
- •21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
- •22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона.
- •Природный газ - сн4 (Метан)
- •Типы классификаций реакции.
- •По тепловому эффекту.
- •По присутствию других веществ.
Оглавление
Оглавление 1
1. Основные понятия и законы химии (Пост. состава, Газовые законы: закон Бойля-Мариотта, Авогарда, Шарля, Гей-люссака, закон сохранения массы и энергии, закон постоянства Рихтера, уравнение Менделеева-клайперона, дальтониты и бертоллиды. 2
2. Химические свойства Металлов и Неметаллов 2
3. Классификация неорганических соединений 3
4. Коррозия Металлов, способы устранения коррозии 3
5. Кислота (классификация, слабые и сильные, номенклатура, химические свойства кислот, взаимодействие с неметаллами, получение, применение) 4
6. Химические свойства солей, получение, применение, классификация, номенклатура 6
7. Химические свойства оксидов, определение, свойства, получение, номенклатура. 8
8. Химические свойства оснований, классификация, номенклатура, получение. Амфотерные гидроксиды и оксиды 9
9. Химическая термодинамика. Понятия системы, энтропия, энтальпия, тепловой эффект химической реакции, закон Гесса и его следствие. Эндотерм и Экзотерм реакции, 1 и 2 законы термодинамики, Скорость химической реакции (факторы влияющие), правило Вант- Гоффа, уравнение Вант- Гоффа. 11
10.Дисперсные системы. Строение мицелл. Воздействие на систему. 12
11. Скорость химической реакции. Факторы, влияющие на скорость. 13
12. Химическое равновесие. Принцип Ле-Шателье, обратимые, необратимые реакции 14
13. Окислительно-восстановительные реакции. Основные окислители и восстановители 14
14. Электролиз 15
15. Алканы, алкены, алкины. Химические свойства, применение. 16
16. Реакции полимеризации и поликонденсации 17
17. Химическая связь. Типы химической связи 18
18. Гидролиз и электрическая диссоциация 18
19. Способы выражения концентрации раствора. Растворы 21
20. Строение атомов: Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда. 22
21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули. 23
22. Современное представление о строение атома: принцип неопределенности Гейзенберга, двойственная природа электрона. 24
Разное 24
1. Основные понятия и законы химии (Пост. состава, Газовые законы: закон Бойля-Мариотта, Авогарда, Шарля, Гей-люссака, закон сохранения массы и энергии, закон постоянства Рихтера, уравнение Менделеева-клайперона, дальтониты и бертоллиды.
Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства.
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам. Простые вещества- молекулы, состоят из атомов одного и того же элемента.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м. Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения - моль.
Относительная атомная масса (Ar) – это отношение средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Относительная молекулярная масса (Mr) — величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов.
Моль вещества (n) — это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12C.
Молярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества.
M = m / n
Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента вещества называется эквивалентной массой (mэкв).
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества
Законы:
Закон Бойля — Мариотта
При постоянных температуре и массе газа произведение давления газа на его объём постоянно.
![]()
p - давление газа; V - объём газа, C - постоянная в оговоренных условиях величина.
Закон Авогадро
В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же количество молекул.
Закон Шарля
Давление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной температуре газа.
![]() где:
где:
P — давление газа,
T — температура газа (в градусах Кельвина),
k — константа.
Закон Гей-Люссака
Относительное изменение объёма данной массы газа при неизменном давлении пропорционально изменению температуры: