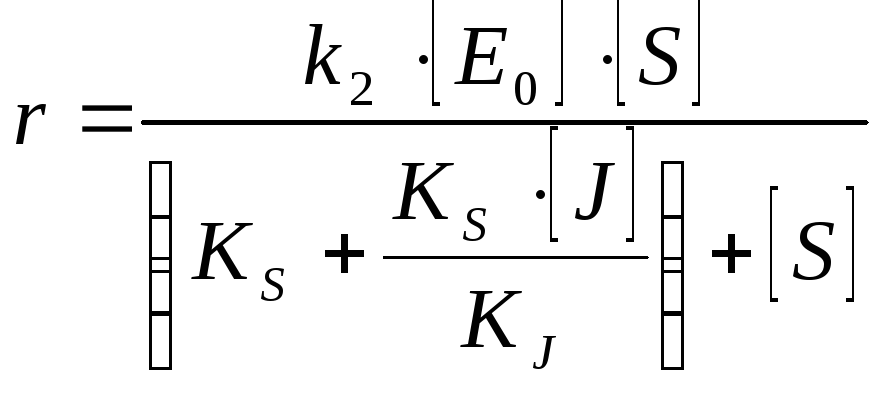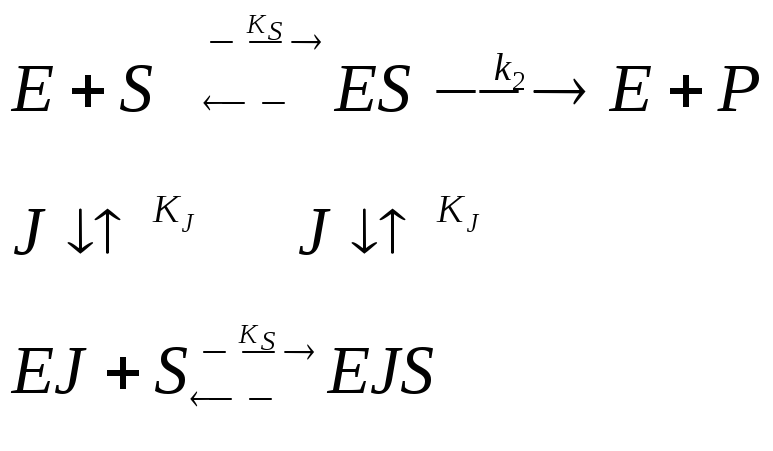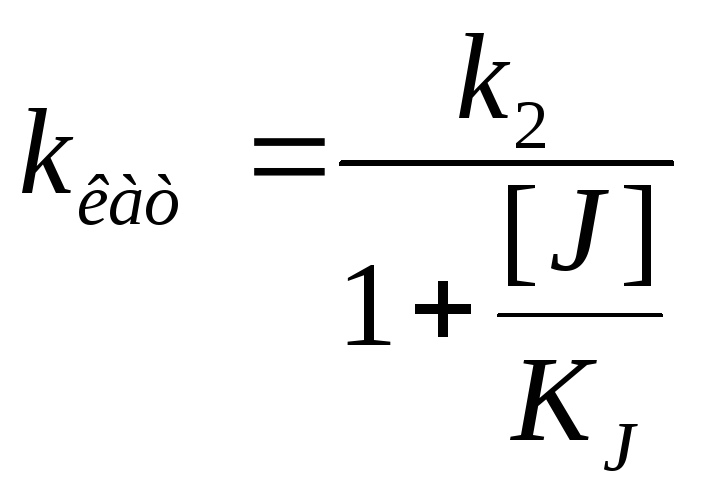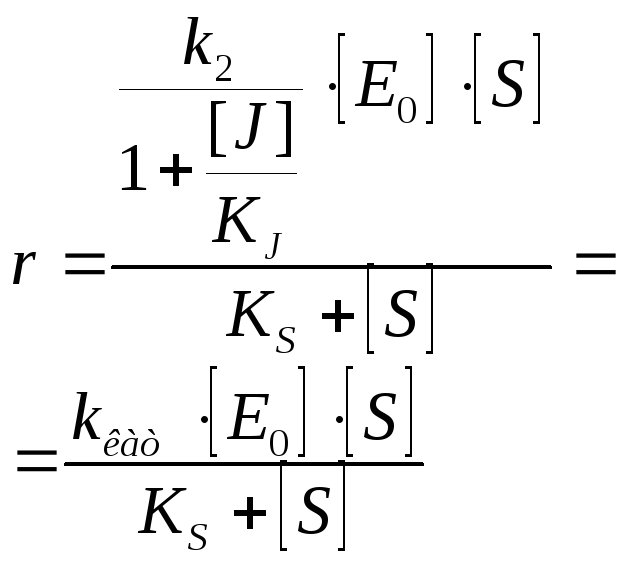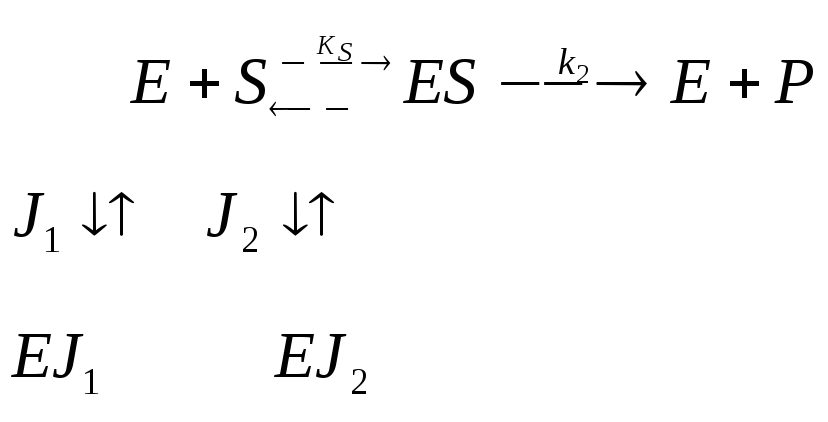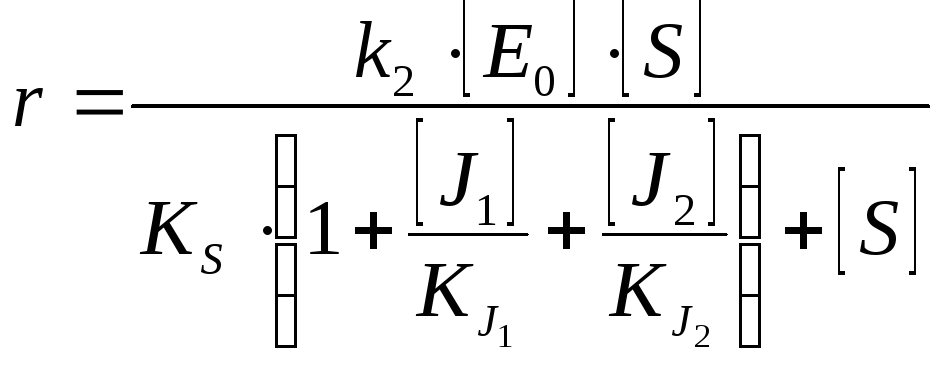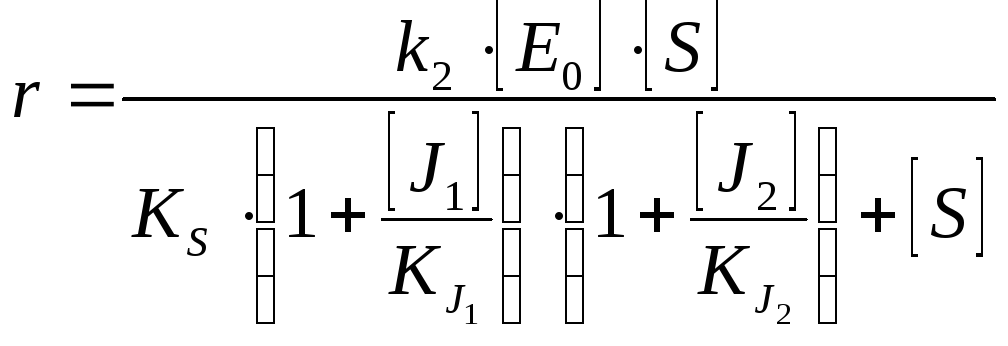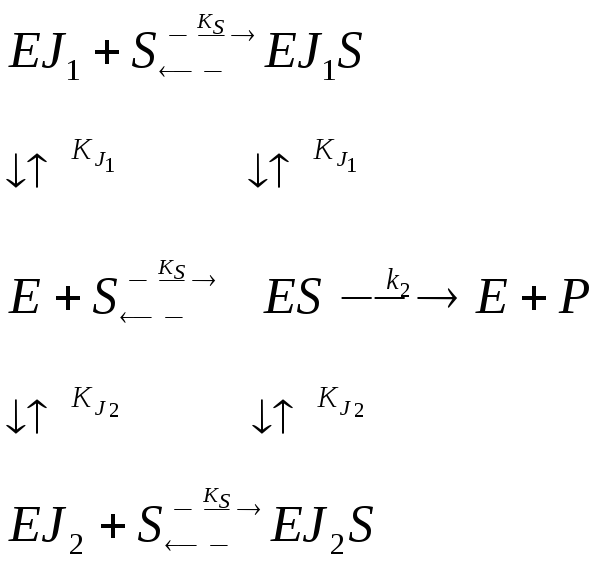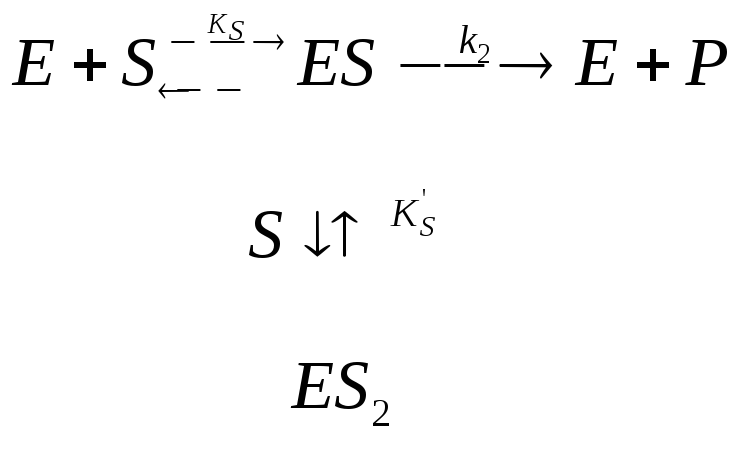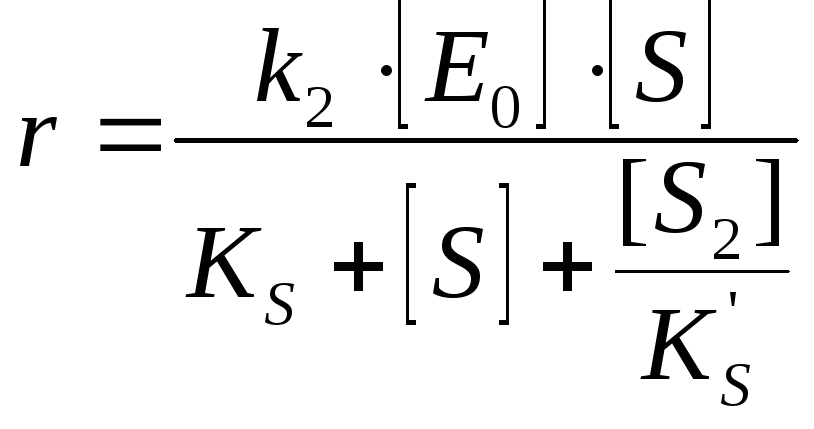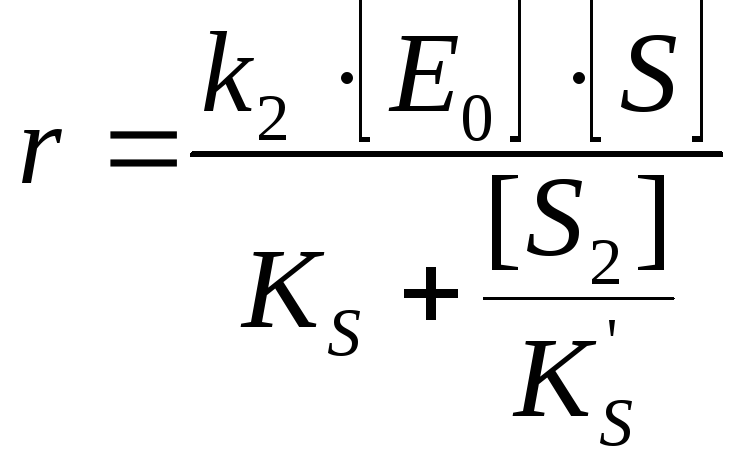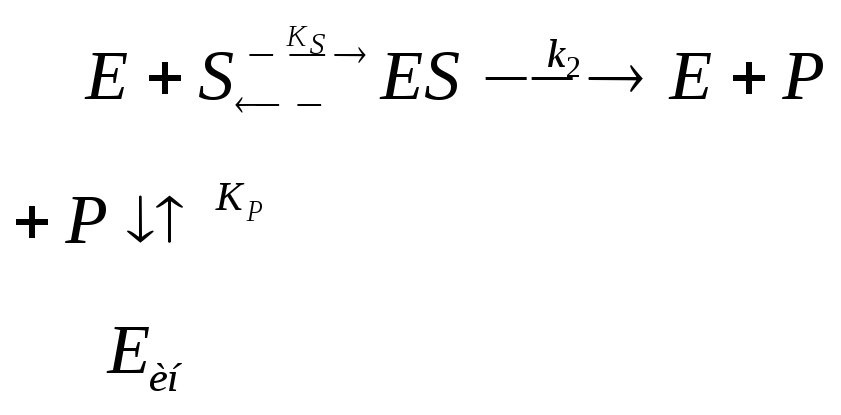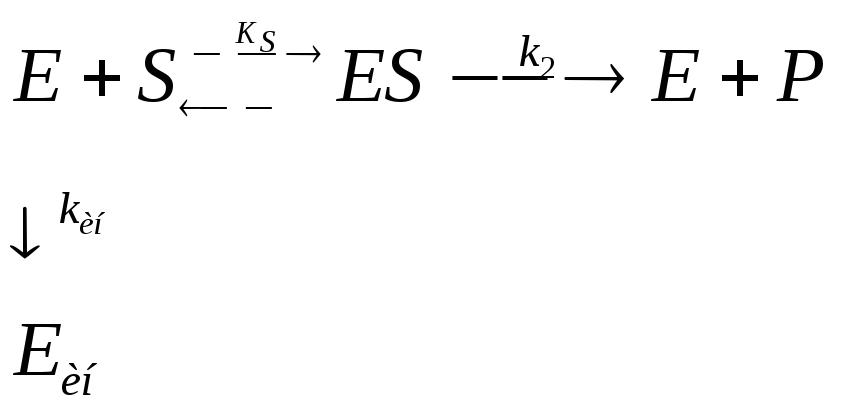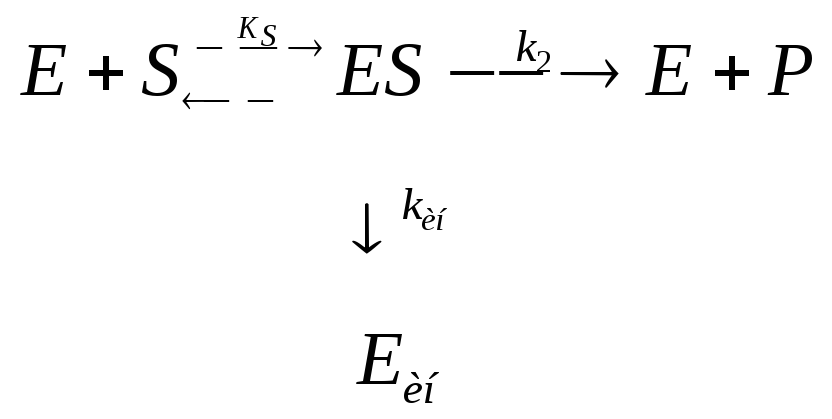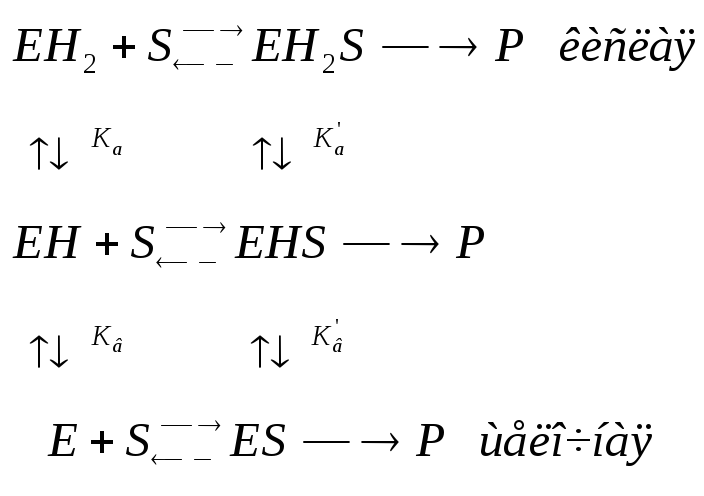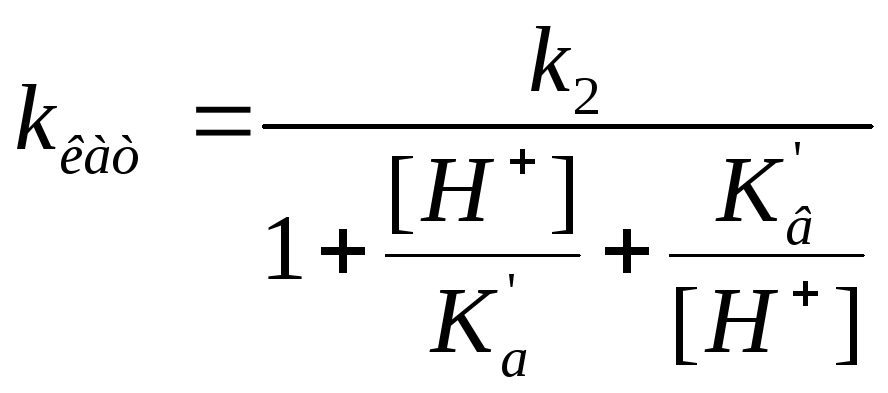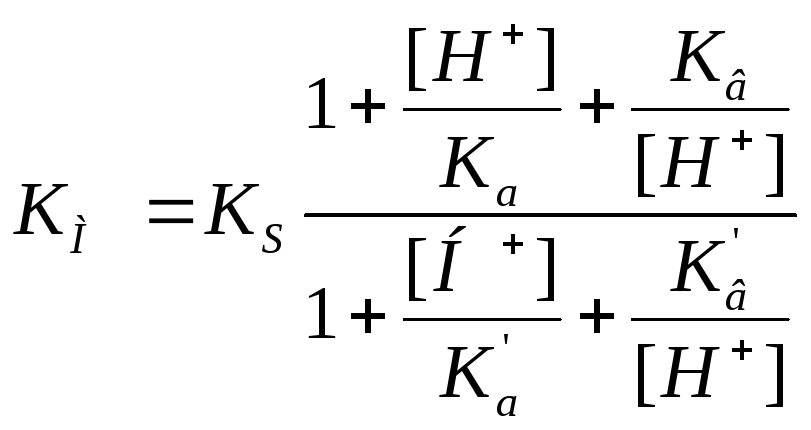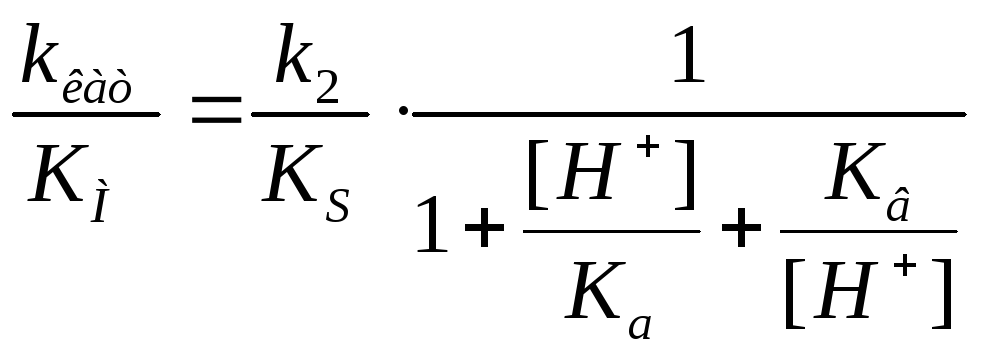Методичка БФХ / 3 часть
.docФерментативная кинетика и катализ
Ферменты..
Кинетическое описание ферментативных процессов.
Процессы, протекающие в присутствии биологических катализаторов – ферментов, - имеют исключительно важное значение в современной биотехнологии. Это объясняется не только широким применением ферментов, но и тем, что процессы в живой природе протекают почти исключительно ферментативным путём. Таким образом, количественное изучение и кинетическое описание ферментативных реакций создают научные основы процессов инженерной энзимологии, а для микробиологических производств дают возможность обосновать выбор оптимального режима биосинтеза и открывают принципиальные пути регулирования и управления жизнедеятельностью микроорганизмов.
![]()
где, E – фермент; S – субстрат; ES – промежуточный фермент-субстратный комплекс; P – продукт; k1; k-1; k2 – константы скорости элементарных реакции в уравнении.
Постулаты (ограничения)
-
Образуется фермент-субстратный комплекс
-
Самая медленная стадия – реакция катализа
k2 << k1; k2<< k-1
-
Комплекс EP не образуется, вторая стадия не обратима (реакция идёт при очень большом избытке субстрата)
[S] >> [E]; [S] >> [P]
-
С каждым активным центром фермента связывается одна молекула субстрата
-
При анализе кинетических характеристик ферментных реакций можно пользоваться концентрациями, а не активностями вследствие разбавленности раствора.
Дифференциальная форма Михаэлиса-Ментен
Наиболее простое допущение, принимаемое при выводе уравнения по схеме (1), заключается в предположении, что фермент-субстратный комплекс, всё время находится в равновесии с исходными веществами, то есть что равновесие на первой стадии устанавливается очень быстро и не нарушается частичным превращением комплекса ES в продукт с высвобождением фермента в форме, свободной от субстрата. В этом случае константу равновесия первой стадии принято обозначать через KS, относя её, однако, не к образованию, а к распаду фермент-субстратного комплекса. Очевидно, константа нестойкости комплекса ES:
![]() (2)
(2)
связана с константами схемы (1) равенством
![]() (3)
(3)
k2 << k1, k-1
Скорость ферментативного превращения субстрата равна скорости образования продукта, то есть скорости второй стадии, если концентрация субстрата много больше концентрации фермента. что обычно наблюдается на практике. Тогда при [S] >> [E0]:
![]() (4),
(4),
где, E0 обозначена концентрация фермента в начальный момент времени в начальный момент времени превращения.
[S0] ≈ [S] Изменение концентрации S можно пренебречь, концентрация ES будет лимитироваться концентрацией E.
В ходе реакции, если нет посторонних эффектов, будет соблюдаться равенство:
![]() (5),
(5),
поскольку фермент, первоначально внесённый в реакционную массу, будет присутствовать в ней либо в свободном виде, либо в виде комплекса с субстратом.
Из уравнения (2):
![]() (6)
(6)
![]()
![]() ,
подставляя в (6)
,
подставляя в (6)
![]()
![]()
Интегральная форма равнения.
![]() ,
,
![]()
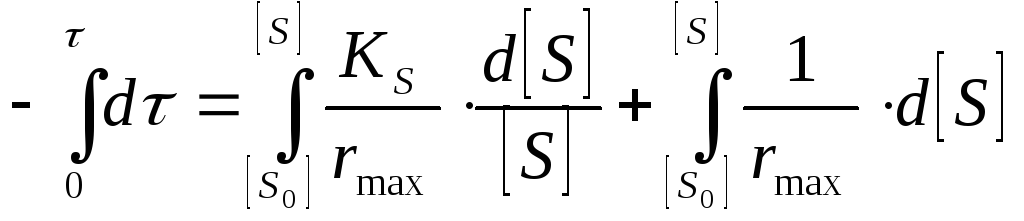
![]()
![]()
|
|
|
|
|
Ингибирование |
||
|
Однокомпонентное ингибирование |
||
|
Полностью конкуретное ингибирование (поражение адсорбционного центра) |
|
|
|
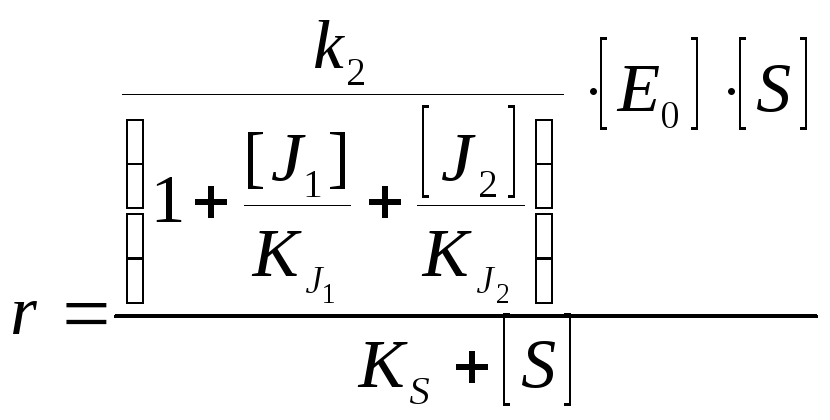
Полностью неконкуретное ингибирование [S] >> [E] J поражает каталитический центр или изменяет конформацию |
|
|
|
Двухкомпонентное ингибирование |
||
|
Взаимозависимое полностью конкурентное |
|
|
|
Взаимозависимое полностью конкурентное |
|
|
|
Взаимозависимое полностью неконкуретное |
|
|
|
Ингибирование субстратом |
|
Если низкие
концентрации [S]:
Если высокие концентрации [S]:
|
|
Ингибирование продуктом Продукт ингибирует фермент по полностью конкурентному типу |
|
|
|
Обратная изомеризация фермента (переход в неактивную форму) |
|
[S] высокая
[S] низкая
|
|
Необратимая инактивация фермента |
|
kин – константа скорости
|
|
|
|
|
|
Влияние кислотности среды на кинетику ферментных реакций Может поражать адсорбционный центр, может поражать каталитический центр, но при этом может образовывать продукт |
|
|
|
|
|
|
|
|
|
|
Основные положения теории фермент-субстратного комплекса. Вывод дифференциальной формы уравнения Михаэлиса-Ментен. Уравнение Бригса-Холдейна. Типы координат, используемые для анализа кинетических констант биохимических реакций в биотехнологии.
Понятие об ингибиторах/активаторах. Однокомпонентное (полностью конкурентное, полностью неконкурентное) ингибирование. Графическая интерпретация ингибирования в координатах Лайнуивера-Берка, Диксона. Двухкомпонентное полностью конкурентное (взаимозависимое, взаимонезависимое) ингибирование, полностью неконкурентное взаимозависимое ингибирование.
Вывод уравнение и особенности нахождения каталитических констант в случаях обратимой изомеризации фермента в неактивную форму, ингибирования субстратом, активации фермента.
Интегральная форма уравнения Михаэлиса-Ментен. Особенности ее графической интерпретации в случае ингибирования продуктом. Влияние температуры на скорость ферментативных реакций. Применение интегральной формы уравнения Михаэлиса-Ментен в случае необратимой инактивации фермента. Влияние рН на скорость ферментативных реакций.
Задача 1. Определите значения кинетических параметров (методом де Мигуэл Марино и Тамари) гидролиза метилового эфира N-ацетил-L-валина, катализируемого α-химотрипсином, исходя из данных таблицы. [E]0=3,8*10-5 моль/л
-
[S]0, моль/л
r0, моль/л*с
0,200
4,57*10-6
0,124
3,83*10-6
0,091
3,33*10-6
0,071
2,97*10-6
0,060
2,67*10-6
Задача 2. Определите значения кинетических параметров (методом Иди-Хофсти) гидролиза бутирилхолина, катализируемого холинэстеразой исходя из данных таблицы. [E]0=5,0*10-6 моль/л
|
[S]0, моль/л |
r0, усл.ед. |
|
10,00*10-4 |
5,55 |
|
2,50*10-4 |
4,45 |
|
0,91*10-4 |
2,94 |
|
0,50*10-4 |
2,09 |
Задача 3. Определите значения кинетических параметров (методом Иди-Хофсти) гидролиза метилового эфира N-бензоил-L-аминомасляной кислоты, исходя из данных таблицы. [E]0=2,16*10-6 моль/л.
-
[S]0, моль/л
r0, моль/л*с
2,24*10-3
4,25*10-7
1,49*10-3
3,52*10-7
1,12*10-3
3,10*10-7
0,90*10-3
2,71*10-7
0,75*10-3
2,45*10-7
Задача 4. Исходя из данных таблицы определите кинетические параметры (методом де Мигуэл Марино и Тамари) гидролиза N-ацетил-L-норвалина, катализируемого α-химотрипсином. [E]0=2,62*10-7 моль/л.
-
[S]0, моль/л
r0, моль/л*с
4,00*10-2
9,70*10-7
2,00*10-2
7,77*10-7
1,33*10-2
6,51*10-7
1,00*10-2
5,50*10-7
0,80*10-2
4,80*10-7
Задача 5. Исходя из данных таблицы определите кинетические параметры (методом де Мигуэл Марино и Тамари) гидролиза бактериальных клеток, катализируемого лизоцимом. [E]0=5,72*10-8 моль/л.
|
[S]0, мг/мл |
r0, ед.опт.пл./с |
|
6,53*10-2 |
1020*10-6 |
|
8,40*10-2 |
1110*10-6 |
|
11,2*10-2 |
1180*10-6 |
|
15,5*10-2 |
1310*10-6 |
Задача 6. Определите значения кинетических параметров (методом Иди-Хофсти) гидролиза этилового эфира N-транс-циннамоил-L-тирозина исходя из данных таблицы. [E]0=3,1*10-9 моль/л.
-
[S]0, моль/л
r0, моль/л*с
0,36*10-3
1,94*10-7
0,18*10-3
1,84*10-7
0,12*10-3
1,75*10-7
0,090*10-3
1,67*10-7
0,072*10-3
1,59*10-7
Задача 7. Определите КМ и rmax (методом Иди-Хофсти) для процесса со следующими кинетическими характеристиками:
|
[S]0, моль/л |
r0, моль/л*мин |
|
0,002 |
0,045 |
|
0,020 |
0,285 |
|
0,060 |
0,460 |
|
0,100 |
0,505 |
Задача 8. Определите КМ и rmax (методом методом де Мигуэл Марино и Тамари) для реакции восстановления пирувата, если известно, что:
|
[S]0, моль/л |
r0, моль/л*мин |
|
20,0*10-6 |
3,15*10-6 |
|
29,0*10-6 |
3,70*10-6 |
|
40,0*10-6 |
4,10*10-6 |
|
50,0*10-6 |
4,39*10-6 |
Задача 9. Определите КМ и rmax (методом Иди-Хофсти) для реакции гидролиза бактериальных клеток, катализируемой лизоцимом, если известно, что:
|
[S]0, мг/мл |
r0, ед.опт.пл./с |
|
1,17*10-2 |
380*10-6 |
|
1,87*10-2 |
516*10-6 |
|
3,73*10-2 |
800*10-6 |
|
7,46*10-2 |
1100*10-6 |
Задача 10. Определите КМ и rmax (методом де Мигуэл Марино и Тамари) для реакции гидролиза, катализируемой трипсином, если известно, что
-
[S]0, моль/л
r0, моль/л*с
1,00*10-2
32,5*10-7
0,80*10-2
28,1*10-7
0,67*10-2
24,5*10-7
0,55*10-2
21,5*10-7
0,50*10-2
21,3*10-7
Задача 11. Определите КМ и rmax (методом Иди-Хофсти) для реакции гидролиза N-ацетил-L-аланил-L-фенилаланина, катализируемого
α-химотрипсином, если известно, что:
-
[S]0, моль/л
r0, моль/л*с
0,153*10-2
4,94*10-7
0,0765*10-2
4,20*10-7
0,0510*10-2
3,74*10-7
0,0383*10-2
3,02*10-7
Задача 12. Определите КМ и rmax (методом де Мигуэл Марино и Тамари) для процесса со следующими кинетическими характеристиками:
|
[S]0, моль/л |
r0, моль/л*мин |
|
0,002 |
0,09 |
|
0,020 |
0,57 |
|
0,060 |
0,92 |
|
0,100 |
1,01 |
Задача 13. Приведенные ниже данные были получены при изучении ингибирования, вызываемого L-β-окси-β-(трео)-метиласпартатом. Определите тип ингибирования и все возможные кинетические характеристики процесса, если известно, что [E]0= 1*10-5 моль/л.
|
[S]0, моль/л |
r0, моль/л*мин |
|
|
[I] = 0 |
[I] = 5*10-4 моль/л |
|
|
0,5*10-4 |
14,0*10-3 |
6,0*10-3 |
|
5,0*10-4 |
92,0*10-3 |
40,0*10-3 |
|
25,0*10-4 |
150,0*10-3 |
120,0*10-3 |
Задача 14. Приведенные ниже данные были получены при изучении ингибирования в системе с β-метиласпартазой. При этом в качестве субстрата использовался L-трео-β-метиласпартат. Определите тип ингибирования и все возможные кинетические характеристики процесса, если известно, что [E]0= 2,5*10-5 моль/л.
|
[S]0, моль/л |
r0, моль/л*мин |
|
|
[I] = 0 |
[I] = 5*10-4 моль/л |
|
|
1,0*10-4 |
26,0*10-3 |
10,0*10-3 |
|
15,0*10-4 |
136,0*10-3 |
86,0*10-3 |
|
50,0*10-4 |
165,0*10-3 |
142,0*10-3 |
Задача 15. Бензоат 1,2,5-триметилпиперидол-4 (β-изомер) является ингибитором гидролиза бутиролхолина. Определите тип ингибирования и все возможные кинетические характеристики процесса исходя из данных таблицы. [E]0 = 6,2*10-6 моль/л.
|
[S]0, моль/л |
r0, усл. ед. |
|
|
[I] = 0,05*10-4 моль/л |
[I] = 0,20*10-4 моль/л |
|
|
10,00*10-4 |
4,77 |
2,86 |
|
2,50*10-4 |
3,78 |
2,28 |
|
0,91*10-4 |
2,56 |
1,52 |
|
0,50*10-4 |
1,79 |
1,06 |
Задача 16. Установлено, что α-кетоглутарат является ингибитором реакции, катализируемой N-метил-глутамат-дегидрогеназой. Определите тип ингибирования и все возможные кинетические характеристики процесса исходя из данных таблицы. [E]0=4,5*10-2 мг/мл.
|
[S]0, моль/л |
r0, моль/л*мин |
|
|
[I] = 6*10-4 моль/л |
[I] = 30*10-4 моль/л |
|
|
1,67*10-4 |
1,67*10-6 |
1,00*10-6 |
|
1,00*10-4 |
1,43*10-6 |
0,77*10-6 |
|
0,500*10-4 |
1,04*10-6 |
0,45*10-6 |
Задача 17. При исследовании свойств холинэстеразы обнаружен ингибитор ее активности. Определите тип ингибирования и все возможные кинетические характеристики процесса, исходя из данных таблицы. [E]0 = 10,0*10-6 моль/л.
|
[S]0, моль/л |
r0, усл. ед. |
|
|
[I] = 0,10*10-4 моль/л |
[I] = 0,30*10-4 моль/л |
|
|
10,00*10-4 |
4,00 |
2,38 |
|
2,50*10-4 |
3,18 |
1,85 |
|
0,91*10-4 |
2,16 |
1,24 |
|
0,50*10-4 |
1,49 |
0,87 |
Задача 18. Установлено, что α-кетоглутарат является ингибитором реакции окисления N-метил-L-глутамата. Определите тип ингибирования и все возможные кинетические характеристики процесса исходя из данных таблицы. [E]0=6*10-2 мг/мл.
|
[S]0, моль/л |
r0, моль/л*мин |
|
|
[I] = 0 |
[I] = 6*10-4, моль/л |
|
|
1,00*10-4 |
1,67*10-6 |
1,43*10-6 |
|
0,625*10-4 |
1,43*10-6 |
1,18*10-6 |
|
0,417*10-4 |
1,25*10-6 |
|
|
0,330*10-4 |
|
0,83*10-6 |