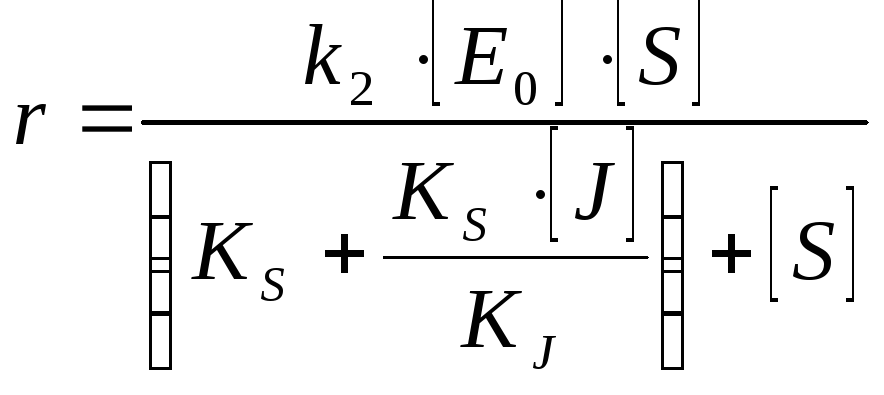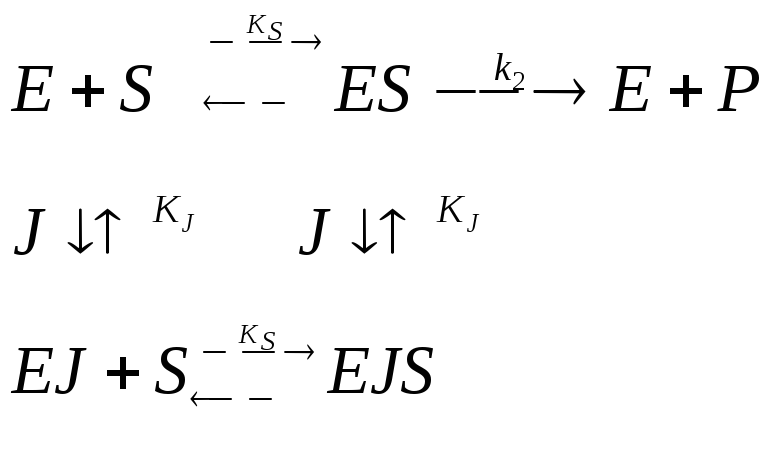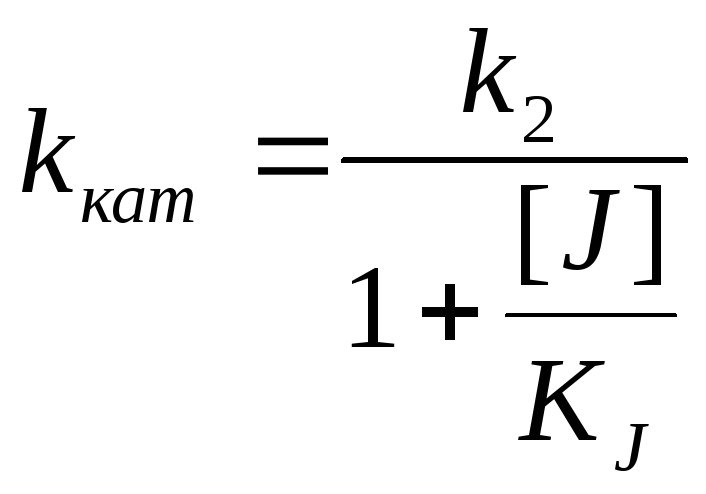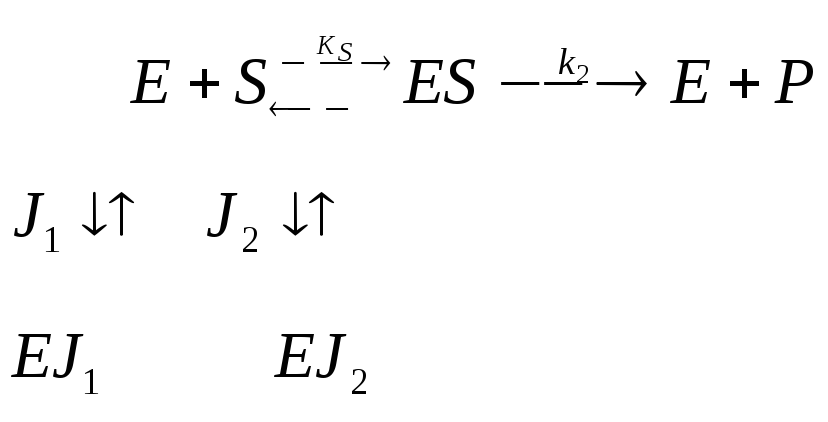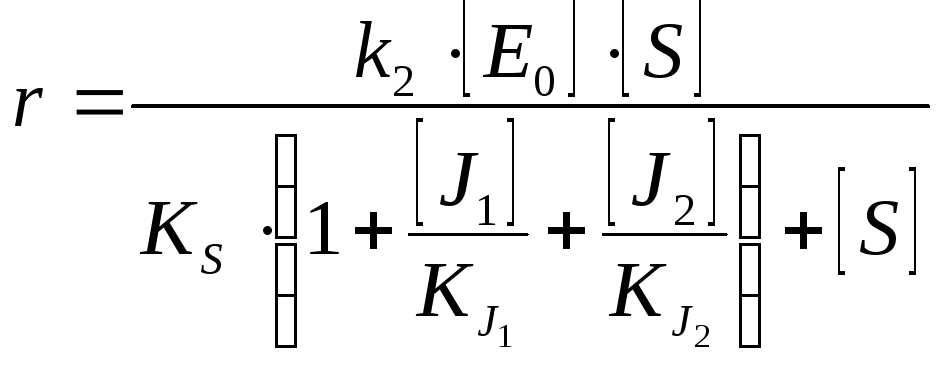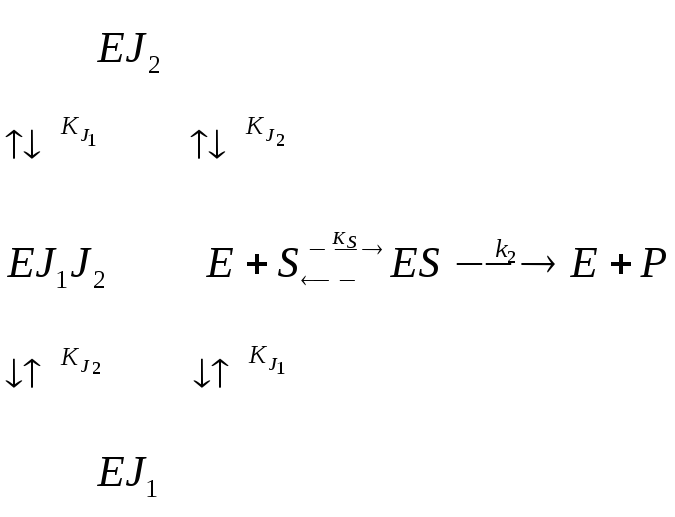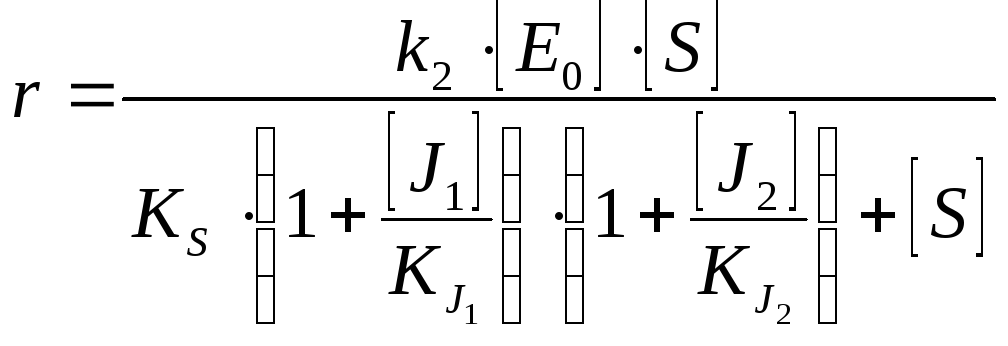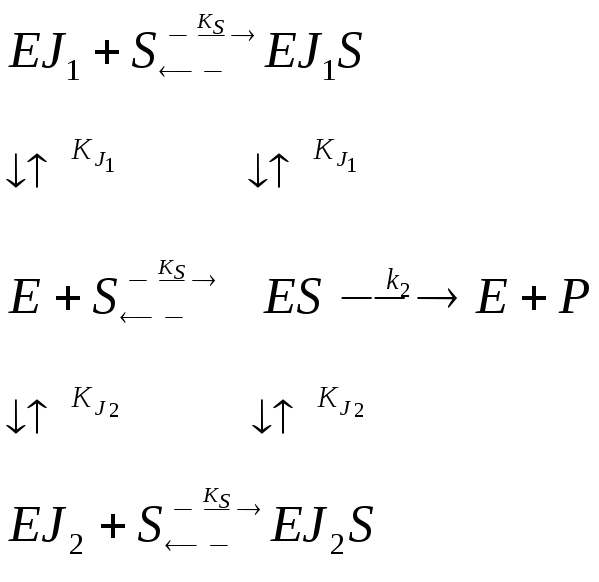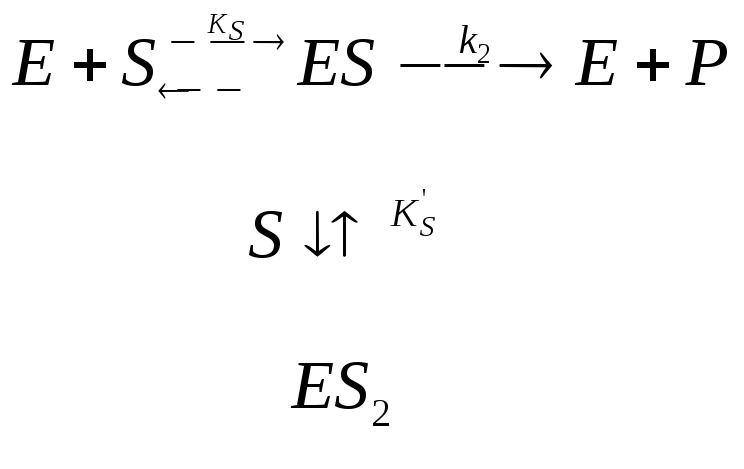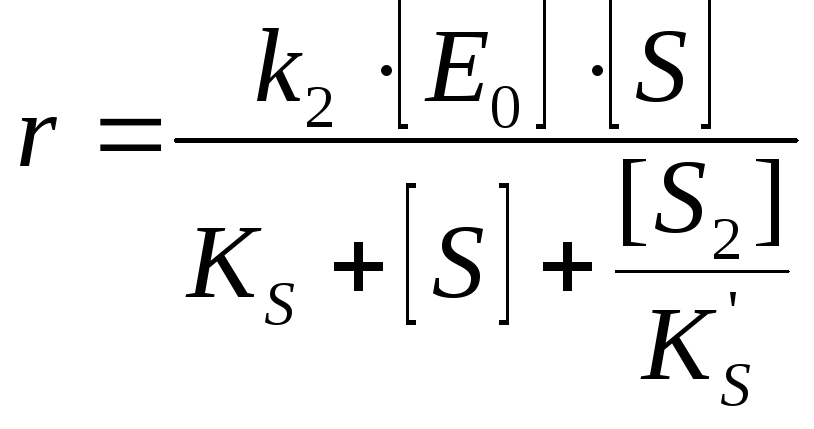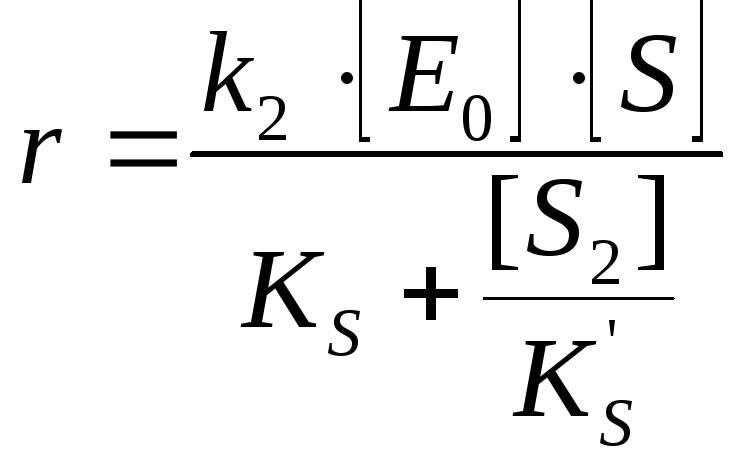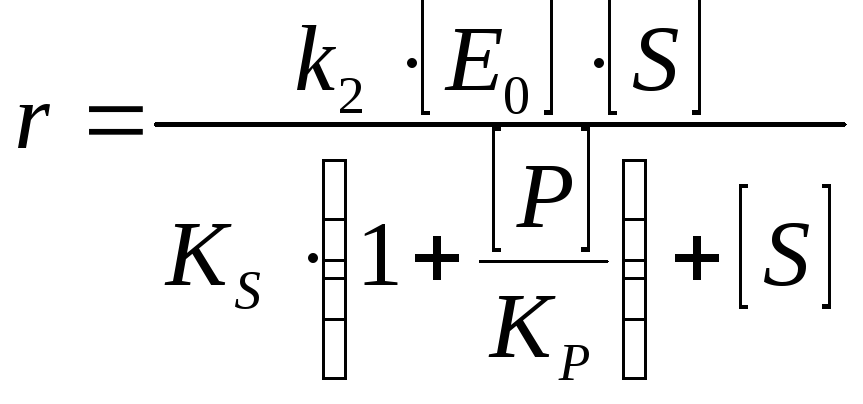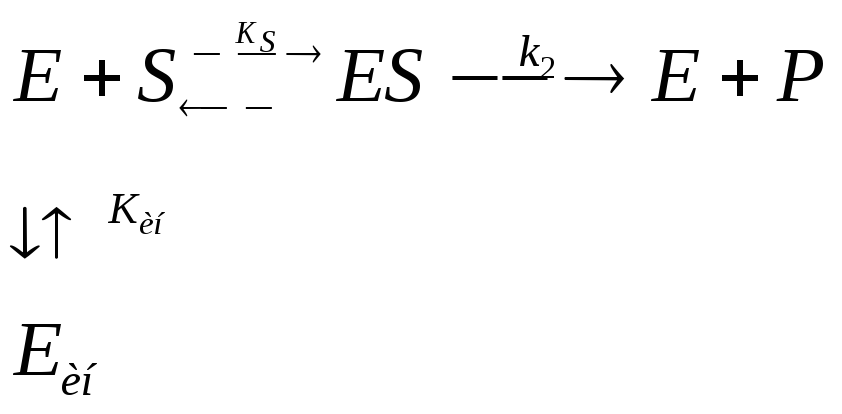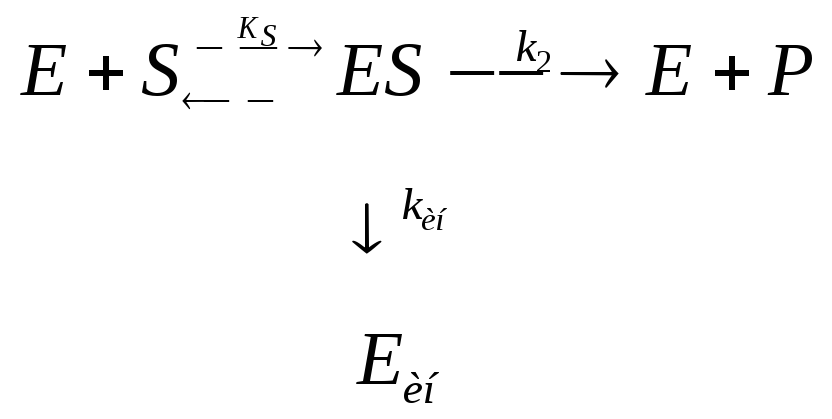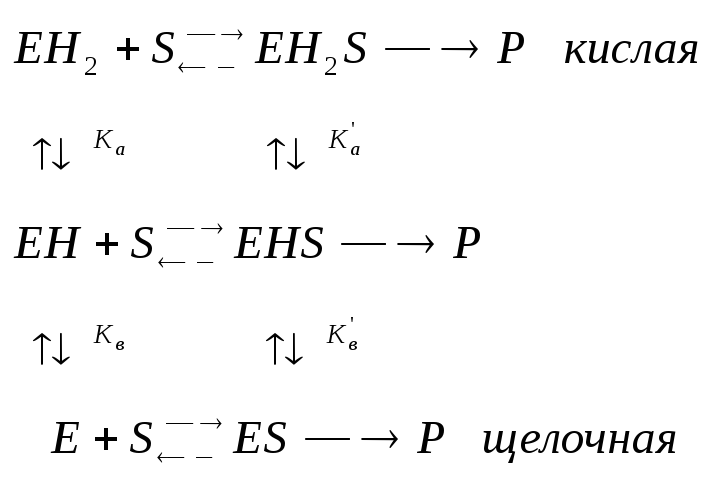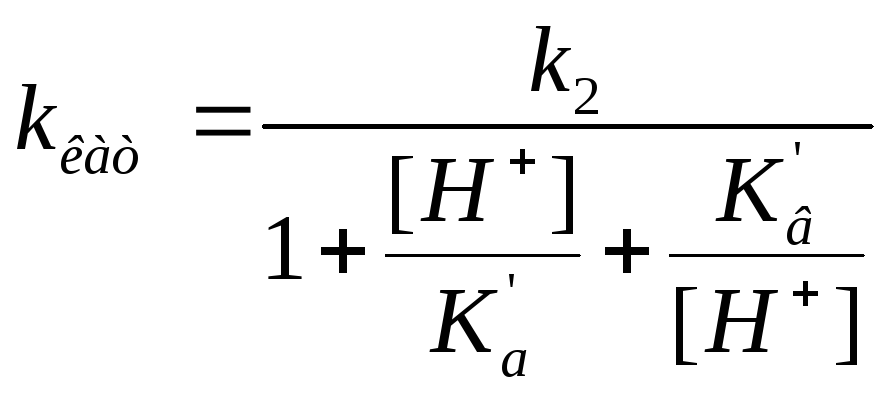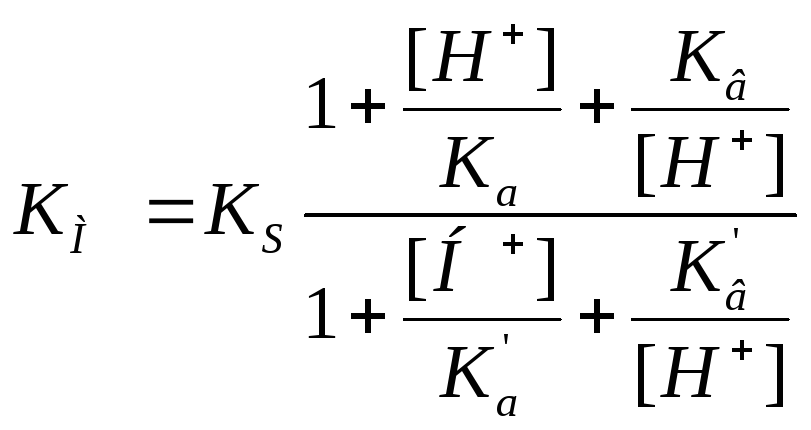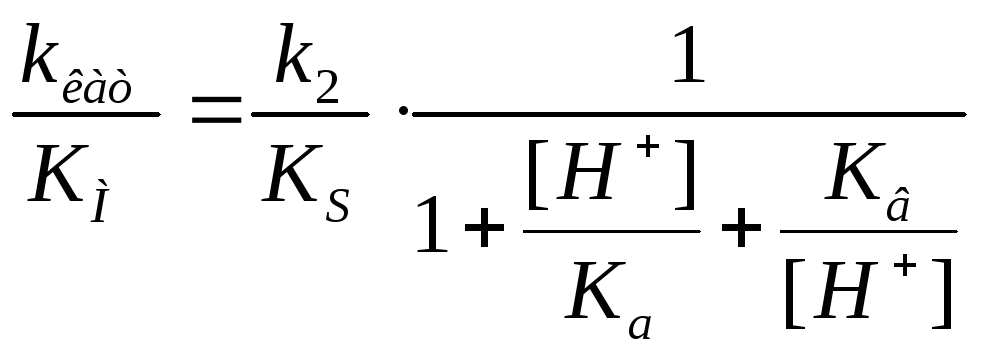Методичка БФХ / 33часть
.docФерментативная кинетика и катализ
Ферменты.
Изучение ферментов представляет особый интерес, так как эта область знания находится на стыке биологических и физических наук. С одной стороны, ферменты имеют исключительное значение в биологии. Жизнь зависит от сложной совокупности химических реакций, осуществляемых специфическими ферментами, и любое изменение действия ферментов может повлечь за собой серьёзные последствия для живого организма. С другой стороны, ферменты как катализаторы всё больше и больше привлекают внимание физиков и химиков. Изучение механизма действия ферментов представляет собой одну из самых увлекательных областей современного научного исследования.
Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ преимущественно белковой природы. Молекулярная масса даже самых маленьких ферментов составляет десятки тысяч дальтон (Да), а у многих – сотни тысяч дальтон. Одна из причин, по которой ферменты так велики, заключается в том, что длинная цепь (или цепи), из которой они состоят, должна свернуться с образованием некоего кармана, называемого активным центром. Попадая в такой карман, молекула вещества с исключительной точностью атакуется функциональными группами фермента. Под «атакой» здесь следует понимать химическое превращение вещества, которое принято называть субстратом, при участии данного фермента.
Современная классификация ферментов предполагает их разделение на шесть основных классов (оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы), по типу катализируемой реакции. В соответствии с этим, разработана номенклатура, где для каждого фермента установлен код, состоящий из четырёх чисел. Первое число означает, к какому из шести классов относится фермент; второе указывает подкласс (как правило, природу донора); третье – подподкласс (как правило, природу акцептора); четвёртое число – это порядковый номер фермента в его подподклассе.
Однако существует и другая классификация ферментов основанная на их химическом составе. Она предполагает их разделение на простые и сложные. Первые целиком представлены полипептидными цепями и при гидролизе полностью распадаются на аминокислоты. Вторые (холоферменты) – помимо белковой части, называемой апоферментом, включают небелковый компонент (простетическую группу): коферменты (низкомолекулярные органические соединения, входящие в состав активного центра фермента, некоторые из них выполняют функцию переноса функциональных групп или электронов) или/и кофакторы (ионы металлов, стабилизирующие пространственную конформацию ферментов).
Ферменты используются живыми организмами для осуществления с высокой скоростью многих взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Каждый биохимический процесс, как и любая химическая реакция, характеризуется энергией активации, то есть свободной энергией, которую нужно предать реагирующим молекулам, что бы произошло химическое превращение. Таким образом, энергия активации – это энергетический барьер, который нужно преодолеть, что бы произошла реакция.
В процессе химических реакций, катализируемых как ферментами, так и неорганическими катализаторами, молекулы вступают в так называемое переходное состояние, характеризующиеся менее устойчивой структурой и наибольшей свободной энергии. Катализаторы снижают свободную энергию переходного состояния и, стабилизируя его, облегчают протекание реакции.
Определение ферментов как веществ, снижающие энергию активации, не точно. В настоящее время установлено, что ферменты вступают во взаимодействие с веществами с образованием фермент-субстратного комплекса и направляют реакцию по новому пути с более низкой энергией активации, аналогично протекают химические процессы с участием неорганических катализаторов.
Следует отметить, что ферменты имеют общие свойства с небиологическими катализаторами:
-
ферменты не входят в состав конечных продуктов реакции и выходят из неё, как правило, в первоначальном виде, то есть они не расходуются в процессе катализа (следует отметить, что для некоторых ферментов в настоящее время установлено возможность модификации и даже распад после осуществления превращения субстрата в продукт);
-
ферменты не могут реализовать протекание тех реакции, которые противоречат законам термодинамики, то есть ферменты осуществляют катализ только энергетически возможных процессов, при этом совокупная энергия системы в ходе реакции не изменяется;
-
ферменты не изменяют направление реакции и не смешают положение равновесие, а лишь ускоряют его достижение.
Однако у ферментов есть и специфические свойства:
-
ферменты обладаю значительно большей эффективностью в сравнении с небиологическими катализаторами (скорость протекания реакции с участием ферментов выше на несколько порядков);
-
биохимические процессы, протекающие с участием ферментов, в отличие от химических реакций, регулируемы, путём изменения каталитической активности ферментов;
-
ферментативные реакции в большинстве своём протекают при условиях близких к физиологическим в то время как для эффективного катализа реакции с участием неорганических катализаторов, необходимо создание жёстких специфических условий (высокие температуры, давления и прочие);
-
ферментативный катализ не подчиняется закону действующих масс;
-
ферменты обладают высокой специфичностью, как по отношению к субстрату, так и к типу катализируемой реакции. При этом можно выделить ферменты обладающие относительной (групповой), абсолютной и стериоспецифичностью.
Уникальные свойства ферментов обусловлены особенной структурой активного центра фермента и конформационной и электростатической комплементарностью между молекулами субстрата и фермента.
Согласно современному представлению о механизме взаимодействия фермента с субстратом, в соответствии с теорией индуцированного соответствия, активный центр фермента достаточно гибок и может изменять свою конформацию при связывании с молекулой субстрата. У активного центра фермента принято выделять две основные функции: образование связей между молекулами фермента и субстрата и осуществление непосредственно самого превращения субстрата в продукт. Иногда даже говорят о двух различных активных центрах фермента – адсорбционном и каталитическом.
Природа связей между ферментом и субстратом в фермент субстратном комплексе зависит от наличия в молекуле субстрата функциональных групп различного типа. При наличии в молекуле субстрата заряженных групп (например, у аминокислот) связывание их с ферментами происходит преимущественно за счёт электростатических сил.
При отсутствии заряженных групп у гидрофильных (полярных) субстратов (например, сахаров) взаимодействие должно быть обусловлено водородными связями. В случаи не заряженных гидрофобных (неполярных) субстратов (например, содержащие углеводородные цепи) взаимодействие должно быть обусловлено гидрофобными (вандерваальсовыми) силами.
Кинетическое описание ферментативных процессов.
Основная идея о принципах биокатализа возникла ещё в начале прошлого века благодаря трудам Брауна и Анри и позднее была развита Михаэлисом и Ментен, которые в 1913 г. создали общую теорию действия ферментов и ферментативной кинетики. Идея заключается в том, что в механизм каталитического действия фермента состоит в общем случае в образовании между ферментом и субстратом промежуточных соединений, претерпевающих в ходе реакции последовательных превращений вплоть до образования конечных продуктов и регенерации фермента. Действительно, в простейшем случае превращение субстрата в продукт может быть представлено следующей схемой:
![]() (1),
(1),
где E – фермент; S – субстрат; ES – промежуточный фермент-субстратный комплекс; ЕР – промежуточный комплекс фермент-продукт; P – продукт; k1; k-1; k2; k-2; k3; k-3– константы скорости элементарных реакции в уравнении.
Теория Михаэлиса-Ментен предполагает наличие ряда ограничений (постулатов):
-
фермент и субстрат за счёт сил физической природы образуют промежуточное соединение – фермент-субстратный комплекс;
-
с активным центром фермента связывается только одна молекула субстрата;
-
реакция катализа не обратима (процесс рассматривается в начальный момент времени, когда концентрация продукта очень низка, при этом реакция идёт при очень большом избытке субстрата: [S] >> [E]; [S] >> [P]), стадией десорбции продукта из комплекса фермент-продукт можно пренебречь;
-
самой медленной является стадия превращения субстрата в продукт (непосредственно реакция катализа): k2 << k1; k2<< k-1;
-
при анализе кинетических характеристик ферментных реакций можно пользоваться концентрациями, а не активностями вследствие разбавленности растворов.
С учётом указанных допущений и в соответствии с принципом стационарности (принципом Боденштейна) простейшая кинетическая схема может быть представлена в следующем виде:
![]()
При этом концентрация промежуточного продукта поддерживается постоянной, то есть фермент-субстратный комплекс, всё время находится в равновесии с исходными веществами. В этом случае под KS подразумевают константу равновесия первой стадии, относя её, однако, не к образованию, а к распаду фермент-субстратного комплекса:
![]() (2)
(2)
Скорость ферментативного превращения субстрата равна скорости образования продукта, то есть скорости второй стадии, если концентрация субстрата много больше концентрации фермента, что обычно наблюдается на практике.
![]() (4),
(4),
[S]0 ≈ [S] Изменение концентрации [S] можно пренебречь, концентрация [ES] будет лимитироваться концентрацией [E].
В ходе реакции, если нет посторонних эффектов, будет соблюдаться равенство:
![]() (5),
(5),
где [E]0 – концентрация фермента в начальный момент времени.
поскольку фермент, первоначально внесённый в реакционную массу, будет присутствовать в ней либо в свободном виде, либо в виде комплекса с субстратом.
Из уравнения (2):
![]() (6)
(6)
![]()
![]() ,
подставляя в (6)
,
подставляя в (6)
![]()
![]()
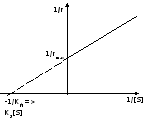
Интегральная форма равнения.
![]() ,
,
![]()
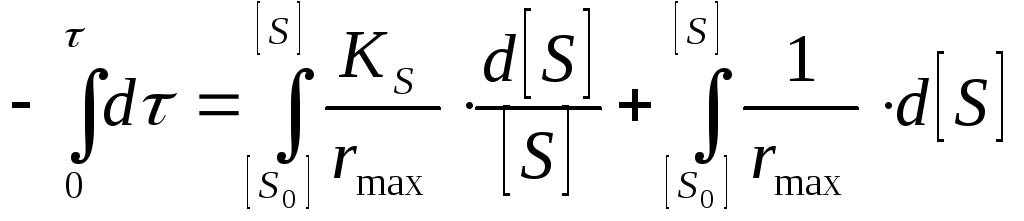
![]()
![]()

|
|
схема |
Основные формулы |
Графическое решение |
|
Ингибирование |
|
|
|
|
Однокомпонентное ингибирование |
|
|
|
|
|
|
|
|
|
Полностью конкуретное ингибирование (поражение адсорбционного центра) |
|
|
|
|
Анализ в координатах Диксона
|
|||
|
Полностью неконкуретное ингибирование [S] >> [E] J поражает каталитический центр или изменяет конформацию |
|
|
|
|
Координаты Диксона
|
|||
|
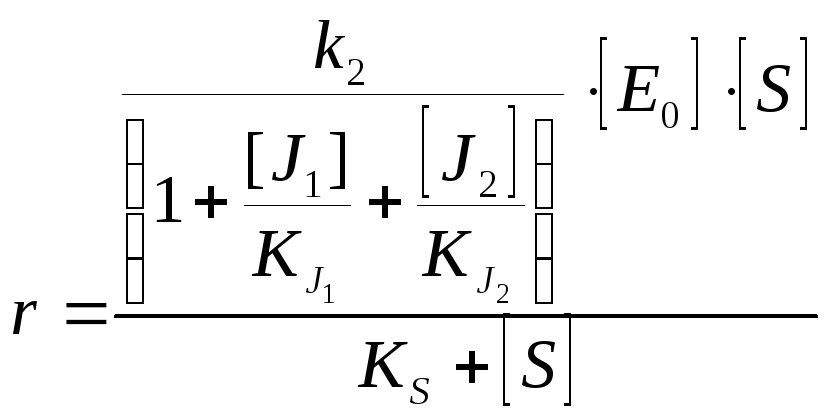
Двухкомпонентное ингибирование |
|
|
|
|
Взаимозависимое полностью конкурентное |
|
|
|
|
Взаимозависимое полностью конкурентное |
|
|
|
|
Взаимозависимое полностью неконкуретное |
|
|
|
|
Ингибирование субстратом |
|
Если низкие
концентрации [S]:
Если высокие концентрации [S]:
|
|
|
Ингибирование продуктом Продукт ингибирует фермент по полностью конкурентному типу |
|
|
|
|
Обратная изомеризация фермента (переход в неактивную форму) |
|
[S] высокая
[S] низкая
|
|
|
Необратимая инактивация фермента |
|
kин – константа скорости
|
|
|
|
|
|
|
|
Влияние кислотности среды на кинетику ферментных реакций Может поражать адсорбционный центр, может поражать каталитический центр, но при этом может образовывать продукт |
|
|
|
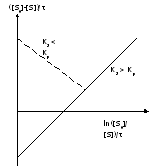
Виды координат в кинетике М-М
-
r=f([S]0)

-
Метод Мигуэла Марина и Тимари
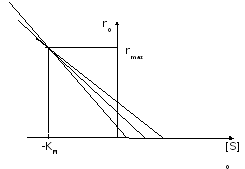
-
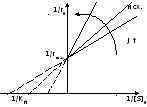
координаты Лайнуивера – Берка
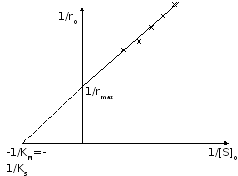
-
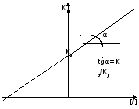
Метод Иди-Хофсти
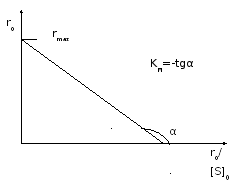
-
координаты Диксона
r0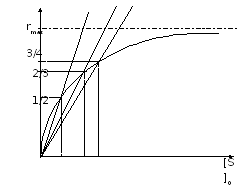
Задача 1.
Определите значения кинетических параметров (методом де Мигуэл Марино и Тамари) гидролиза метилового эфира N-ацетил-L-валина, катализируемого α-химотрипсином, исходя из данных таблицы. [E]0=3,8*10-5 моль/л
-
[S]0, моль/л
r0, моль/л·с
0,200
4,57·10-6
0,124
3,83·10-6
0,091
3,33·10-6
0,071
2,97·10-6
0,060
2,67·10-6
Задача 2.
Определите значения кинетических параметров (методом Иди-Хофсти) гидролиза бутирилхолина, катализируемого холинэстеразой исходя из данных таблицы. [E]0=5,0·10-6 моль/л
|
[S]0, моль/л |
r0, усл.ед. |
|
10,00·10-4 |
5,55 |
|
2,50·10-4 |
4,45 |
|
0,91·10-4 |
2,94 |
|
0,50·10-4 |
2,09 |
Задача 3.
Определите значения кинетических параметров (методом Иди-Хофсти) гидролиза метилового эфира N-бензоил-L-аминомасляной кислоты, исходя из данных таблицы. [E]0=2,16·10-6 моль/л.
-
[S]0, моль/л
r0, моль/л·с
2,24·10-3
4,25·10-7
1,49·10-3
3,52·10-7
1,12·10-3
3,10·10-7
0,90·10-3
2,71·10-7
0,75·10-3
2,45·10-7
Задача 4. Исходя из данных таблицы определите кинетические параметры (методом де Мигуэл Марино и Тамари) гидролиза N-ацетил-L-норвалина, катализируемого α-химотрипсином. [E]0=2,62·10-7 моль/л.
-
[S]0, моль/л
r0, моль/л·с
4,00·10-2
9,70·10-7
2,00·10-2
7,77·10-7
1,33·10-2
6,51·10-7
1,00·10-2
5,50·10-7
0,80·10-2
4,80·10-7
Задача 5.
Исходя из данных таблицы определите кинетические параметры (методом де Мигуэл Марино и Тамари) гидролиза бактериальных клеток, катализируемого лизоцимом. [E]0=5,72·10-8 моль/л.
|
[S]0, мг/мл |
r0, ед.опт.пл./с |
|
6,53·10-2 |
1020·10-6 |
|
8,40·10-2 |
1110·10-6 |
|
11,2·10-2 |
1180·10-6 |
|
15,5·10-2 |
1310·10-6 |
Задача 6.
Определите значения кинетических параметров (методом Иди-Хофсти) гидролиза этилового эфира N-транс-циннамоил-L-тирозина исходя из данных таблицы. [E]0=3,1·10-9 моль/л.
-
[S]0, моль/л
r0, моль/л·с
0,36·10-3
1,94·10-7
0,18·10-3
1,84·10-7
0,12·10-3
1,75·10-7
0,090·10-3
1,67·10-7
0,072·10-3
1,59·10-7
Задача 7.
Определите КМ и rmax (методом Иди-Хофсти) для процесса со следующими кинетическими характеристиками:
|
[S]0, моль/л |
r0, моль/л·мин |
|
0,002 |
0,045 |
|
0,020 |
0,285 |
|
0,060 |
0,460 |
|
0,100 |
0,505 |
Задача 8.
Определите КМ и rmax (методом методом де Мигуэл Марино и Тамари) для реакции восстановления пирувата, если известно, что:
|
[S]0, моль/л |
r0, моль/л·мин |
|
20,0·10-6 |
3,15·10-6 |
|
29,0·10-6 |
3,70·10-6 |
|
40,0·10-6 |
4,10·10-6 |
|
50,0·10-6 |
4,39·10-6 |
Задача 9.
Определите КМ и rmax (методом Иди-Хофсти) для реакции гидролиза бактериальных клеток, катализируемой лизоцимом, если известно, что:
|
[S]0, мг/мл |
r0, ед.опт.пл./с |
|
1,17·10-2 |
380·10-6 |
|
1,87·10-2 |
516·10-6 |
|
3,73·10-2 |
800·10-6 |
|
7,46·10-2 |
1100·10-6 |