
- •Биокинетика
- •Глава 1. Введение в биокинетику
- •Предмет изучения биокинетики
- •Химическая кинетика как основа биокинетики
- •1.2.1. Современные представления о механизме химической реакции
- •1.2.2. Скорость химической реакции
- •1.2.3. Константа равновесия
- •1.2.4. Выражения для константы скорости элементарной химической реакции
- •1.2.5. Влияние pH на скорость химической реакции
- •1.2.6. Кинетический эксперимент
- •Глава 2. Ферментативный катализ
- •2.1. Кинетические схемы и механизм ферментативной реакции
- •2.1.1. Схема Михаэлиса-Ментен
- •2.1.2. Определение параметров Wm и Km из экспериментальных данных
- •2.1.3. Метод графов при анализе кинетических схем
- •2.1.4. Определение концентрации активных центров
- •2.2. Типичные зависимости начальной стационарной скорости реакции от концентрации субстрата
- •2.2.1. Ингибирование и активация избытком субстрата
- •2.2.2. Аллостерические эффекты
- •2.3. Многосубстратные реакции
- •2.4.2. Релаксационная кинетика
- •2.5. Влияние температуры и pH на скорость ферментативных реакций
- •2.6. Ингибирование ферментативных реакций
- •2.7. Инактивация ферментов
- •2.8. Полиферментные системы. Сопряженные ферментные реакции
- •2.9. Кинетика действия ферментов в открытых системах
- •3.1.1. Химическое строение рецепторов и лигандов
- •3.1.2. Агонисты и антагонисты
- •3.2.3. Строение и функционирование g-белок сопряженных рецепторов
- •3.2.4. Механизмы внутриклеточного проведения и усиления рецепторного сигнала
- •3.2.5. Инактивация рецепторного сигнала
- •3.3.1. Диффузия рецепторов
- •3.3.2. Связываение нескольких молекул лиганда с одним рецептором
- •1) Координаты Хилла.
- •2) Координаты Бьеррума.
- •3.4. Взаимодействие нескольких лигандов с одним рецептором
- •3.5. Учет функции распределения клеток по количеству рецепторов на мембране
- •3.6. Феномен колебаний рецепторного связывания
- •Глава 4. Клеточный рост
- •4.1. Клеточный цикл
- •4.2. Экспоненциальная фаза роста
- •4.2.1. Многосубстратные процессы
- •4.2.2. Ингибирование и активация клеточного роста
- •4.2.3. Влияние pH
- •4.4.1. Выражение для удельной скорости клеточного роста в экспоненциальной фазе
- •4.4.2. Многостадийность клеточного цикла
- •5.1. Пассивный транспорт
- •5.2. Активный ионный транспорт
- •Глава 6. Эндоцитоз
Биокинетика
(краткий конспект лекций)
составил к.ф.-м.н. А. В. Чернышев.
(http://cyto.kinetics.nsc.ru/biomed/staff.html)
Глава 1. Введение в биокинетику
Предмет изучения биокинетики
Развитие биологической кинетики (биокинетики) связано с постановкой следующих вопросов.
Что определяет протекание биологических процессов во времени?
Каковы пути и возможности ускорения биохимических реакций?
Какая стадия определяет скорость того или иного биологического явления?
Какие события на молекулярном уровне задают динамику развития в целом?
…
Исследование количественных закономерностейразвития биологических процессов во времени на молекулярном уровне составляетпредметбиокинетики.
Биокинетика – наука, изучающая на молекулярном уровне закономерности развития биологических процессов в системах in vitro, живых органах и тканях, клеточных популяциях.
Химическая кинетика как основа биокинетики
В биокинетике количественное описание биологических процесов на молекулярном уровне основано на базовых законах химической кинетики.
1.2.1. Современные представления о механизме химической реакции
Чтобы произошла
химическая реакция, необходимо, чтобы
энергия взаимодействующих молекул была
больше энергии
активации
![]() (Аррениус, 1889).
(Аррениус, 1889).
На рис. 1.1 приведены различные типы химических реакций.
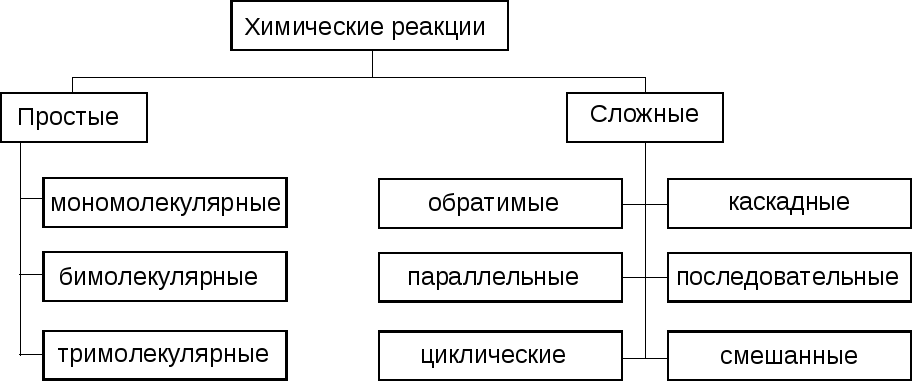
Рис. 1.1. Типы химических реакций.
Некоторые простые (элементарные) химические реакции:
![]() (бимолекулярная)
(бимолекулярная)
![]() (мономолекулярная,
изомеризация)
(мономолекулярная,
изомеризация)
![]() (мономолекулярная,
диссоциация)
(мономолекулярная,
диссоциация)
1.2.2. Скорость химической реакции
Для элементарной (простой) химической реакции, которая представлена стехиометрическим уравнением
![]() (1.1)
(1.1)
определяется скорость реакции:
![]() (1.2)
(1.2)
и выполняется закон действующих масс:
![]() (1.3)
(1.3)
где k – константа скорости химической реакции. Универсальный метод определения порядка и константы скорости химической реакции в эксперименте:
![]() (1.4)
(1.4)
Для расчета кинетики сложной реакции, механизм которой составлен из простых реакций, используется принцип независимости элементарных стадий:
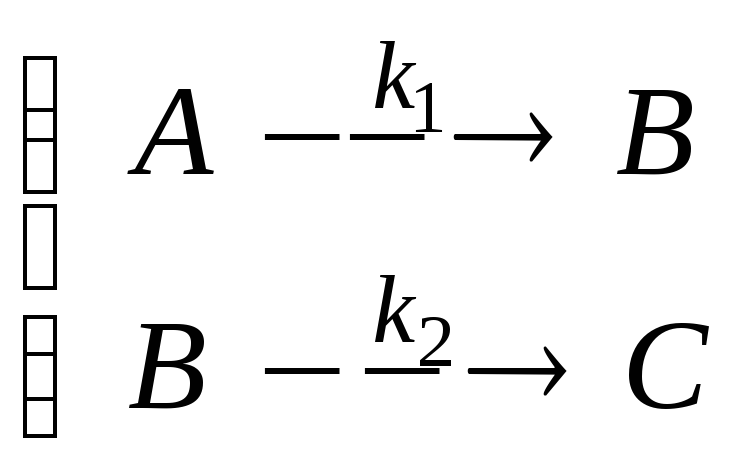 (1.5)
(1.5)
 (1.6)
(1.6)
1.2.3. Константа равновесия
В принципе, любая элементарная реакция обратима:
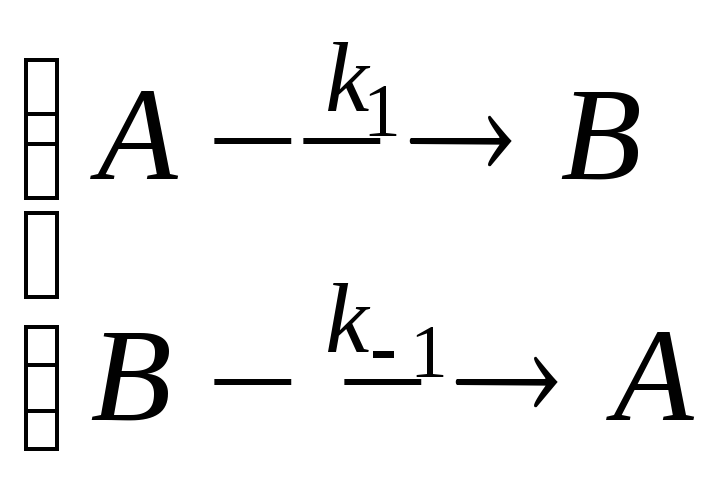 (1.7)
(1.7)
В равновесии
![]() (1.8)
(1.8)
![]() (1.9)
(1.9)
где K называется константой равновесия.
1.2.4. Выражения для константы скорости элементарной химической реакции
Зависимость константы скорости от температуры (Аррениус):
![]() (1.10)
(1.10)
где
![]() - константа Больцмана. В общем случае,
предэкспонент в (1.10) зависит от температуры:
- константа Больцмана. В общем случае,
предэкспонент в (1.10) зависит от температуры:
![]()
Теория
активированного (переходного)
комплексапозволяет рассчитать![]() :
:
![]() (1.11)
(1.11)
где:
![]() -
трансмиссионный множитель (обычно
-
трансмиссионный множитель (обычно![]() );
);![]() - постоянная Планка;
- постоянная Планка;![]() ,
,![]() ,
,![]() -
изменение энергии Гиббса, энтропии и
энтальпии (соответственно) при переходе
от реагентов к активированному
(переходному) комплексу.
-
изменение энергии Гиббса, энтропии и
энтальпии (соответственно) при переходе
от реагентов к активированному
(переходному) комплексу.
1.2.5. Влияние pH на скорость химической реакции
Возможные схемы:
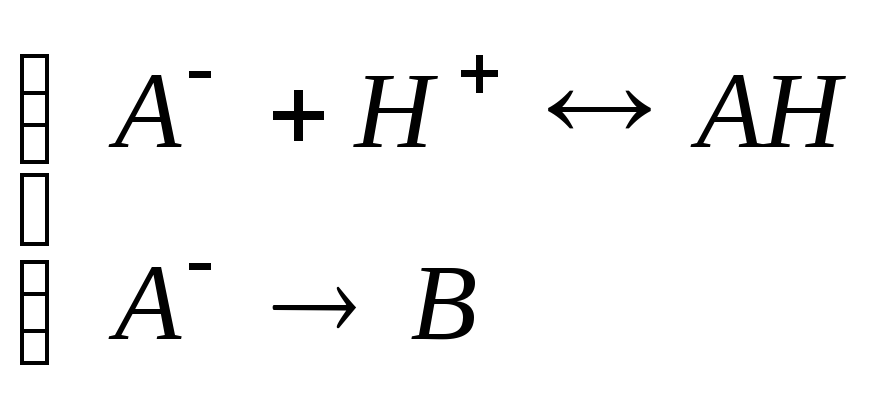 (1.12a)
(1.12a)
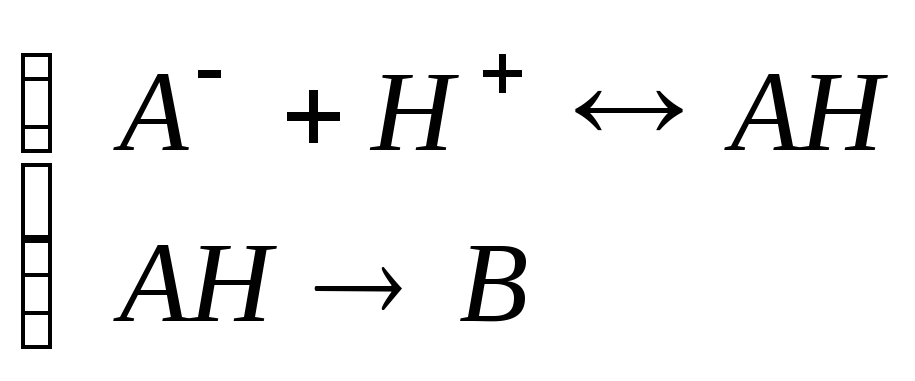 (1.12b)
(1.12b)
 (1.12c)
(1.12c)
При фиксированном
значении pHскорость
реакций (1.12a-c)
можно описывать через эффективную
константу скорости![]() :
:
![]()
Типичные зависимости kэфф(pH) для схем (1.12a-c) представлены на рис. 1.2.
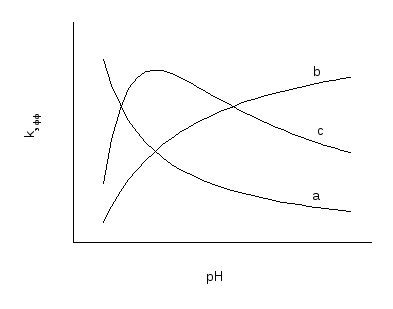
Рис. 1.2.Наиболее типичныеpH-зависимости эффективной константы скорости реакции.
