
razdel_belki_fermenty_nov
.docxРазделы: Химия белков. Ферменты.
1. При осаждение белков высаливанием происходит:
а) присоединение других молекул
б) денатурация макромолекул
в) дегидратация макромолекул +
г) потеря нативных свойств
2. Какие вещества в растворе выявляет биуретовая реакция?
а) гетерополисахариды
б) фосфолипиды
в) белки +
г) нуклеиновые кислоты
3. Какая последовательность соответствует представленному пептиду?

a) Цис-Ала-Асп
б) Глу-Гли-Тир +
в) Глу-Цис-Гли
г) Вал-Гли-Фен
4. Присутствие любого белка в растворе можно определить с помощью реакции:
а) биуретовой +
б) ксантопротеиновой
в) нингидриновой
г) с фенилизотиоцианатом
5. Пептид, на С-конце которого находится иминокислота:
а) вал-иле-сер-тре
б) цис-ала-про-тир
в) про-гис-гли-три
г) иле-три-сер-про +
6. Пептид, на N-конце которого находится диаминомонокарбоновая кислота:
а) тре-ала-лиз-про
б) лиз-сер-гис-глн +
в) асн-вал-иле-арг
г) глу-лей-тре-лиз
7. Для количественного определения аминокислот в растворе используют:
а) биуретовый метод
б) реакцию Фоля
в) реакцию Сакагути
г) реакцию с нингидрином +
8. Водородными связями между атомами пептидного остова стабилизируется:
а) первичная структура
б) вторичная структура +
в) третичная структура
г) четвертичная структура
9. Порядок чередования аминокислот, соединенных пептидной связью, это:
а) первичная структура +
б) вторичная структура
в) третичная структура
г) четвертичная структура
10. Генетически детерминирована:
а) первичная структура +
б) вторичная структура
в) третичная структура
г) четвертичная структура
11. Какое из отмеченных свойств характерно для денатурированных белков:
а) наличие водородных связей
б) наличие пептидных связей +
в) наличие вторичной и третичной структуры
г) хорошая растворимость в воде
12. Как называют структуру белка, представляющую совместное расположение нескольких полипептидных цепей, связанных нековалентными связями?
а) первичная структура
б) вторичная структура
в) третичная структура
г) четвертичная структура +
13. Что такое изоэлектрическая точка белка (ИЭТ)?
а) значение температуры замерзания воды в гидратной оболочке
б) значение рН, равное оптимуму рН для действия белка-фермента
в) значение температуры, оптимальное для действия ферментов
г) значение рН, при котором суммарный заряд белковой молекулы равен нулю +
14. К какому электроду будут мигрировать белки сыворотки крови при электрофорезе в сильно щелочной среде?
а) зависит от величины заряда
б) кислые белки — к аноду, основные — к катоду
в) к аноду +
г) кислые белки — к катоду, основные — к аноду
д) к катоду
15. Какая аминокислота содержит гетероцикл?
а) гистидин +
б) глицин
в) глутамин
г) тирозин
16. В каком направлении будут перемещаться белки сыворотки крови при электрофорезе при рН=8.6
а) к катоду
б) к аноду +
в) остаются на старте
г) зависит от величины заряда
17. Какие вещества необходимы для высаливания белков:
а) щелочноземельные металлы +
б) сахароза
в) кислоты
г) тяжелые металлы
18. Какой метод можно использовать для очистки раствора белка от низкомолекулярных примесей:
а) высаливание
б) ультрацентрифугирование
в) электрофорез
г) диализ +
19. Какая из перечисленных аминокислот является диаминокарбоновой кислотой?
а) лейцин
б) лизин +
в) серин
г) глицин
20. На каких свойствах белков основан метод аффинной хроматографии:
а) амфотерности
б) способности к ионизации
в) величине молекулярной массы
г) специфическом взаимодействии с лигандами +
21. Конформация полипептидной цепи, стабилизируемая связями между радикалами аминокислот, является:
а) первичной структурой
б) вторичной структурой
в) третичной структурой +
г) четвертичной структурой
22. Пространственное расположение и характер взаимодействия пептидных цепей в олигомерном белке характеризует:
а) первичную структуру
б) вторичную структуру
в) третичную структуру
г) четвертичную структуру +
23. Радикалы аминокислот взаимодействуют при образовании:
а) первичной структуры
б) вторичной структуры
в) третичной структуры +
24. К аминокислоте с гидрофобным радикалом относится:
а) лейцин +
б) аспарагиновая кислота
в) лизин
г) аргинин
25. Для каких белков преобладающей является бета-структура полипептидной цепи:
а) гемоглобин
б) фиброин шелка +
в) миоглобин
г) сывороточный альбумин
26. Как называется дополнительная группа фермента^ прочно связанная с его белковой частью:
а) кофактор
б) кофермент
в) апофермент
г) простетическая группа +
27. При какой температуре ферменты денатурируют:
а) 0 °С
б) 80-100 °С +
в) 20-30 °С
г) 30-40 °С
28. Какая изоформа лактатдегидрогеназы локализована преимущественно в сердце:
а) ЛДГ1 +
б) ЛДГ3
в) ЛДГ4
г) ЛДГ5
29. Какое свойство присуще как неорганическим катализаторам, так и ферментам:
а) не сдвигают подвижного равновесия +
б) высокая специфичность
в) регулируемость количества и активности
г) физиологические условия протекания
30. К какому классу относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием АТФ:
а) лиазы
б) лигазы +
в) оксидоредуктазы
г) трансферазы
31. Какая температура является оптимальной для действия большинства ферментов:
а) 50-60 °С
б) 15-20 °С
в) 80-100 °С
г) 35-40 °С +
32. Чем выше константа Михаэлиса, тем сродство фермента к субстрату:
а) выше
б) ниже +
в) остается неизменным
33. Как называется участок молекулы фермента, ответственный одновременно и за присоединение вещества, подвергающегося ферментативному действию, и за осуществление ферментативного катализа:
а) каталитический центр
б) активный центр +
в) адсорбционный центр
г) аллостерический центр
34. При каком рН большинство ферментов проявляют максимальную активность:
а) кислом, рН=1.5-2.0
б) щелочном, рН=8.0-9.0
в) близком к нейтральному +
г) только при рН=7,0
35. Как ферменты влияют на энергию активации:
а) увеличивают
б) уменьшают +
в) не изменяют
36. К какому классу относятся ферменты, катализирующие внутримолекулярный перенос группы:
а) оксидоредуктазы
б) лиазы
в) изомеразы +
г) трансферазы
37. Какое значение рН является оптимальным для пепсина:
а) 1-2 +
б) 3-5
в) 5-7
г) близкое к нейтральному
38. Сродство фермента к субстрату характеризует:
а) константа седиментации
б) константа Михаэлиса +
в) константа равновесия
39. Для ферментов, обладающих абсолютной специфичностью, характерно:
а) превращение одного единственного субстрата +
б) превращение группы субстратов с одинаковым типом связей
в) превращение стереоизомеров одного типа
40. Линейная зависимость скорости реакции от концентрации фермента достигается при:
а) недостатке субстрата
б) равном количестве субстрата и фермента
в) избытке субстрата +
41. Пептид, плохо растворимый в воде:
а) глу-цис-лиз
б) глн-асп-фен
в) арг-сер-про
г) мет-ала-лей +
42. Пептид, лучше других растворимый в воде при рН 7,0:
а) асп-тре-лиз +
б) асн-мет-фен
в) про-сер-ала
г) цис-гли-три
43. Для наиболее грубого удаления балластных белков чаще используют:
а) электрофорез
б) ионообменную хроматографию
в) высаливание +
г) гель-фильтрацию
44. Наиболее специфичным методом выделения белков является:
а) гель-фильтрация
б) высаливание
в) ультрацентрифугирование
г) аффинная хроматография +
45. Ферменты ускоряют реакции, так как:
а) изменяют свободную энергию активацию
б) ингибируют обратную реакцию
в) изменяют константу равновесия реакции
г) уменьшают энергию активации +
46. Количественное измерение ферментов основано на зависимости скорости реакции от:
а) температуры
б) концентрации субстрата
в) величины рН
г) концентрации фермента +
47. Фермент пепсин используется в медицине для:
а) обработки гнойных ран
б) предотвращения тромбообразования
в) улучшения пищеварения +
г) рассасывания рубцов
48. Специфичность ферментов может быть:
а) обратимой
б) относительной +
в) временной
г) необратимой
49. Аллостерический центр фермента представляет собой:
а) участок молекулы, ионизирующий субстрат
б) участок молекулы, обеспечивающий присоединение субстрата
в) участок молекулы, с которым связываются низкомолекулярные вещества, отличающиеся по строению от субстратов и обладающие регуляторной функцией +
г) небелковая часть фермента
50. При постоянной концентрации фермента скорость реакции с увеличением количества субстрата:
а) уменьшается
б) увеличивается
в) не изменяется
г) увеличивается, затем остается постоянной +
51. Ферменты, катализирующие расщепление внутримолекулярных связей при участии воды, называются:
а) лигазы
б) лиазы
в) гидролазы +
г) оксидоредуктазы
52. Мультиферментные комплексы состоят из:
а) нескольких ферментов, катализирующих превращение двух субстратов
б) нескольких ферментов, катализирующих превращения одного субстрата в нескольких реакциях +
в) нескольких ферментов, катализирующих превращения одного субстрата в одной реакции
г) нескольких ферментов, катализирующих превращение трех субстратов в одной реакции
53. Ингибиторами ферментов являются вещества:
а) повышающие скорость ферментативных реакций
б) вызывающие денатурацию ферментов
в) снижающие скорость ферментативных реакций +
г) снижающие растворимость ферментов
54. Мономерные (однокомпонентные) ферменты являются:
а) протеинами +
б) протеидами
в) липопротеинами
г) гликопротеинами
55. Ферменты, катализирующие реакции образования сложных веществ из более простых:
а) лиазы
б) гидролазы
в) лигазы +
г) синтетазы
56. Изоферменты – это множественные формы ферментов, которые:
а) катализируют разные реакции
б) не различаются по физико-химическим
свойствам
в) катализируют одну и ту же реакцию +
г) имеют одну и ту же структуру
57. Кофактор ферментов может быть представлен:
а) белками
б) ионами металлов +
в) протеидами
58. Ингибирование бывает:
а) специфическое
б) обратимое +
в) классическое
г) неспецифическое
59. Согласно классификации ферменты делят на:
а) пять классов
б) девять классов
в) шесть классов +
г) четыре класса
60. Ферменты отличаются от неорганических катализаторов тем, что:
а) активны при любой температуре
б) проявляют более низкую каталитическую активность
в) расходуются в реакции
г) термолабильны +
61. Конкурентным ингибитором фермента, превращающего янтарную кислоту в фумаровую, является:
а) пировиноградная кислота
б) малоновая кислота +
в) молочная кислота
г) яблочная кислота
62. Ферменты, катализирующие реакции межмолекулярного переноса атомов или групп атомов:
а) изомеразы
б) трансферазы +
в) гидролазы
г) лиазы
63. Абсолютная специфичность – это способность фермента катализировать:
а) превращение веществ с одним типом химической связи
б) превращение стереомеров
в) превращение только одного субстрата +
г) превращение только двух субстратов
64. В основу классификации ферментов положен:
а) характер связей
б) тип катализируемой реакции +
в) тип субстрата
г) механизм действия фермента
65. Ферменты, катализирующие реакции разрыва связей или реакции отщепления различных групп от субстратов без участия воды с образованием двойной связи или присоединения по двойной связи:
а) лигазы
б) изомеразы
в) лиазы +
г) гидролазы
66. Ферментами являются соединения:
а) имеющие сходное химическое строение
б) проявляющие одинаковые физические свойства
в) белковой природы, обеспечивающие протекание химических реакций +
г) небелковой природы, ускоряющие реакции
67. Ферменты, катализирующие окислительно-восстановительные реакции:
а) лиазы
б) гидролазы
в) оксидоредуктазы +
г) лигазы
68. Выберите неправильный ответ. Скорость ферментативных реакций зависит от:
а) концентрации субстрата
б) концентрации фермента
в) молекулярной массы фермента +
г) температуры
69. Апофермент – это:
а) небелковая часть
б) белковая часть +
в) простетическая группа
70. Скорость ферментативной реакции в оптимальных условиях зависит от:
а) концентрации субстрата +
б) концентрации кофактора
в) растворимости
г) специфичности
71. Ферменты из класса трансфераз катализируют:
а) реакции гидролиза
б) реакции внутримолекулярного переноса атомов или групп атомов
в) реакции изомеризации
г) реакции межмолекулярного переноса атомов или
групп атомов +
72. Ингибирование называется необратимым, если изменения:
а) нестойкие
б) стойкие +
в) повышают активность фермента
г) вызывают сходные по строению вещества
73. Действие высокой температуры на каталитическую активность проявляется в:
а) замедлении реакции вследствие уменьшения гидрофильности белка-фермента
б) инактивации фермента +
в) активации субстрата
г) снижении эффективной концентрации фермента
74. Амфотерность фермента подтверждает:
а) белковую природу +
б) углеводную природу
в) липидную природу
г) нуклеотидную природу
75. Холофермент – это:
а) белковая часть молекулы фермента
б) небелковая часть молекулы фермента
в) сложный фермент, включающий белковую и небелковую части +
г) фермент, прочно связанный с субстратом
76. Большинство ферментативных реакций протекает при рН:
а) 2,5 – 8,5
б) 6,5 – 7,5 +
в) 4,5 – 7,0
г) 8,0 – 9,0
77. Вещества, замедляющие ход ферментативных реакций, называются:
а) ингибиторы +
б) активаторы
в) катализаторы
г) денатураторы
78. Участок молекулы фермента, к которому присоединяется вещество, способное вызвать изменение ее конфигурации, называется:
а) каталитическим центром
б) аллостерическим центром +
в) простетической группой
г) активным центром
79. При увеличении количества фермента в условиях избытка субстрата скорость ферментативной реакции:
а) уменьшается
б) увеличивается +
в) не изменяется
г) увеличивается, затем остается постоянной
80. Вещество занимает место в аллостерическом центре и ингибирует фермент. Это:
а) конкурентное обратимое ингибирование
б) неконкурентное обратимое ингибирование +
в) необратимое ингибирование
г) активирование ферментативных реакций
81. Действие высокой температуры на ферментативную реакцию проявляется в следующем:
а) в замедлении реакции, т.к. уменьшается гидрофильность белка-фермента
б) фермент инактивируется в результате денатурации +
в) активирует субстрат, вследствие чего повышается скорость реакции
г) не оказывает существенного влияния
82. Незаменимой аминокислотой для человека является:
а) фенилаланин +
б) тирозин
в) цистеин
г) серин
83. К серосодержащим аминокислотам относится:
а) метионин +
б) лизин
в) валин
г) аргинин
84. Положительным зарядом в радикальной части обладает аминокислота:
а) аспарагин
б) глутамин
в) лизин +
г) глутамат
85. Изоэлектрическая точка белка зависит от:
а) наличия гидратной оболочки
б) суммарного заряда молекулы +
в) наличия водородных связей
г) наличия спиральных участков в молекуле
86. Олигомерные белки:
а) проходят через полупроницаемую мембрану
б) не содержат -спиральных участков
в) состоят из нескольких полипептидных цепей +
г) не обладают четвертичной структурой
87. Незаменимая для человека аминокислота:
а) лизин +
б) цистеин
в) аспарагин
г) глутамин
88. Сульфгидрильную группу (тиогруппу) содержит аминокислота:
а) аспарагин
б) гистидин
в) цистеин +
г) метионин
89. Денатурация белка всегда сопровождается:
а) нарушением третичной структуры белка +
б) гидролизом пептидных связей
в) появлением окраски
г) образованием функциональных комплексов с другими белками
90. Незаменимая для человека аминокислота:
а) лейцин +
б) аланин
в) пролин
г) аспарагин
91. Фолдинг белка – это:
а) формирование первичной структуры
б) модификация аминокислотных остатков
в) формирование третичной структуры +
г) транспорт в митохондрии
92. Аминокислота с положительным зарядом в радикале:
а) гистидин +
б) валин
в) аргинин
г) изолейцин
93. Аминокислота с отрицательным зарядом в радикале:
а) лейцин
б) гистидин
в) глутамат +
г) аргинин
94. Наиболее прочные связи в молекуле белка:
а) пептидные +
б) водородные
в) ионные
г) гидрофобные
95. Ковалентные связи в молекуле белка:
а) дисульфидные +
б) водородные
в) ионные
г) гидрофобные
96. Один катал – это:
а) количество фермента, катализирующее образование 1 моль продукта в секунду при стандартных условиях +
б) количество молекул субстрата, превращающихся на 1 молекуле фермента за 1 секунду
в) число единиц активности фермента, приходящееся на 1 мг белка в препарате фермента
г) количество фермента, вызывающее превращение 1 мкмоль субстрата в минуту при стандартных условиях
97. С активным центром фермента не связывается:
а) субстрат
б) продукт
в) конкурентный ингибитор
г) аллостерический эффектор +
98. Общее количество субъединиц в лактатдегидрогеназе:
а) две
б) три
в) четыре +
г) шесть
99. Активировать апофермент может:
а) субстрат
б) аллостерический активатор
в) продукт реакции
г) кофермент +
100. Одна международная единица ферментативной активности – это:
а) количество фермента, катализирующее образование 1 моль продукта в секунду
при стандартных условиях
б) количество молекул субстрата, превращающихся на 1 молекуле фермента за 1 секунду
в) число единиц активности фермента, приходящееся на 1 мг белка в препарате фермента
г) количество фермента, вызывающее превращение 1 мкмоль субстрата в минуту при стандартных условиях +
101. Назовите трипептид:
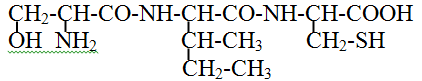
а) серил-изолейцил-цистеин +
б) треонил-лейцил-метионин
в) тирозил-валил-метионин
г) серил-лейцил-цистеин
102. Назовите трипептид:
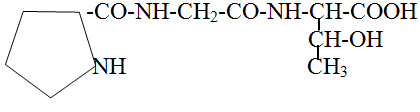
а) гистидил-глицил-серин
б) пролил-глицил-треонин +
в) фенилаланил-аланил-серин
г) триптофил-глицил-аланин
103. Назовите трипептид:
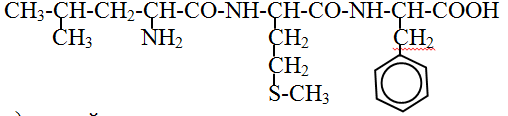
а) изолейцил-цистеил-тирозин
б) лейцил-метионил-фенилаланин +
в) лейцил-валил-гистидин
г) валил-метионил-пролин
104. Назовите трипептид:
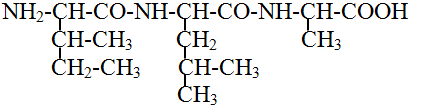
а) лейцил-изолейцил-аланин
б) лейцил-валил-треонин
в) изолейцил-лейцил-аланин +
г) цистеил-валил-аланин
105. Назовите трипептид:
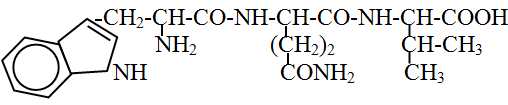
а) триптофил-глутамил-валин +
б) тирозил-аспарагил-лейцин
в) фенилаланил-глутамил-лейцин
г) триптофил-аспарагил-аланин
106. Назовите трипептид:
![]()
а) лизил-глутамил-аланин
б) аргинил-аспарагил-валин
в) лизил-треонил-лейцин
г) аргинил-лизил-валин +
107. Назовите трипептид:
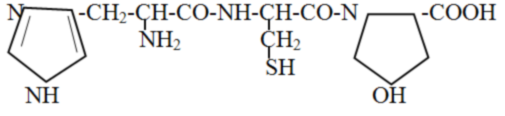
а) гистидил-цистеил-гидроксипролин +
б) пролил-метионил-тирозин
в) триптофил-цистеил-фенилаланин
г) гистидил-серил-тирозин
108. Назовите трипептид:
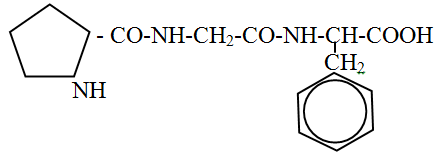
а) гидроксипролил-аланил-тирозин
б) гистидил-глицил-тирозин
в) пролил-глицил-фенилаланин +
г) гистидил-аланил-фенилаланин
109. Назовите трипептид:
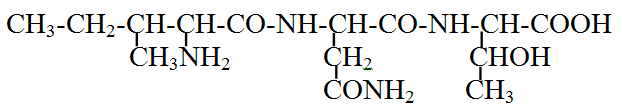
а) изолейцил-аспарагил-треонин +
б) лейцил-глутамил-валин
в) валил-глутамил-аланин
г) изолейцил-лизил-треонин
110. Назовите трипептид:
а) лизил-фенилаланил-лейцин
б) серил-тирозил-изолейцин
в) серил-триптофил-лейцин +
г) треонил-триптофил-лейцин
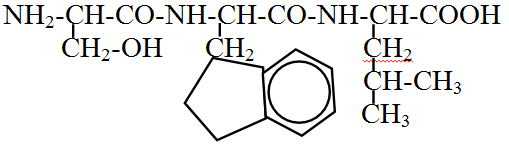
111. Назовите трипептид:
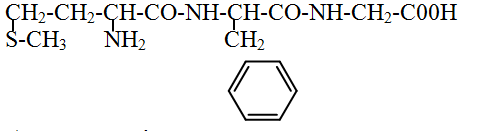
а) метионил-фенилаланил-глицин +
б) цистеил-тирозил-аланин
в) метионил-тирозил-глицин
г) аланил-фенилаланил-серин
112. Назовите аминокислоту:
![]()
а) лейцин
б) изолейцин +
в) валин
г) аланин
113. Назовите аминокислоту:
![]()
а) лейцин +
б) изолейцин
в) валин
г) аланин
114. Назовите аминокислоту:
![]()
а) глицин +
б) аланин
в) серин
г) цистеин
115. Назовите аминокислоту:
![]()
