
- •Титриметрический метод определения общей щелочности и карбонатной жесткости воды
- •3.1 Титриметрический анализ. Основные понятия
- •3.2 Растворы, применяемые в титриметирическом анализе
- •3.3 Классификация методов титриметрического анализа Методы титриметрического анализа классифицируются по типу химической реакции, лежащей в основе определяемого вещества.
- •3.5 Индикаторы в кислотно-основном титровании
- •Характеристики перехода кислотно-основных индикаторов
- •Приготовление растворов индикаторов. Метиловый оранжевый (0,1% в воде): 0,01 г красителя растворяют в 10 мл воды; применяют в количестве 3-4 капель на 25 мл титруемого раствора.
- •3.6 Техника титрования
- •3.8 Выполнение работы
- •Задание 3. Стандартизация (определение точной концентрации) раствора хлорводородной кислоты по навеске щелочи
- •3.9 Порядок оформления отчета
- •Задание 2. Стандартизация (определение точной концентрации) раствора щелочи по точному раствору хлорводородной кислоты
- •Задание 3. Стандартизация (определение точной концентрации) раствора хлорводородной кислоты по навеске щелочи
Лабораторная работа № 3
(образец)
Титриметрический метод определения общей щелочности и карбонатной жесткости воды
3.1 Титриметрический анализ. Основные понятия
Титриметрический анализ основан на точном измерении объема стандартного раствора реагента (титранта), израсходованного на реакцию с анализируемым веществом. Вещества реагируют между собой в эквивалентных количествах.
В титриметрическом анализе титрантами называют растворы, титр которых известен. Титром раствора называется концентрация растворенного вещества, выраженная в г/мл или мг/мл. Например, выражение «титр H2SO4 равен 0,0049 г/мл» означает, что каждый миллилитр данного раствора серной кислоты содержит 0,0049 г H2SO4. Титр обозначается буквой Т с указанием формулы вещества: ТH2SO4=0,0049 г/мл. Таким образом, титр – это способ выражения концентрации вещества.
При титровании используют два раствора:
рабочий раствор - раствор титранта с точно известной концентрацией, объем которого необходимо определить с помощью бюретки;
титруемый раствор – раствор анализируемого вещества с точно известным объемом, концентрацию которого необходимо определить.
Титрование – это процесс постепенного прибавления раствора титранта (T) к точно отмеренному объему анализируемого раствора вещества (A) до момента, когда оба вещества прореагируют друг с другом, то есть до момента достижения точки эквивалентности.
В точке эквивалентности количество прибавленного титранта эквивалентно количеству анализируемого вещества. При титровании необходимо точно установить момент наступления эквивалентности, т.е. фиксировать точку эквивалентности.
Расчеты результатов титрования основаны на принципе эквивалентности, согласно которому объемы растворов титранта и анализируемого вещества, количественно реагирующих между собой, обратно пропорциональны их концентрациям:
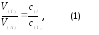
где V(T) и V(A) – объемы (л) и c(Т) и с(А)– молярные концентрации (моль/л) раствора титранта и анализируемого вещества соответственно.
Уравнение (1) составляет основу титриметрических определений. Для определения концентрации одного из растворов (или массы вещества в данном растворе) необходимо знать точно объемы реагирующих растворов, точную концентрацию другого раствора и установить момент, когда два вещества прореагируют в эквивалентных количествах.
3.2 Растворы, применяемые в титриметирическом анализе
Существует два способа получения растворов с точно известной концентрацией вещества, т.е. стандартных растворов. В зависимости от этого различают первичные стандартные растворы (приготовленные) и вторичные стандартные растворы (установленные).
Приготовление первичного стандартного раствора. Точную навеску, взятую на аналитических весах, растворяют в мерной колбе. В результате получают раствор, в котором точно известно количество вещества и объем раствора. Полученные растворы называют растворами с приготовленным титром. Титр раствора равен навеске вещества (г, мг), деленной на объем (мл). Чтобы перейти к молярной концентрации эквивалента, достаточно титр раствора умножить на 1000 и разделить на молекулярную массу.
Приготовление вторичного стандартного (стандартизированного) раствора. В этом случае нет необходимости брать точную навеску вещества. Вещество взвешивают на технохимических весах, растворяют в определенном объеме, и получают раствор вещества приблизительно нужной концентрации. Точную его концентрацию устанавливают титрованием с помощью раствора первичного стандарта. Полученные растворы называют растворами с установленным титром.
Стандартные растворы можно также приготовить с помощью фиксаналов (стандарт-титров). Фиксаналы предствляет собой запаянные стеклянные ампулы, содержащие количество вещества, необходимое для приготовления 1 л раствора. Промышленность выпускает фиксаналы с различными веществами, как в виде растворов (серная и хлорводородная кислоты, гидроксиды натрия и калия), так и сухие (перманганат калия, карбонат или оксалат натрия и др.). Для приготовления стандартного раствора из фиксанала, содержимое ампулы переносят в мерную колбу вместимостью 1 л. Для этого в каждой коробке с фиксаналами имеется стеклянный боек и стеклянная палочка. В горлышко колбы вставляют воронку и вкладывают стеклянный боек, о который разбивают дно ампулы. Затем стеклянной палочкой пробивают отверстие в верхней части ампулы и дают содержимому полностью вытечь или высыпаться в колбу, которую затем заполняют дистиллированной водой до метки.
