
1 семестр МП / РПК / Молекулярная физика / mppz_m3_of_tks_fizika1_231000.62
.doc
Методическое пособие
для практических (семинарских) занятий
по дисциплине «Физика 1. Механика. Термодинамика»
Модуль 1.3 Молекулярная физика. Термодинамика
Семинар 7. Первое начало термодинамики
План занятия
1. Краткое теоретическое введение
2. Разбор типовых задач ( №№ 2.25, 2.29, 2.30).
3. Самостоятельное решение задач (№№ 2.28).
4. Обсуждение самостоятельно решенных задач, включая домашнее задание
5. Краткое обобщение рассмотренных вопросов и подведение итогов
Основные определения и формулы
1. Уравнение состояния, идеальный газ, моль, молярная масса.
Состояние заданной
массы газа определяется значениями
трех макроскопических параметров:
давления
![]() объема
объема
![]() и температуры
и температуры
![]() В состоянии термодинамического равновесия
эти параметры находятся в функциональной
зависимости, которую можно выразить
уравнением
В состоянии термодинамического равновесия
эти параметры находятся в функциональной
зависимости, которую можно выразить
уравнением
![]() .
.
Это уравнение называют уравнением состояния. Для идеальных и реальных газов вид этой зависимости различен.
Под идеальным газом понимают газ, в котором расстояния между атомами или молекулами (в дальнейшем будем их называть частицами) настолько велики, что потенциальной энергией взаимодействия частиц между собой можно пренебречь. Кроме того, можно пренебречь и объемом, который занимают сами частицы, по сравнению с объемом сосуда в котором они находятся. Опытным путем было получено, что идеальные газы с хорошей точностью подчиняются уравнению
![]() .
.
Количество вещества,
в котором содержится число частиц,
равное числу атомов в 12 г изотопа углерода
![]() называется молем.
Число частиц, содержащееся в моле
вещества, называют числом Авогадро
называется молем.
Число частиц, содержащееся в моле
вещества, называют числом Авогадро
![]() ,
причем
,
причем
![]()
![]() ,
,
поэтому, определить число молей изучаемого газа или вещества, можно по формулам
![]() или
или
![]() ,
,
где
![]() – масса газа,
– масса газа,
![]() – его молярная масса.
– его молярная масса.
2. Уравнение Менделеева-Клапейрона, основное уравнение молекулярно-кинетической теории, парциальное давление, закон Дальтона, абсолютная термодинамическая шкала температур, абсолютный нуль.
Экспериментально
было установлено, что один моль любого
газа при нормальных условиях ( те. при
.давлении
![]() атм.
атм.
![]() Па
и температуре
Па
и температуре
![]() )
занимает объем
)
занимает объем
![]()
![]()
![]() –
закон Авогадро.
–
закон Авогадро.
Таким образом, если мы возьмем один моль любого идеального газ при произвольных условиях и приведем его к нормальным условиям, то в соответствии с уравнением состояния (2), можно записать
![]()
Величины
![]() и
и
![]() нам известны заранее, поэтому, подставляя
в это уравнение значения этих величин,
получим
нам известны заранее, поэтому, подставляя
в это уравнение значения этих величин,
получим
![]() ,
,
или
![]()
где
![]() – универсальная газовая постоянная.
– универсальная газовая постоянная.
Для произвольного числа молей последнее выражение можно записать в виде уравнения, называемого уравнением Менделеева-Клапейрона:
![]() .
.
3. Первое начало термодинамики.
Первое начало термодинамики формулируется следующим образом: количество тепла, сообщённое системе, идёт на увеличение её внутренней энергии и совершение системой работы, т.е.:
![]() .
.
Литература
Л-1, §§ 1.3- 1.9.
Л-3, №№ 2.25, 2.28-2.30.
Модуль 1.3 Молекулярная физика. Термодинамика
Семинар 8. Первое начало термодинамики (продолжение)
План занятия
1. Краткое теоретическое введение
2. Разбор типовых задач ( №№ 2.36, 2.37, 2.47).
3. Самостоятельное решение задач (№№ 2.38, 2.42).
4. Обсуждение самостоятельно решенных задач, включая домашнее задание
5. Краткое обобщение рассмотренных вопросов и подведение итогов
6. Контрольная работа № 1.3
Основные определения и формулы
1. Работа, внутренняя энергия, количество тепла.
При элементарном изменении объёма газа совершается работа:
![]() .
.
Внутренняя энергия может быть представлена как:
![]() ,
,
где
![]() – число молей вещества,
– число молей вещества,
![]() – молярная теплоёмкость при постоянном
объёме. Подчеркнём, что в отличие от
количества тепла Q
и работы А,
зависящих от процесса перехода системы
из одного состояния в другое, внутренняя
энергия является функцией состояния.
То есть,
– молярная теплоёмкость при постоянном
объёме. Подчеркнём, что в отличие от
количества тепла Q
и работы А,
зависящих от процесса перехода системы
из одного состояния в другое, внутренняя
энергия является функцией состояния.
То есть,
![]() и
и
![]() – это бесконечно малые величины, не
являющиеся полными дифференциалами, а
– это бесконечно малые величины, не
являющиеся полными дифференциалами, а
![]() – полный дифференциал. Практически
величина Q
может быть
рассчитана, если известна зависимость
теплоемкости тела от температуры
– полный дифференциал. Практически
величина Q
может быть
рассчитана, если известна зависимость
теплоемкости тела от температуры
![]() :
:
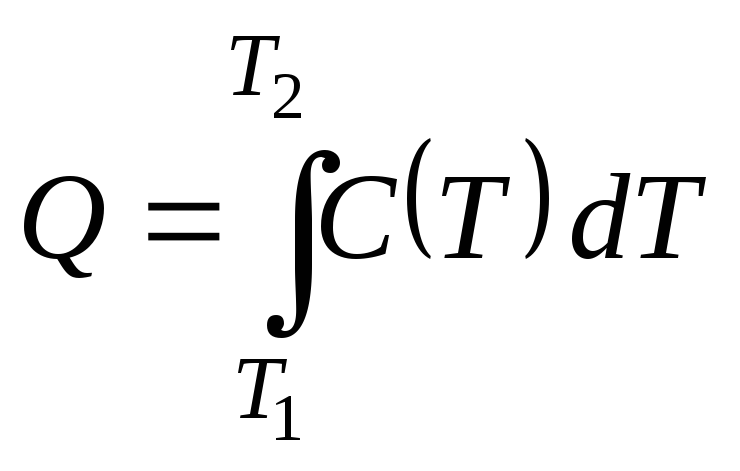 .
.
Величина А может быть рассчитана, если известна зависимость давления от объема:
 .
.
Согласно теореме
о равнораспределении энергии по степеням
свободы (на одну поступательную и
вращательную степень свободы приходится ![]() энергии, на одну колебательную степень
свободы –
энергии, на одну колебательную степень
свободы –
![]() энергии), внутренняя энергия идеального
газа:
энергии), внутренняя энергия идеального
газа:
![]() ,
,
где k
– постоянная Больцмана, R
– универсальная газовая постоянная,
![]() – число Авогадро,
– число Авогадро,![]() – число степеней свободы молекулы.
– число степеней свободы молекулы.
Для одноатомного
газа
![]() =3
(3 поступательные степени свободы).
=3
(3 поступательные степени свободы).
Обычно при не
слишком высоких температурах для
двухатомного газа
![]() =3+2=5
(3 поступательные степени свободы и 2
вращательные).
=3+2=5
(3 поступательные степени свободы и 2
вращательные).
Для многоатомного
газа, если колебательные степени
“заморожены”,
![]() =3+3=6
(3 поступательные степени свободы и 3
вращательные).
=3+3=6
(3 поступательные степени свободы и 3
вращательные).
Литература
Л-1, §§ 1.3- 1.9.
Л-3, №№ 2.36, 2.37, 2.38, 2.42, 2.47.
Контрольная работа № 1.3
Учебно-методические материалы
Основная литература
1. Савельев И. В. Курс общей физики, кн. 3. – М.: ООО «Издательство Астрель», ООО «Издательство АСТ», 2003, §§ 1.1- 1.9.
2. Иродов И. Е. Физика макросистем. Основные законы: Учебное пособие для вузов. – М.: Бином. Лаборатория знаний, 2004, §§ 1.1- 1.3, 1.5- 1.6.
3. И. Е. Иродов. Задачи по общей физике. – М.: ЗАО «Издательство БИНОМ», 2007.
Электронные версии учебников, учебных пособий, методических разработок, размещенные в коллекции информационных ресурсов МИЭТ: http://www.mocnit.miet.ru/oroks-miet/
4. Абрамов А.А., Ткачев В.А., Берестов А.Т., Моисеенко О.О., Погибельская Н.Б., Спиридонов А.Б., Фаттахдинов А.У. Механика. Молекулярная физика. [Электронный ресурс].-М.: Коллекция электронных ресурсов МИЭТ, 2007.- Режим доступа: http://srs.miet.ru
