
заболевания ЖКТ
.pdf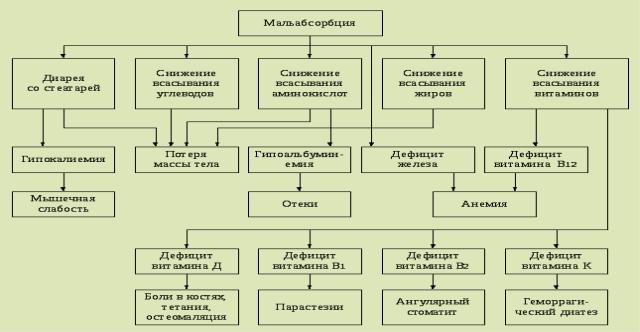
Синдром мальабсорбции
Синдром мальабсорбции — комплекс клинических симптомов, возникающих в результате нарушения всасывания (абсорбция) нутриентов в тонкой кишке, обусловленного нарушением внутриполостного и/или мембранного пищеварения, уменьшением функционирующей всасывательной поверхности или нарушением лимфоотока от слизистой оболочки тонкой кишки.
Этиология первичного (наследственного) синдрома: генетически обусловленные ферментопатии, отсутствие внутриклеточных переносчиков (дисахаров, триптофана — болезнь Хартнупа). Причинами вторичного (приобретенного) синдрома являются: энтериты; энтеропатии; опухоли тонкой кишки; резекция более 1 метра кишечника; отравления; алиментарная недостаточность питания; действие ионизирующего излучения; системные заболевания (амилоидоз, склеродермия, недостаточность кровообращения, эндокринопатия).
Патогенез:
Клиническая картина.
Диарея (кал пациентов с синдромом мальабсобции зловонный, объем фекалий увеличен, консистенция кала кашицеобразная или водянистая, стул может приобретать жирный блеск и становиться ахоличным, если у пациента нарушен синтез желчных кислот или затруднено их поступление в кишечник (при холестазе)).
Снижение массы тела (этот симптом вызван недостаточным поступлением в организм основных питательных веществ. У больных с синдромом мальабсорбции I степени тяжести масса тела уменьшается не более чем на 5–10 кг. У больных с синдромом мальабсорбции II степени – более чем на 10 кг (в 50% случаев). У больных с синдромом мальабсорбции при III степени у большинства пациентов дефицит массы тела может превышать 10 кг).
нарушение всех видов обмена (белкового, жирового, углеводного, минерального, витаминного, водно-электролитного) аналогично алиментарной дистрофии;
нарушение психики, периферической чувствительности;
поливитаминная недостаточность (сухость и шелушение кожных покровов, хейлит, глосситы, стоматиты. Могут появляться пигментные пятна на лице, шее, кистях, голенях
и стопах. Ногти становятся тусклыми, расслаиваются. Наблюдается истончение и выпадение волос).
В12 (фолиево)-дефицитная анемия, Fе–дефицитная;
кахектические отеки (гипопротеинемия);
гипотензия, нарушение сердечного ритма;
гипотермия;
нарушение функции всех органов эндокринной системы (полигландулярная эндокринопатия).
Диагностика. 1. Сбор анамнеза (заподозрить синдром мальабсорбции можно у пациентов с хронической диареей, снижением массы тела и анемией. Прежде всего необходимо установить наличие заболеваний, который могут приводить к синдрому мальабсорбции). 2. Лабораторные методы диагностики. 3. Исследования крови. 4. Исследования кала. 5. Инструментальные методы диагностики. 6. Дополнительные методы исследования.
Лечение.
Диетотерапия (назначается диета с высоким содержанием белка (до 130-150 г/сут)).
Проведение регидратационной терапии, коррекция электролитных нарушений.
Лечение сопутствующего дисбактериоза.
Медикаментозное лечение
o Коррекция поливитаминной недостаточности и дефицита минералов o Антибактериальная терапия
o Гормональная терапия
o Антисекреторные и противодиарейные препараты o Препараты холеретического действия
o Панкреатические ферменты
oАнтацидная терапия
Хирургическое лечение.
Недостаточность кишечных моно- и дисахаридаз
Кишечные энтеропатии - общее название не воспалительных хронических заболевании кишечника, развивающихся в результате ферментопатии (энзимопатии) или врожденных аномалий строения кишечной стенки.
Моносахаридазная недостаточность
Дисахариды, принятые с пищей и образующиеся при переваривании полисахаридов, расщепляются нормально, однако образующиеся глюкоза, галактоза, фруктоза не могут всасываться из-за нарушения их активного транспорта.
Наследственная непереносимость фруктозы, возникающая при генетически обусловленном дефекте фруктозо-1-фосфатальдолазы, не проявляется, пока ребёнок питается грудным молоком, т.е. пока пища не содержит фруктозы. Симптомы возникают, когда в рацион добавляют фрукты, соки, сахарозу. Рвота, боли в животе, диарея, гипогликемия и даже кома и судороги возникают через 30 мин после приёма пищи, содержащей фруктозу. У маленьких детей и подростков, продолжающих принимать фруктозу, развиваются хронические нарушения функций печени и почек. Непереносимость фруктозы - достаточно частая аутосомно-рецессивная форма патологии.
Галактоземия - редкое генетическое нарушение обмена веществ, при котором изменяется нормальный процесс метаболизма углеводов (сахаров) галактозы.
Галактоземия наследуется за аутосомно-рецессивным типом и возникает из-за дефицита активности фермента - галактозофосфат-уридилтрансферазы, отвечающего за усвоение организмом галактозы.
Клинические признаки заболевания возникают рано — через 1-2 недели после рождения ребенка. Пропадает аппетит, появляются вялость, рвота, понос. Наблюдается дефицит массы тела. Постепенно развивается гепато-, спленомегалия, появляется стойкая гипербилирубинемия, преимущественно за счет прямого билирубина. Часто отмечается катаракта, ведущая к слепоте. Могут быть симптомы, свидетельствующие о поражении почек (протеинурия, гипераминоацидурия), центральной нервной системы (задержка психофизического развития).
Единственным лечением при классической галактоземии является строгое воздержание от употребления галактозы и лактозы. Однако, даже при условии ранней диагностики и соблюдении диеты, со временем могут возникнуть следующие осложнения: нарушение речи, трудности при обучении, неврологические нарушения (например, тремор и т.д.)
Дисахаридазная недостаточность
Дисахаридазная недостаточность — синдром желудочно-кишечных расстройств, обусловленный нарушением расщепления (гидролиза) и всасывания дисахаридов (лактозы, сахарозы и др.) в тонкой кишке.
Этиология. Причиной дисахаридазной недостаточности является наследственная (первичная) или приобретенная (вторичная) недостаточность дисахаридаз — ферментов, обеспечивающих расщепление и всасывание различных дисахаридов в тонкой кишке. В зависимости от типа дисахаридаз различают недостаточность лактазы (проявляется непереносимостью лактозы), сахаразы (непереносимость сахарозы) и др.
Наследственная недостаточность лактазы передается по аутосомно-рецессивному типу, а сахаразы — по аутосомно-доминантному. При обретенные формы дисахаридазной недостаточность. развиваются как осложнение различных неинфекционных и инфекционных болезней кишечника; при этом снижается активность нескольких дисахаридаз, но активность лактазы — в большей степени. У недоношенных детей и новорожденных в первые дни жизни возможно развитие транзиторной непереносимости дисахаридов, обусловленной замедленным созреванием ферментативных систем.
Патогенез. В основе патогенеза дисахаридазной недостаточности лежит накопление нерасщепленных дисахаридов и продуктов их брожения в просвете кишечника и повышение в нем осмотического давления.
Вследствие этого происходит секреция электролитов и жидкости в просвете кишечника. Неабсорбированные углеводы способствуют размножению бактерий в верхнем отделе тонкой кишки. Бактериальная ферментация углеводов, продукция органических кислот и водорода и другие факторы усугубляют дисфункцию кишечника, нарушают всасывание, способствуют развитию пищевой аллергии.
Клиническая картина. Наследственная непереносимость лактозы проявляется частым водянистым пенистым стулом с кислым запахом после первого кормления грудным молоком. Отмечается метеоризм, постепенно нарастают симптомы обезвоживания
организма, уменьшается масса тела. Наблюдаются лактозурия, аминоацидурия, отставание в росте, недостаточность массы тела. Увеличение концентрации в крови лактозы, которая поступает через слизистую оболочку кишечника, оказывает токсическое действие. При благоприятном течении болезни функции кишечника компенсируются к 2—3 годам жизни, при тяжелом течении развивается синдром нарушенного кишечного всасывания с различными нарушениями обмена веществ и хроническим расстройством питания.
Более редкие разновидности дисахаридазной недостаточности — сахаразная и изомальтазная недостаточность проявляются при введении сахарозы (кормление подслащенным коровьим молоком, молочными смесями) частым водянистым стулом. При этом наряду с непереносимостью сахарозы имеется частичная непереносимость крахмала – как следствие снижения активности изомальтазы.
Диагностика. Основывается на данных анамнеза (непереносимость молока, пищевого сахара у родственников больного), биохимических исследований, нагрузочных проб с лактозой, сахарозой, крахмалом, глюкозой и D-ксилозой; обязательной фиксацией симптомов непереносимости — поноса, метеоризма, болей в животе: определении активности лактазы (сахаразы) в биоптате из слизистой оболочки тонкой кишки, рентгенологические исследования желудочно-кишечного тракта (с применением бария и соответствующего сахара.
Лечение. Основным компонентом его является диета, исключающая соответствующий сахар. При непереносимости сахарозы и изомальтозы вместо сахара вводят глюкозу и фруктозу, ограничивают продукты, содержащие крахмал; не следует разводить коровье молоко отварами; необходимо исключить молочные смеси с декстримальтозой и мукой.
При тяжелых формах лактазной недостаточности приходится полностью отказываться от кормления молоком. Детям дают сухие молочные безлактозные (низколактозные) смеси с солодовым экстрактом, мукой (рисовой, гречневой), низколактозное соевое, миндальное молоко; назначают препараты с иммобилизованным ферментом (керулак и др.). В более легких случаях ребенка переводят на молочнокислые продукты (кефир, йогурт, ацидофильная смесь), используют для кормления продукты, содержащие фруктозу.
Целиакия
Целиакия (глютеновая энтеропатия) – это заболевание кишечника, имеющее генетическую причину и характеризующееся непереносимостью белка глютена и хроническим воспалением слизистой оболочки тонкой кишки.
Этиология. Важное значение в развитии целиакии имеют генетические факторы. Тип передачи, вероятно, аутосомно-доминантный с неполной пенетрантностью.
Болезнь провоцируется употреблением в пищу глютен-содержащих продуктов из пшеницы, ржи, ячменя. Согласно недавним наблюдениям, эти пептиды играют ключевую роль в патогенезе целиакии. Для возникновения болезни, видимо, тpебуется два условия: генетическая предрасположенность и какой-либо провоцирующий фактор.
Патогенез. Глиадин вызывает атрофию слизистой оболочки тонкой кишки, следствием чего является синдром мальабсорбции, приводящий, в свою очередь, к развитию гипотрофии, рахитоподобного синдрома и многих других метаболических расстройств.
Востром периоде целиакии выявляются атрофические изменения слизистой оболочки
ввиде сглаженности и полного исчезновения ворсин, увеличения глубины крипт. Эпителиальный пласт уплощен, энтероциты приобретают кубическую форму, объем клеток уменьшается. В энтероцитах возрастает число лизосом и появляются крупные пищеварительные вакуоли. Значительно снижается высота микроворсинок вплоть до полного их исчезновения.
Клиническая картина. В настоящее время различают типичную, торпидную, стертую и латентную формы целиакии. 1. Типичная (классическая) — чаще развивается в раннем детстве с синдромом нарушенного всасывания II-й или III-й степени. 2. Торпидная — для нее характерны тяжелое течение, неэффективность обычного лечения. 3. Стертая форма — для нее характерны, в первую очередь, внекишечные проявления заболевания. При этом клинические признаки нарушения всасывания могут отсутствовать. 4. Латентная форма заболевания протекает субклинически, впервые выявляется во взрослом состоянии.
При типичной форме целиакии клиническая картина заболевания у ребенка появляется через 1-6 месяцев, а иногда скрытый период длится несколько лет. Ребенок останавливается
ввесе, появляются урчания, боли в животе, учащается стул. Стул становится светлым (серожелтым, желто-коричневым), часто обильным, с непереваренными частичками пищи, плохо отмывается от горшка, кожи ребенка. Аппетит у некоторых снижается до полного его отсутствия, у других повышается до обжорства. Отставание в росте чаще наблюдается у детей после трех лет.
Страдают все виды обмена, в первую очередь, белковый обмен. В результате выраженной гипопротеинемии и гипоальбуминемии развиваются безбелковые отеки. Нарушения всасывания липидов и углеводов сказываются на энергетическом метаболизме.
Формируется полигиповитаминоз. Иногда, при поражении только двенадцатиперстной кишки и проксимальной части тощей кишки, заболевание может проявляться лишь изолированным дефицитом железа или фолиевой кислоты (без желудочно-кишечных симптомов). Витаминная и минеральная недостаточность могут привести к остеомаляции и хондропатии.
Нарушение всасывания кальция и витамина D приводит к развитию остеопороза и формированию рахитоподобных деформаций костной системы. В группах больных целиакией могут быть представлены компрессия позвонков с бессимптомными переломами, кифосколиоз, межпозвонковые грыжи и другие признаки заболеваний костей и хрящей. Пептические язвы желудка могут быть еще одним проявлением целиакии.
Клинические симптомы, кроме перечисленных выше, включают отставание в психомоторном развитии, диарею с полифекалией (стул иногда напоминает пену), задержку роста, симптомы эндокринной недостаточности, апатию, мышечную атрофию, гипотонию, увеличение живота.
Боли в животе и частые расстройства стула (жидкий стул или запоры), тошнота, рвота, боли в костях, одышка вследствие фолатной или железодефицитной анемии, депрессия, утомляемость, потливость, мышечные судороги, носовые кровотечения считают обычными признаками болезни. Поврежденная слизистая оболочка перестает быть надежным барьером для всасывания вредных для организма соединений, и они проникают в кровь больного, вызывая интоксикацию (отравление).
Типичным проявлением при поражении нервной системы с чувствительностью к глютену является мозжечковая атаксия, часто сопровождающаяся поражением периферических нервов. Все симптомы могут исчезать с назначением соответствующей диеты.
Диагностика. Целиакию можно диагностировать на основании клинических данных, эндоскопического обследования, гистологического исследования, взятого из места поражения биоптата, и выявления атрофии слизистой оболочки тонкой кишки. Биопсия должна предоставить результаты, соответствующие картине целиакии, и должна сопровождаться благоприятным клиническим ответом на безглютеновую диету.
Разработаны методы иммуноферментного анализа, позволяющие выявлять высокоспецифичные для целиакии антитела класса G и А к эндомизию, глиадину, трансглутаминазе, pетикулину.
Лечение. Единственное на данный момент возможное лечение целиакии — полностью исключить все продукты, содержащие глютен. Безглютеновая диета поможет постепенно восстановить поврежденную часть кишечника, защитить его от нового повреждения и избавиться от тяжелых симптомов. Улучшение наступает с первых же дней применения диеты, а полноценно слизистая начинает работать через 3-6 месяцев у детей и почти через 2 года у взрослых. Соблюдение безглютеновой диеты — пожизненное требование к больному, потому что даже самое малое количество глютена может вызвать новые повреждения кишечника.
Кроме диеты больным проводится лечение неминуемо возникающего при этом заболевании дисбактериоза.
Для коррекции витаминно-минеральной недостаточности, улучшения ферментативных процессов больным нередко назначают таблетированные препараты. Необходимы препараты витамина D3, железа, анаболические препараты, пепсидил, натуральный желудочный сок, панкреатин и т.д.
При тяжелых проявлениях целиакии, при выраженных признаках аллергии показано назначение преднизолона.
Болезнь Крона
Болезнь Крона — хроническое рецидивирующее заболевание неясной этиологии, характеризующееся гранулематозным воспалением с сегментарным поражением разных отделов пищеварительного тракта.
Характеризуется трансмуральным, то есть затрагивает все слои пищеварительной трубки, воспалением, лимфаденитом, образованием язв и рубцов стенки кишки.
Этиология. Причины развития болезни неизвестны. Предполагают этиологическую роль бактерий, вирусов, пищевых аллергенов, генетических факторов (семейный характер болезни отмечен в 5% случаев). Отмечено, что БК ассоциируется с антигеном гистосовместимости HLA-B27.
Патогенез. Точные представления о механизмах развития болезни отсутствуют. В настоящее время рабочей гипотезой служит предположение о нарушении иммунного ответа организма на кишечную микрофлору у генетически предрасположенных лиц. Предполагают, что органы иммуногенеза вырабатывают аутоантитела к клеткам слизистой оболочки кишечника, а также сенсибилизированные лимфоциты, обладающие повреждающим
действием. При БК выявляются значительные нарушения микробиоценоза кишечника: уменьшение количества бифидобактерий при одновременном увеличении числа энтеробактерий и появлении энтеробактерий с признаками патогенности.
КЛАССИФИКАЦИЯ БОЛЕЗНИ КРОНА (МОНРЕАЛЬ,2005)
ВОЗРАСТ УСТАНОВЛЕНИЯ ДИАГНОЗА (AGEDIAGNOSIS)
А1 – до 16 лет
А2 – между 17 и 40 годами
А3 – в возрасте старше 40 лет ЛОКАЛИЗАЦИЯ (LOCATION)
L1 – подвздошная кишка
L2 – толстая кишка
L3 – подвздошная и толстая кишка
L4 – изолированное поражение верхних отделов желудочно-кишечного тракта
ХАРАКТЕР ПОРАЖЕНИЯ (BEHAVIOR)
В1 – без стриктур и пенетрации
В2 – стенозирующее
В3 – пенетрирующее
Р – добавляется к В1-В3 при наличии перианального поражения
Клиническая картина.
Кишечная симптоматика 1.Боль в животе, особенно после еды. 2.Поносы, кровь в стуле (редко). 3.Симптомы нарушения всасывания. 4.Повреждения в анальной области.
Внекишечные симптомы 1.Анемия, лихорадка, общее недомогание, снижение веса –можетбыть и без диареи.
2.Артрит, узловатая эритема, вторичная аминорея, афтозный стоматит. 3.Глазная симптоматика (конъюнктивит, эписклерит, кератит, ирит, увеит).
Диагностика.
1. Лабораторные данные ОАК –анемия,лейкоцитоз, повышение СОЭ.
ОАМ – без патологии, в активную фазу может быть протеинурия, микрогематурия. БАК – Дефицит белка, альбуминов, Fe, ферритина, витамина В12, фолиевой кислоты,
цинка, магния. Увеличение трансферрина, СРБ, серомукоида, α2иγ-глобулинов,АЛТ, иногда билирубина.
Иммунологический анализ крови: повышение Ig, циркулирующих иммунных комплексов, снижение Т-лимфоцитов-супрессоров.
Копрограмма: примесь крови и слизи, при микроскопии: большон количество эритроцитов; положительная реакция на срытую кровь (реакция Грегерсена), на растворимый белок (реакция Трибуле), много эпителиальных клеток и лейкоцитов.
2. Инструментальные методы 1.Колоноскопия с биопсией (так чтобы попал подслизистый слой): афтозные и
язвенные поражения на нормальной или воспаленной слизистой оболочке.
2.Гистология: эпителиоидные гранулемы (30-60%)в подслизистом слое (с гигантскими клетками Лангханса).
3. R-логическое исследование: изъязвления (афты), рельеф булыжной мостовой, сужение просвета, стеноз.
Лечение.
o Диета «П».
o Коррекция нарушений обмена веществ, электролитного и поливитаминного дисбаланса и кишечной оксалатурии.
o Базисная патогенетическая терапия: лечение препаратами, содержащими 5- аминосалициловую кислоту (сульфасалазин), глюкокортикоидами и негормональными иммунодепрессантами (азатиоприн, 6-меркаптопурин при непереносимости азатиоприна). Доказана эффективность инфлексимаба.
oСимптоматическая терапия – это антибиотики для лечения вторичной инфекции, антидиарейные средства, антигистаминные средства – при выраженных
аллергических реакциях.
o Хирургическое лечение (стенозирование кишки, перфорация, абсцессы, свищи).
Муковисцидоз (кишечная форма)
Муковисцидоз (Cystic Fibrosis) – моногенное заболевание, обусловленное мутацией гена МВТР (муковисцидозного трансмембранного регулятора проводимости), характеризующееся поражением экзокринных желез жизненно важных органов и систем и имеющее обычно тяжелое течение и прогноз.
Этиология. Ген МВ контролирует структуру и функцию белка, названного МВТР - трансмембранный регулятор МВ. На сегодняшний день выделено около 2 000 мутаций гена - трансмембранного регулятора проводимости муковисцидоза (МВТР), ответственных за развитие симптомов МВ.
Патогенез. МВТР регулирует транспорт электролитов (главным образом хлора) между эпителиальными клетками и межклеточной жидкостью. Мутации гена МВ нарушают не только транспорт, но и секрецию ионов хлора. При затруднении их прохождения через клеточную мембрану увеличивается реабсорбция натрия железистыми клетками, нарушается электрический потенциал просвета, что вызывает изменение электролитного состава и дегидратацию секрета желез внешней секреции. В результате выделяемый секрет становится чрезмерно густым и вязким.
Клиническая картина. Клиническая симптоматика кишечного синдрома у больных со смешанной и преимущественно кишечной формами муковисцидоза складывается из симптомов нарушения функции поджелудочной железы и кишечника.
◙ Нарушение ферментативной активности поджелудочной железы проявляется недостаточным расщеплением и всасыванием жиров, белков и в меньшей степени углеводов.
В кишечнике возникают гнилостные процессы, сопровождающиеся накоплением газов, в результате чего почти постоянно наблюдается вздутие живота. Характерен обильный, жирный, замазкообразный стул с неприятным гнилостным запахом. Выпадение прямой кишки отмечается у 10—20 % детей.
◙Из других абдоминальных симптомов можно выделить частые боли в животе различного характера: схваткообразные при метеоризме, мышечные после мучительного приступообразного кашля, боли в области увеличенной печени при недостаточности правого сердца. Боли в эпигастральной области могут быть связаны с недостаточной нейтрализацией желудочного сока в двенадцатиперстной кишке вследствие сниженной секреции поджелудочной железой бикарбонатов.
◙У значительного числа умерших больных на вскрытии обнаруживается билиарный цирроз печени, в то время как результаты биохимических исследований часто бывают отрицательными. Расстройство пищеварения закономерно приводит к развитию гипотрофии, несмотря на повышенный аппетит у большинства больных. В редких случаях у детей грудного возраста развивается отечный синдром (гипопротеинемические отеки).
Мекониевая непроходимость кишечника развивается у 10—15 % новорожденных, больных муковисцидозом. В первые дни жизни ребенка появляются симптомы кишечной непроходимости: рвота с примесью желчи, неотхождение мекония, увеличение живота. Серый, замазкообразный меконий находится в просвете тонкой кишки, обычно в области илеоцекального клапана. Опасным осложнением является мекониевый перитонит.
Диагностика. Диагноз МВ подтверждается при наличии одного или более характерных фенотипических проявлений МВ в сочетании с доказательствами наличия мутации гена МВТР, такими как: выявление мутаций гена МВТР при генотипировании или увеличение уровня хлоридов в секрете потовых желез больного.
◙Потовый тест — методом пилокарпинового электрофореза по Гибсону и Куку является «золотым стандартом диагностики», проводится троекратно. Пограничные значения хлора 40-59 ммоль/л, патология 60 ммоль/л и выше.
◙Неонатальный скрининг.
Лечение.
o Диетотерапия (пациентам с МВ необходима ранняя и «агрессивная» нутритивная терапия).
o Заместительная терапия недостаточности экзокринной функции поджелудочной железы;
o Витаминотерапия (витамины A, D, E, K).
