
естественно
.PDF101
ТКЭАМ — топографическое картирование электрической активности мозга — область электрофизиологии, оперирующая с множеством количественных методов анализа электроэнцефалограммы и вызванных потенциалов. Топографическое картирование существенным образом повышает эффективность ЭЭГ-метода. ТКЭАМ позволяет очень тонко и дифференцированно анализировать изменения функциональных состояний мозга на локальном уровне в соответствии с видами выполняемой испытуемым психической деятельности. Однако, следует подчеркнуть, что метод картирования мозга является не более чем очень удобной формой представления на экране дисплея статистического анализа ЭЭГ и ВП.
Количественная ЭЭГ. Количественная ЭЭГ-активности рассматривается как средний уровень активности мозговых волн в связи с той или иной деятельностью или в связи с той или иной патологией. Регистрация ЭЭГ производится в состоянии оперативного покоя (глаза открыты), психосенсорного покоя (глаза закрыты). Для анализа ЭЭГ применяют Фу- рье-анализ или полупериодный. В результате анализа вычисляют амплитуду, частоту ритмов ЭЭГ индекс времени (%% времени который данный ритм занимает за определенный временной период регистрации). После получения исходных данных производится обработка полученных результатов, применением цифровых методов.
Современные методы клинической и экспериментальной электроэнцефалографии сделали значительный шаг вперед благодаря применению компьютеров. Обычно на поверхность скальпа при клиническом обследовании больного накладывают несколько десятков чашечковых электродов. Далее эти электроды соединяют с многоканальным усилителем. Современные усилители очень чувствительны и позволяют записывать электрические колебания от мозга амплитудой всего в несколько микровольт (1 мкВ = 1/1000000 В). Далее достаточно мощный компьютер обрабатывает ЭЭГ по каждому каналу. Психофизиолога или врача, в зависимости от того, исследуется мозг здорового человека или больного, интересуют многие характеристики ЭЭГ, которые отражают те или иные стороны деятельности мозга, например ритмы ЭЭГ (альфа, бе-
102
та, тета и др.)? характеризующие уровень активности мозга. В качестве примера можно привести применение этого метода в анестезиологии. В настоящее время во всех хирургических клиниках мира во время операций под наркозом наряду с электрокардиограммой регистрируется и ЭЭГ, ритмы которой могут очень точно указывать глубину наркоза и контролировать деятельность мозга.
Широкое использование ЭЭГ в клинической практике предполагает понимание природы и механизмов генеза электроэнцефалограммы. Однако механизмы генерации ЭЭГ остаются не вполне ясными. В настоящее время существует как минимум три теории происхождения альфа-активности и локализации ее генераторов: 1) теория пейсмекеров. сформулированная П. Андерсоном и коллегами, предполагающая локализацию центрального механизма генерации альфа ритма в таламических ядрах (Andersen P.. Andersson S.A. 1974) модель корковых и таламических генераторов предложенная Ф. Ло-
песом да Сильва с сотр. ( Lopes da Silva F.H., et all., 1973) ко-
торая базируется на существовании относительно независимых генераторов, локализованных как в ядрах таламуса, так и в коре. 3) теория Басара Е. (Basar E., Shurmann M. 1996),
постулирующая наличие множества мультифункциональных селективно распределенных по мозгу генераторов альфа-ритма, образующих диффузно-распределенную альфа-систему.
Нейронные системы коры головного мозга проявляют свойства фильтра по отношению к электрической активности элементов, составляющих данные системы, но одновременно с этим, обладают и свойствами автогенераторов. Распределенный характер источника альфа-ритма ЭКоГ-ЭЭГ позволил выдвинуть гипотезу о существовании множественных дискретных источников осцилляции альфа-диапазона - «альфонов».
Можно предположить, что подобным же образом в коре головного мозга существуют и гипотетические генераторы бе- та-2-, бета-1-, тета- и дельта-ритмов (и возможно других ритмов ЭЭГ). Позитивные и негативные связи-отношения между
103
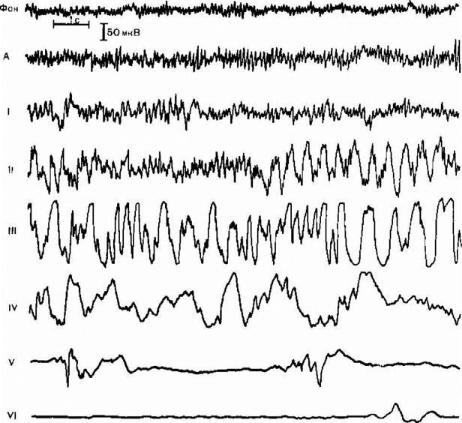
Рис. 20. Электроэнцефалографические стадии наркоза натрия оксибутиратом. А — фаза генерализации гиперсинхронного а-ритма; I — стадия увеличения амплитуды и замедления фоновой активности до 6—10 Гц; II — стадия пароксизмов высокоамплитудных гиперсинхронных волн частотой 2,5—4 Гц с элементами судорожной активности «быстрая волна — медленная волна», III — стадия генерализованной гиперсинхронной (150—200 мкВ) активности частотой 1,5—4 Гц, IV—стадия высокоамплитудных медленных волн частотой 0,5— 3 Гц с периодическим снижением амплитуды ЭЭГ до уровня изоэлектрической линии; V — стадия «немых зон» длительностью до 5 с короткими вспышками медленных волн, имеющих амплитуду 30—100 мкВ, VI — стадия «немых зон» длительностью 10 с и более, дальнейшее уменьшение амплитуды биопотенциалов до 10—30 мкВ и укорочение периодов активности до 1—2 с (Руководство по анестезиологии, -Под ред. Бунятяна А.А.. 1995).
амплитудами различных ритмов ЭЭГ, выявленные нами с помощью методов установления множественной линейной регрессии и корреляции, могут свидетельствовать о том,
104
что пр и наличии множества гипотетических генераторов различных ритмов ЭКоГ в то же время они объединены некими механизмами управления, которые обеспечивают общую организацию ЭЭГ (Лобасюк Б.А., 2005).
3.1.4. Вызванные потенциалы головного мозга
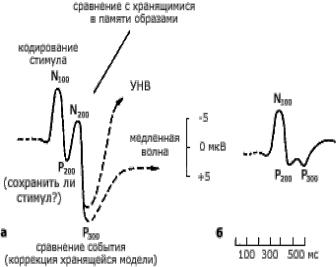
Вызванные потенциалы (ВП) — биоэлектрические колебания, возникающие в нервных структурах в ответ на внешнее раздражение и находящиеся в строго определенной временной связи с началом его действия (рис. 21). У человека ВП обычно включены в ЭЭГ, но на фоне спонтанной биоэлектрической активности трудно различимы (амплитуда одиночных ответов в несколько раз меньше амплитуды фоновой ЭЭГ). В связи с этим регистрация ВП осуществляется специальными техническими устройствами, которые позволяют выделять полезный сигнал из шума путем последовательного его накопления, или суммации. При этом суммируется некоторое число отрезков ЭЭГ, приуроченных к началу действия раздражителя.
Широкое использование метода регистрации ВП стало возможным в результате компьютеризации психофизиологических исследований в 50-60 гг. Первоначально его применение в основном было связано с изучением сенсорных функций человека в норме и при разных видах аномалий. Впоследствии метод стал успешно применяться и для исследования более сложных психических процессов, которые не являются непосредственной реакцией на внешний стимул. Способы выделения сигнала из шума позволяют отмечать в записи ЭЭГ изменения потенциала, которые достаточно строго связаны во времени с любым фиксированным событием. В связи с этим появилось новое обозначение этого круга физиологических явлений — событийно-связанные потенциалы (ССП).
Эти потенциалы представляют собой последовательность позитивных и негативных колебаний, регистрируемых, как правило, в интервале 0-500 мс. В ряде случаев возможны и более поздние колебания в интервале до 1000 мс. Коли-
105
чественные методы оценки ВП и ССП предусматривают, в
Рис.21. Вызванные потенциалы.
первую очередь, оценку амплитуд и латентностей. Амплитуда — размах колебаний компонентов, измеряется в мкВ, латентность — время от начала стимуляции до пика компонента, измеряется в мс. Помимо этого, используются и более сложные варианты анализа.
Вызванный потенциал - биоэлектрические колебания системного характера в виде волны или группа волн, возникающих
внервных структурах в ответ:
-на сенсорные стимулы;
-на электрическое раздражение афферентных путей;
-на импульсы, поступающие по ассоциативным волок-
нам;
-на строго фиксированные события.
Вызванные потенциалы используются:
-для анализа реакций мозга на внешние стимулы; и
-для анализа внутренне обусловленных нервных процес-
сов.
Обычно вызванные потенциалы соизмеримы с уровнем спонтанной активности и для их выделения применяются специальные статистические методы.
3.1.5. Регистрация ответов нейронов.
Реально первый прорыв в изучении функционирования мозга человека (по определению академика Н.П.Бехтеревой)
106
был связан с исследованиями в условиях прямого многоточечного контакта с мозгом человека при применении метода долгосрочных и краткосрочных имплантированных электродов для диагностики и лечения больных. По времени развертывание этого метода совпало с началом понимания того, как работает отдельный нейрон, как происходит передача информации от нейрона к нейрону и по нерву. Одной из первых в условиях непосредственного контакта с мозгом человека стала работать академик Н.П.Бехтерева и ее сотрудники в институте мозга человека Российской академии наук.
Результаты, полученные этим коллективом, позволили получить важнейшую информацию о механизмах работы мозга по обеспечению высших психических функций. Были получены данные о жизни отдельных зон мозга, о соотношении коры и подкорки, о компенсаторных возможностях мозга и многое другое. Однако и эти исследования не могли, решит всех поставленных задач: мозг состоит из десятков миллиардов нейронов, а с помощью электродов можно было наблюдать за десятками, и то не всегда теми, которые нужны для исследования, а теми, рядом с которыми оказался лечебный электрод.
Нейрон — нервная клетка, через которую передается информация в организме, представляет собой морфофункциональную единицу ЦНС человека и животных. При достижении порогового уровня возбуждения, поступающего в нейрон из разных источников, он генерирует разряд, называемый потенциалом действия. Как правило, нейрон должен получить много приходящих импульсов прежде, чем в нем возникнет ответный разряд. Все контакты нейрона (синапсы) делятся на два класса: возбудительные и тормозные. Активность первых увеличивает возможность разряда нейрона, активность вторых — снижает. По образному сравнению, ответ нейрона на активность всех его синапсов представляет собой результат своеобразного "химического голосования". Частота ответов нейрона зависит от того, как часто и с какой интенсивностью возбуждаются его синаптические контакты, но здесь есть свои ограничения. Генерация импульсов (спайков) делает нейрон недееспособным примерно на 0,001 с. Этот период на-

107
зывается рефрактерным, он нужен для восстановления ресурсов клетки. Период рефрактерности ограничивает частоту разрядов нейронов. Частота разрядов нейронов колеблется в широких пределах, по некоторым данным от 300 до 800 импульсов в секунду.
Регистрация ответов нейронов. Активность одиночно-
го нейрона регистрируется с помощью так называемых микроэлектродов, кончик которых имеет от 0,1 до 1 микрона в диаметре. Специальные
Специальные устройства позволяют вводить такие электроды в разные отделы головного мозга, в таком положении электроды можно зафиксировать и, будучи соединены с комплексом усилитель — осциллограф, они позволяют наблюдать электрические разряды нейрона. С помощью
Рис. 22. Варианты осциллограмм импульсной активности нейронных популяций, регистрируемых в различных корковых и подкорковых с т р у к т у р а х ( п о Н . П . Б е х т е р е в о й с с о а в т . , 1 9 8 5 ) . Вверху - отметки времени (100 мс). Латинские буквы справа - условные обозначения структур мозга человека.
микроэлектродов регистрируют активность отдельных нейронов, небольших ансамблей (групп) нейронов и множественных популяций (т.е. сравнительно больших групп нейронов). Количественная обработка записей импульсной активности нейронов представляет собой довольно сложную задачу особенно в тех случаях, когда нейрон генерирует множество разрядов и нужно выявить изменения этой динамики в зави-
108
симости от каких-либо факторов. С помощью ЭВМ и специального программного обеспечения оцениваются такие параметры, как частота импульсации, частота ритмических пачек или группирования импульсов, длительность межстимульных интервалов и др. Анализ функциональных характеристик активности нейронов в сопоставлении с поведенческими реакциями проводится на достаточно длительных отрезках времени от 25-30 с и выше. Ценными объектами исследования функциональных свойств нейронов служат крупные и относительно доступные нейроны некоторых беспозвоночных. Многочисленные факты, касающиеся нейрональной организации поведения, были получены при изучении импульсной активности нейронов в экспериментах на кроликах, кошках и обезьянах. Один из удивительных видов электрической активности нейронов, регистрируемой внутриклеточным микроэлектродом, - это пейсмекерные потенциалы. А Арванитаки и И. Халазонитис (1955) впервые описали осциллирующие потенциалы нервной клетки, не связанные с поступлением к ней синаптических влияний.
Исследования активности нейронов головного мозга человека осуществляются в клинических условиях, когда пациентам с лечебными целями вводят в мозг специальные микроэлектроды. В ходе лечения для полноты клинической картины больные проходят психологическое тестирование, в процессе которого регистрируется активность нейронов. Исследование биоэлектрических процессов в клетках, сохраняющих все свои связи в мозге, позволяет сопоставлять особенности их активности, с результатами психологических проб, с одной стороны, а также с интегративными физиологическими показателями (ЭЭГ, ВП, ЭМГ и др.). Последнее особенно важно, потому что одной из задач изучения работы мозга является нахождение такого метода, который позволил бы гармонически сочетать тончайший анализ в изучении деталей его работы с исследованием интегральных функций. Знание законов функционирования отдельных нейронов, конечно, совершенно необходимо, но это только одна сторона в изучении функционирования мозга, не вскрывающая, однако, законов работы мозга как целостной функциональной системы.
109
3.1.6. Магнитоэнцефалография (МЭГ).
Магнитоэнцефалография (МЭГ) - технология, позволяющая измерять и визуализировать магнитные поля, возникающие вследствие электрической активности мозга. Для детекции полей используются высокоточные сверхпроводниковые квантовые интерферометры, или СКВИД-датчики. МЭГ применяется в исследованиях работы мозга и в медицине.
Первая магнитоэнцефалограмма была получена физиком Дэвидом Коэном из Иллинойса без использования СКВИДов.( Cohen D. 1968). МЭГ может использоваться для локализации очагов эпилептической активности, в частности при планировании операций.
В 2007 году группа исследователей сообщила об удачной классификации с помощью МЭГ таких заболеваний, как рассеянный склероз, болезнь Альцгеймера, шизофрения, синдром Шегрена, хронический алкоголизм, невралгии лицевых нервов в группе из 142 человек. Учёные предположили, что МЭГ может помочь в диагностике болезней мозга, и основали компанию Orasi Medical для коммерческого продвижения разработанной ими методики.
Регистрация магнитной составляющей электромагнитного поля головного мозга стала осуществляться относительно недавно в связи с успехами физики низких температур и сверхчувствительной магнитометрии. МЭГ является не только неинвазивным, но даже бесконтактным методом исследования функции мозга. Физическая сущность метода МЭГ заключается в регистрации сверхслабых магнитных полей, возникающих в результате протекания в головном мозгу электрических токов. Основой датчика является катушка, расположенная параллельно поверхности черепа на расстоянии до 1 см и помещенная в сосуд с жидким гелием для придания ей сверхпроводящих свойств. Только таким образом можно зарегистрировать слабые индукционные токи, возникающие в катушке под влиянием магнитных полей, силовые линии которых выходят радиально (перпендикулярно поверхности черепа), т.е. обусловленных протеканием внеклеточных токов в тангенци-
110
альном направлении (параллельно поверхности черепа). Прин
Рис. 23. Магнитоэнцефалография.
ципиальной особенностью магнитного поля по сравнению с электрическим полем является то, что череп и мозговые оболочки практически не оказывают влияния на его величину, будучи как бы «прозрачными» для магнитных силовых линий. Это позволяет регистрировать активность не только наиболее поверхностно расположенных корковых структур (как в случае ЭЭГ), но и глубоких отделов мозга с достаточно высоким отношением сигнал/шум.
Именно для МЭГ впервые был разработан математический аппарат и созданы программные средства определения дипольного источника в объеме мозга, которые затем были модифицированы для аналогичного анализа ЭЭГ. В связи с этими особенностями МЭГ достаточно эффективна для точного определения внутримозговой локализации эпилептических очагов и генераторов различных компонентов ВП, тем более что к настоящему времени созданы многоканальные МЭГустановки.
Несмотря на кажущиеся преимущества МЭГ, она не является конкурентом электроэнцефалографии, а рассматривается как дополнительный метод исследования мозга, имеющий и некоторые недостатки. Аппаратура для регистрации МЭГ намного дороже, чем электроэнцефалографы; МЭГ чрезвычайно чувствительна к смещениям датчика относительно головы пациента и к внешним магнитным полям, экранирование от которых является достаточно сложной технической задачей; МЭГ в основном регистрирует активность
