
системные механизмы
.pdf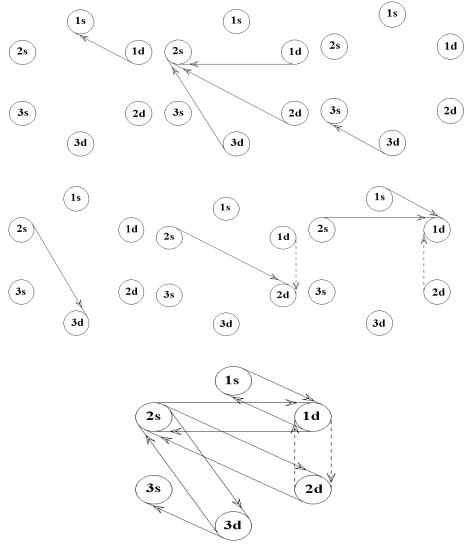
линейной регрессии, конструируется полициклический81 мультиграф (рис. 2.1, Ж) отражающий ориентированные, т.е. направленные от одного показателя к другому, взаимные влияния, т.е. связи-отношения.
В результате изложенной процедуры формируется математическая модель, позволяющая при анализе данных использовать методы и категории теории графов.
А |
Б |
В |
Г |
Д |
Е |
Ж
Рис. 2.1. Геометрическая интерпретация с помощью графов уравнений множественной линейной регресси.
Обозначения: А-Е – графы-деревья интерпетирующие уравнения множественной линейной регрессии. Ж - полициклический мультиграф, отражающий ориентированные, т.е. направленные от одного показателя к другому, взаимные влияния, т.е. связиотношения.
Двумерные коэффициенты корреляции вычисляли82 методом наименьших квадратов и интерпретировали с помощью неориентированных графов.
2.5. Количественная электроэнцефалография. Сегментация ЭЭГ (ЭКоГ)
Потребность в количественной оценке ЭЭГ (ЭКоГ) обусловила необходимость статистического анализа характера её распределений.
Норберт Винер предложил рассматривать ЭЭГ, как стохастический сигнал, по аналогии с характеристиками сигнала любой сложной системы (Винер 1961). Исходя из этой посылки, можно было предположить, что главные законы динамики ЭЭГ могли быть изучены на основе вероятностно статистического анализа, вне зависимости от биофизического происхождения корковых электрических процессов (Lopes da Silva 1981). Это стимулировало появления значительного количества работ относительно стохастических свойств сигнала электроэнцефалограммы.
В первых работах, посвященных анализу статистических свойств ЭЭГ как стохастического процесса, было показано, что распределение амплитудных значений ЭЭГ соответствует гауссовским параметрам (Kozhevnikov V.A., 1958; Lion K.S., Winter D.F, 1953; Sounders M.G.,. 1963). Это очень важное заключение для понимания природы суммарной ЭЭГ. В соответствии с центральной предельной теоремой гауссовские свойства ЭЭГ можно было бы объяснить взаимной независимостью индивидуальных источников (генераторов) коркового электрического поля (Elul R., 1969), что разрешало бы в полной мере применение параметрических методов математической статистики к анализу ЭЭГ-сигнала и существенно упрощало бы его содержательные трактовки. Однако, ряд авторов не подтвердил гауссовскую структуру ЭЭГ (Sugimoto H., Ishii N., Iwata A. et. al., 1978; Weiss M.S., 1973; Campbell J. et al., 1967). Причина столь явных противоречий в основном была связана с тем, что для тестирования авторы использовали фрагменты ЭЭГ разной длительности. Короткие сегменты ЭЭГ, до 10 с, как правило хорошо апроксимировались гауссовским распределением, а более длинные - до 1 мин, обычно не подчинялись нормальному закону. Важным выводом этих работ было предположение о том, что ЭЭГ может
фактически быть описана в соответствии с распределениями83 вероятности, но только при довольно коротких реализациях, не более 10-20 с.
Применение методов нелинейной динамики (теория детерминированного хаоса) к проблеме описания электроэнцефалограммы было относительно успешно (Jansen 1991; Roeschke и другие. 1997; Pritchard и Герцог 1992). Эта теория работает с ансамблями траекторий динамических систем и использует вероятностный подход для описания наблюдаемыхсистем. Однако, методы нелинейной динамики базируются на гипотезе, что электрическая деятельность мозга может быть описана постоянными динамическими моделями. Такая гипотеза нереалистична во многих случаях (A.Ya.Kaplan, S.L.Shishkin, 2000)
Всвоей совокупности изложенные факты свидетельствует о том, что динамическая картина ЭЭГ-процесса может быть корректно описана только при рассмотрении достаточно коротких его сегментов. это побудило исследователей к разработке специализированных методов сегментации ЭЭГ.
Вмногочисленных исследованиях с применением сегментации ЭЭГ было обнаружено (Darlow J.S., 1985), что ЭЭГ действительно состоит из относительно стационарных сегментов, длительность основной массы которых по данным разных авторов варьирует в пределах от 0,2 до 10—12 секунд. Главным концептуальным достижением сегментационного подхода является выявление временной структурированности ЭЭГ, гораздо более тонкой, чем обычные генерализованные перестройки ритмических компонентов, типа синхронизации-десинхронизации. высказанное еще Ремондом (Remond А.,Rrenault B., 1972). Предположение об организации ЭЭГ сигнала из ограниченного набора элементарных паттернов, по-видимому, нашло свое подтверждение в кусочностационарной структурированности ЭЭГ. Каждый стационарный участок ЭЭГ, возможно, и является метастабильным функциональным модулем ЭЭГ активности, обладающем индивидуальным паттерном характеризующих его оценок, например спектральных (Каплан А.Я., 1998).Описаны ряд методов сегментации: сегментация методом фиксированных интервалов, параметрическая сегментация ЭЭГ, параметрическая сегментация ЭЭГ на основе авторегрессионного моделирования, адаптивная сегментация на основе статистических методов, сегментация ЭЭГ
без использования статистических подходов при поиске границ84 между сегментами, топографическая сегментация ЭЭГ, непараметрический метод Б.С. Дарховского и Б.Е. Бродского.
Как полагает Каплан А.Я. (1999) дальнейший прогресс в содержательных интерпретациях ЭЭГШ в немалой степени будет связан со структурно-аналитическим подходом к изучению ЭЭГ, как кусочно-стационарного процесса.
Применение различных методов сегментации в сочетании со спектральном анализом может обеспечить пространственно временной анализ ЭЭГ, и по-видимому, является одним из базовых подходов в развитии идеологии количественного анализа ЭЭГ
(QEEG).
2.6. Математические основы выявления подобия в действии фармакологических объектов, использованием
разностных матриц ЭКоГ.
Исходя из представлений о том, что электрокортикографический (ЭКоГ) паттерн является функцией нейрохимического состояния головного мозга (Мельник Э.В., 1998), можно предположить, что выявление подобия при применении фармакологического препарата или биологически активного вещества (БАВ) и определенного лиганда (нейротрансмиттера или гормона) в динамических изменениях ЭКоГ может служить доказательством участия данного лиганда в механизмах действия изучаемого препарата.
Для выявления сходства-различия в механизмах действия на ЭКоГ фармакологических объектов использовали разностные матрицы и дискриминантный анализ.
Разностные матрицы получали, вычисляя разности средних величин показателей ЭКоГ до и после применения препаратов. Матрицы составляли отдельно для левого и правого полушарий. Исходные величины показателей ЭKоГ в разных группах опытов могут статистически значимо различаться, что в свою очередь, может влиять на корректность математико-статистических вычислений. Применение разностных матриц способствует стандартизации расчетного материала.
С целью верификации подобия-различия в испытуемых препаратов, вычисляли парные коэффициенты корреляции между величинами ЭКоГ определенными к 5-30 минутам после введения
препаратов. Дискриминантный анализ проводили между85 разностными матрицами показателей ЭКоГ.
Дискриминантный анализ – это раздел многомерного анализа, содержанием которого является разработка методов решения задач распознавания (дискриминации) новых объектов , путем сравнения величины их признаков с аналогичными показателями уже исследованных кластеров.Такое сравнение позволяет классифицировать новые объекты, отнестим их в те или иные группы (Янковой А.Г., 2001).
Впроцессе проведения дискриминантного анализа возникает две главные теоретические проблемы:
1. Выбор функции F(z).
2. Определение неизвестных коэффициентов дискриминатной функции F(z).
Вматематико-статистической литературе ( Болч Б., Хуань К.Дж. 1979; Глинський В.В., Ионин В.Г. 1998) наиболее разработанным является является случай использования линейной дискриминантной функции, как наиболее часто применяемый в исследованиях функцій.
Определение неизвестных коэффициентов дискриминатной функции чаще всего базируется на вычислении расстояний Маханолобиса (квадрата расстояния Маханолобиса) между центрами тяжести кластеров с последующим определением неизвестных коэффициентов дискриминантной функции. Это классический вариант дискриминации. Отсутствие статистически значимых различий (Р>0,1) квадрата расстояния Маханолобиса между разностными матрицами данных свидетельствует о подобии показателей ЭКоГ, и наоборот, статистически значимое различие (P<0,1) разностных матриц данных, судя по квадрату расстояния Маханолобиса, свидетельствует об отсутствии подобия.
86
Глава 3 Исследования роли ретикулярной формации ствола мозга
вмеханизмах коркового электрогенеза
3.1.Сопоставление показателей ЭКоГ, отводимых от
препаратов ИМ и ИПМ
Сопоставление показателей несегментированных ЭКоГ, отводимых от препаратов ИМ и ИПМ. В ЭКоГ ИПМ по сравнению с ЭКоГ, отводимой от ИМ (таб. 3.1) были значимо более низкими амплитуды бета-2-, бета-1-, альфа-, тета- и дельта-ритмов как в левом, так и в правом полушарий.
Реорганизация ЭКоГ ИПМ по сравнению с таковой, регистрируемой в ИМ, выражалась в меньших значениях индексов длительности бета-2- и тета-ритмов и бóльших величинах индексов длительности бета-1- и дельта-ритмов в обоих полушариях. Индекс длительности альфа-ритма в левом полушарии не отличался достоверно от соответствующего показателя для ИМ, а в правом был меньше.
Сопоставление показателей сегментированных ЭКоГ ИМ и ИПМ. Отношение длительностей эпизодов десинхронизации к продолжительностям эпизодов синхронизации ЭКоГ, отводимой от левого полушария ИМ, составляло 6,65 (13,07% синхронизации), а в правом – 1,46 (40_65% синхронизации), тогда как для ИПМ соответствующие значения равнялись 6.40 (13,41% синхронизации) и 11.84 (7,78% синхронизации) соответственно.
Показатели амплитуд бета-2-, бета-1-, альфа-, тета- и дельта-ритмов ЭКоГ во втором кластере – «эпизодах синхронизации» – были больше аналогичных величин для первого кластера – «десинхронизации» (табл. 3.1. рис. 3.1) как в левом, так и в правом полушарии ИМ. Для препарата ИПМ амплитудные показатели бета-2-, бета-1-, тета- и дельтаритмов ЭКоГ при синхронизации также оказались бóльшими, чем аналогичные величины, выявленные в отрезках десинхронизации ЭКоГ и в левом, и в правом полушарии. В то же время амплитуда альфа-ритма в отрезках синхронизации была статистически значимо большей только в левом полушарии.

87
|
|
|
А |
|
|
200 |
|
|
|
|
|
180 |
|
|
|
T |
D |
|
|
|
|
|
|
160 |
|
|
A |
|
|
|
|
|
|
|
|
140 |
|
|
|
|
|
120 |
|
|
|
|
|
|
|
B1 |
|
|
|
мкВ 100 |
|
|
|
|
|
80 |
B2 |
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
40 |
|
|
|
|
|
20 |
|
|
|
|
|
0 |
1 2 3 4 |
1 2 3 4 |
1 2 3 4 |
1 2 3 4 |
1 2 3 4 |
|
SB2A |
SB1A |
SAA |
STA |
SDA |
Б
200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
180 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
160 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
140 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
120 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
мкВ 100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DB2A1 2 3 4 |
|
|
1DB1A2 3 4 1 2DAA3 4 1 2DTA3 4 |
1 2 3DDA4 |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
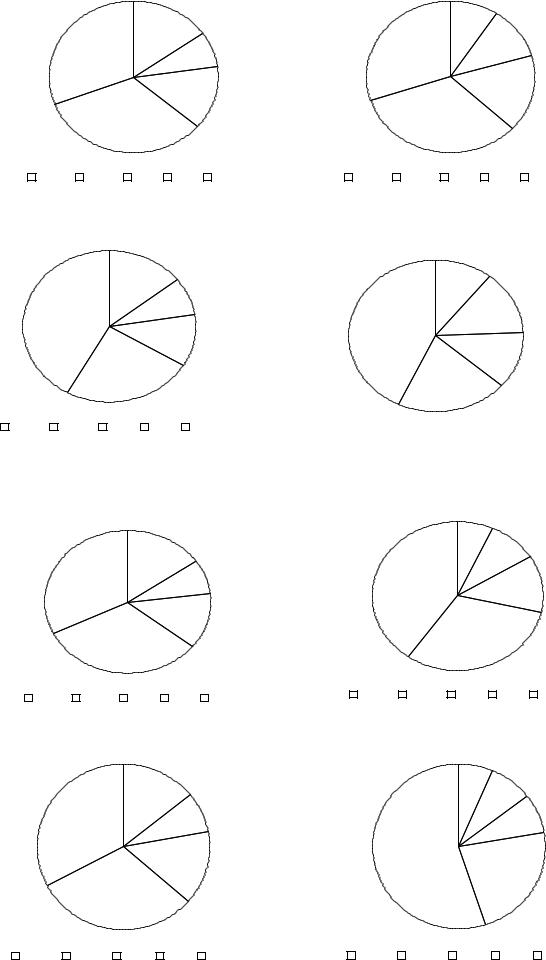
Рисунок. 3.1. Диаграммы средних амплитуд ритмов 2-,1-, -, -, и - ЭКоГ, отводимой от левого (А) и правого (Б) полушария интактного мозга (1,2) и препарата изолированного мозга (3, 4) при сегментации в пределах сегментов десинхронизации (1,3) и синхронизация (2,4).
Реорганизация ЭКоГ при переходе от десинхронизации к синхронизации (таб. 3.1, рис. 3.2) как в ИМ, так и в ИПМ
|
I |
88 |
|
|
|
13,97 |
|
8,17 |
|
|
|
А |
Б |
|
28,35 |
27,04 |
10,27 |
|
|
|
7,07 |
|
|
12,40 |
|
14,78 |
|
|
|
30,34 |
|
29,98 |
|
|
|
SB2T SB1T SAT STT SDT |
SB2T |
SB1T SAT STT SDT |
13,51 |
10,32 |
|
В |
Г |
|
7,56 |
13,38 |
|
39,57
42,13
10,58
11,97
22,90
SB2T SB1T SAT STT SDT 20,11

 SB2T
SB2T  SB1T
SB1T  SAT
SAT  STT
STT  SDT
SDT
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
5,66 |
|
|
А |
|
|
14,21 |
Б |
|
|
|
8,26 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
29,61 |
|
|
|
|
|
|
|
|
|
|
|
|
|
7,12 |
34,76 |
|
|
|
10,75 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11,62 |
|
|
|
|
|
|
29,69 |
|
|
|
|
26,95 |
|
||
|
|
|
|
|
|
|
|
||
DB2T |
DB1T |
DAT |
DTT |
DDT |
DB2T |
DB1T |
DAT |
DTT |
DDT |
|
|
|
|
|
|||||
|
|
|
13,18 |
|
|
|
5,41 |
|
|
|
|
|
|
|
|
|
6,95 |
||
В |
|
|
|
Г |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
30,28 |
|
|
|
7,18 |
|
|
|
|
6,65 |
|
|
|
|
|
|
|
|
||
|
|
|
|
13,46 |
46,82 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19,26 |
28,63 |
|
|
|
|
|
|
|
|
|
DB2T |
DB1T |
DAT |
DTT |
DDT |
DB2T |
DB1T |
DAT |
DTT |
DDT |
Рисунок. 3.2. Индексы длительности ритмов ЭКоГ левого и89 правого полушарий.
Обозначения: I – левое полушарие, II – правое полушарие, А
– ИМ десинхронизация, Б – ПМ десинхронизация, В – ИМ синхронизация, Г - ПИ синхронизация.
Остальные обозначения те же, что и на рис.3.1.
сопровождалась уменьшением индекса длительности тетаритма в обоих полушариях. В левом полушарии препаратов как ИМ, так и ИПМ индексы длительности бета-1- и дельтаритмов в условиях синхронизации увеличивались по сравнению с таковыми во время десинхронизации, а индекс альфа-ритма уменьшался. Индекс длительности бета-1-ритма в левых полушариях при подобных переходах оставался неизменным в ИМ и возрастал в препарате ИПМ.
В правом полушарии индекс длительности бета-2-ритма ЭКоГ, отводимой от ИМ, уменьшался в условиях синхронизации по сравнению с таковым в периоды десинхронизации, а в препаратах ИПМ статистически значимо не изменялся. Индекс длительности бета-1-ритма в соответствующих условиях в ИМ статистически не отличался, а в ЭКоГ, отводимой от ИПМ, был меньше. Соответствующий показатель для альфа-ритма в ИМ был больше, а в ИПМ – меньше, для дельта-ритма, регистрируемого в ИМ, статистически значимо не отличался, а в ИПМ – ЭКоГ был меньше.
Результаты сравнения особенностей периодов десинхронизации в составе ЭКоГ, отводимой от ИМ и ИПМ, показали, что амплитуды бета-1-, альфа-, тета- и дельта-ритмов в последнем случае в обоих полушариях были заметно меньшими, чем в условиях ИМ. При отведении от ИПМ амплитуды бета-2-ритма в сравниваемых экспериментальных ситуациях в левом полушарии оказались меньшими, а в правом
– бóльшими по сравнению с аналогичными показателями при отведении от ИМ.
Индексы длительности бета-2-ритма в сегментах десинхронизации в обоих полушариях ИПМ были меньшими, чем в ИМ, а бета-1-ритма – наоборот, бóльшими. Индекс длительности альфа-ритма в левом полушарии ИПМ на отрезках десинхронизации был бóльшим, чем в ИМ, а в правом
полушарии – меньшим. Индекс длительности тета-ритма в90 правом полушарии ИПМ был меньшим по сравнению с таковым в условиях интактности мозга, а в левом статистически не отличался. Индекс длительности дельтаритма при десинхронизации в левом полушарии ИПМ оказался меньшим, а в правом – бóльшим, чем в условиях ИМ.
При сравнении особенностей периодов синхронизации в ЭКоГ, отводимой от ИМ и ИПМ, амплитуды бета-2- и тетаритмов в последних препаратах были меньшими, а бета-1- и дельта-ритмов – наоборот, бóльшими. Амплитуда альфа-ритма в правом полушарии ИПМ была меньше таковой в случае интактности, а в левом полушарии статистически не отличалась.
Индексы длительности бета-2- и тета-ритмов ЭКоГ в сегментах синхронизации при отведении от ИПМ оказались меньшими, чем в ИМ, а дельта-ритма – бóльшими в обоих полушариях. Индекс длительности бета-1-ритма в левом полушарии ИПМ в сравниваемых экспериментальных ситуациях превышал таковой для ИМ, в правом – статистически не отличался. Индекс длительности альфаритма в пределах участков синхронизации ЭКоГ, регистрируемой в левом полушарии ИПМ, был бóльшим, чем в условиях ИМ, а в правом – меньшим.
3.2. ФМПА показателей амплитуды ЭКоГ, отводимой от ИМ и ИПМ.
ФМПА показателей ЭКоГ без применения процедуры сегментации. В условиях ИМ без предварительного проведения сегментации ЭКоГ (таб. 3.2, рис. 3.3, А) показатели ФМПА амплитуды ритмов ЭКоГ находились в пределах –1,31
± 0.04 – 0,98 ± 0,03 %. Показатели ФМПА амплитуд бета-1- и альфа-ритмов ЭКоГ были положительными, составляя в среднем 0,98 ± 0,03 и 0,85 ± 0,03 %, а бета-2-, тета- и дельтаритмов – отрицательными, равняясь 1.31 ± 0,04, –0,50 ± 0,01 и –0,56 ± 0.02 % соответственно. В отведениях от препарата ИПМ все показатели ФМПА амплитуды ритмов ЭКоГ были положительными и варьировали от 8,40 ± 0,16 до 27,30 ± 0,52 %, т.е. ЭКоГ-активность по амплитуде была отчетливо «латерализована» в левое полушарие.
