
Лабораторная работа №3.
Потенциалы электродов и э.д.с. гальванического элемента.
Теория.
1. Гальванический элемент.
Простейший гальванический элемент включает в себя два металлических электрода, погруженных в растворы электролитов. Растворы электролитов разделены пористой перегородкой во избежание их перемещения. Через пористую перегородку могут проникать ионы электролитов. На границах раздела фаз в гальваническом элементе возникают скачки потенциала вследствие перехода носителей электричества из одной фазы в другую. В результате на концах (электродах) гальванического элемента возникает разность электрических потенциалов, называемая электродвижущей силой (э.д.с.):
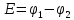 (1)
(1)
Уравнение для реакции, протекающей в гальваническом элементе:
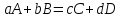 (2)
(2)
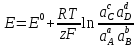 (3)
(3)
Величина Е0 называется стандартной э.д.с. элемента. Она равна Е, когда активности веществ аi равны единице.
Необходимо обратить внимание на то, что в уравнении Нернста z численно равно n, но является безразмерной величиной, как и коэффициенты a, b, c, d. размерности «моль» при n и стехиометрических коэффициентах a, b, c, d в уравнении Нернста сокращаются. Таким образом, число z в уравнении Нернста – это число электронов, участвующих в элементарной электрохимической реакции на любом из электродов; при определении z необходимо проставить стехиометрические коэффициенты в уравнении реакции.
Гальванический элемент согласно Международной конвенции записывают так, чтобы при его работе электрический ток внутри элемента протекал слева направо. Например, гальванический элемент Даниэля-Якоби записывают так:
 ,
,
так как при его работе протекает реакция:
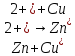
и ионы Zn2+ и Cu2+ движутся слева направо. Напомним, что за направление тока принято направление движения положительно заряженных частиц. Уравнение Нернста согласно (3) записывают в виде:
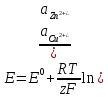 (4)
(4)
Активности твердых веществ (Zn и Cu) равны 1. В числителе под знаком логарифма записывают активности (концентрации) ионов, вступающих в реакцию, в степенях, равных коэффициентам в уравнении реакции.
2. Потенциалы электродов.
Как следует из определения э.д.с., ее можно представить как разность потенциалов двух отдельных электродов. Поскольку абсолютное значение потенциала электродов невозможно измеряют разность потенциалов между исследуемым электродом и электродом сравнения, потенциал которого условно принимают равным нулю. В качестве электрода сравнения используют стандартный (нормальный) водородный электрод (н.в.э.), который представляет собой платиновую пластину, погруженную в раствор кислоты с аН+=1 и омываемую потоком газообразного водорода при давлении рН2=1атм.
Согласно Международной конвенции при определении потенциалов отдельных электродов водородный электрод необходимо записывать слева. Например, при определении потенциала цинкового электрода следует записать:
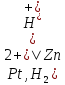 (5)
(5)
В гальваническом элементе устанавливается равновесие реакции:
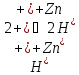 (6)
(6)
и возникает разность потенциалов, определяемая уравнением, аналогичным уравнению Нернста:
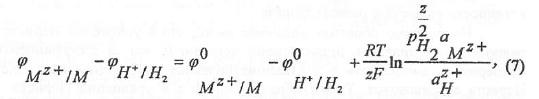
где подстрочные индексы указывают систему, к которой относятся потенциалы. Уравнение (7) легко преобразовать к виду:
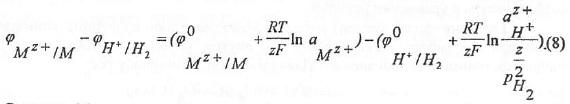
Согласно Международной конвенции потенциал стандартного (нормального) водородного электрода условно принят равным нулю при любой температуре:
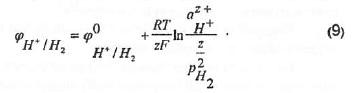
Учитывая,
что аН+=1
и рН2=1,
это эквивалентно принятию нулю значения
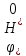 .
Таким образом, значение электродного
потенциала по отношению к потенциалу
стандартного (нормального) водородного
электрода (н.в.э.) можно вычислить по
формуле:
.
Таким образом, значение электродного
потенциала по отношению к потенциалу
стандартного (нормального) водородного
электрода (н.в.э.) можно вычислить по
формуле:
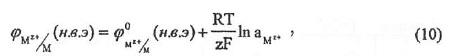
где
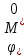 (н.в.э.)
– стандартное значение потенциала
электрода в водородной шкале потенциалов.
Значения
(н.в.э.)
– стандартное значение потенциала
электрода в водородной шкале потенциалов.
Значения
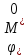 (н.в.э.)
приведены в справочниках. Следует
отметить, что в отличие от э.д.с., значения
которой всегда больше нуля, значения
потенциалов электродов могут быть
отрицательными. В этом случае при работе
гальванического элемента (5) будет
протекать реакция, обратная записанной
в (6).
(н.в.э.)
приведены в справочниках. Следует
отметить, что в отличие от э.д.с., значения
которой всегда больше нуля, значения
потенциалов электродов могут быть
отрицательными. В этом случае при работе
гальванического элемента (5) будет
протекать реакция, обратная записанной
в (6).
Ряд стандартных значений потенциалов металлических электродов в водородного электрода называется рядом напряжений металлов. Согласно этому ряду металлы с отрицательным значением φ0 вытесняют водород из растворов кислот, а металлы с меньшим значением φ0 вытесняют из растворов солей металлы с большим значением φ0.
Зная потенциалы электродов, легко можно вычислить э.д.с. гальванического элемента, составленного из двух полуэлементов. Так как ЕЮ0, то для вычисления э.д.с. нужно из большего потенциала вычесть меньший. Например, для гальванического элемента Даниэля-Якоби:

Экспериментальная часть.
