
- •1. Термодинамика как наука. Основные параметры состояния газа. Уравнение состояния идеального газа.
- •2. Смесь идеальных газов. Теплоемкость газа.
- •3. Основные функции состояния газа (внутренняя энергия, энтальпия и энтропия газа).
- •4. Основные понятия и определения процесса обмена теплотой.
- •5. Процесс передачи теплоты теплопроводностью. Закон Фурье.
- •6. Процесс теплового излучения. Закон Стефана-Больцмана.
- •7. Поглощательная, отражательная и пропускная способности тела.
- •8. Процесс теплопередачи
- •9. Теплообменные аппараты.
- •10. Микроклимат помещения.
- •11. Тепловой и воздушный режимы здания. Сопротивление теплопередаче ограждающих конструкций.
- •12 Фильтрация. Сопротивление воздухопроницанию конструкций.
- •13 Конденсация влаги. Сопротивление паропроницанию конструкций.
- •14. Тепловой баланс жилых зданий. Теплопотери и теплопоступления в помещения.
- •15. Определение тепловой мощности системы отопления. Удельная тепловая характеристика здания.
- •16. Летний тепловой режим помещения.
- •17 Понятие о системах отопления. Требования, предъявляемые к ним
- •18 Классификация систем отопления
- •19 Система водяного отопления с естественной циркуляцией воды
- •20 Размещение элементов системы отопления в зданиях
- •21 Отопительные приборы. Классификация, виды, характеристики.
- •22 Тепловой расчет отопительных приборов.
- •23 Схемы присоединения приборов к теплопроводам. Регулирование теплоотдачи приборов
- •24 Гидравлический расчет трубопроводов систем отопления с естественной циркуляцией.
- •25 Гидравлический расчет трубопроводов системы отопления с искусственной циркуляцией.
- •26. Понятие о горизонтальных систем отопления
- •27. . Понятие о низкотемпературных системах отопления
- •28 Проектирование вентиляционных систем с рекуперацией тепла
- •29.Типы систем поквартирного отопления.
- •30.Устройство систем вентиляции с рекуперацией тепла.
- •31.Понятие о тепловых насосах.
- •32.Особенности гидравлического расчета систем горизонтального отопления.
- •33. Проблемы проектирования, сооружения и эксплуатации систем вентиляции с рекуперацией тепла.
- •34. Печное отопление.
- •35.Газовое отопление
- •36.Отопление многоэтажных зданий.
- •37.Аэродинамический расчет систем вентиляции.
- •38.Системы вентиляции, их классификация.
- •39.Схемы организации воздухообмена в помещении.
- •40 Обработка приточного воздуха. Приточные центры.
- •41.Электрическое отопление.
- •42.Вентиляция жилых зданий. Элементы систем вытяжной естественной вентиляции.
- •43 Системы парового отопления, их классификация.
- •44) Система парового отопления низкого давления.
- •45 Панельно-лучистое отопление.
- •46.Системы воздушного отопления
- •47.Системы механической вентиляции, конструктивные элементы и их размещение.
- •48) Понятие о кондиционировании воздуха. Классификация систем кондиционирования воздуха.
- •49) Установки кондиционирования воздуха ( центральный кондиционер, местный кондиционер).
- •50) Борьба с шумом и вибрацией в системах вентиляции.
- •51.Понятие вентиляции. Параметры микроклимата в вентилируемых помещениях. Воздухообмен в помещении.
- •52. Влажный воздух, основные характеристики,I-d диаграмма влажного воздуха.
- •53) Схемы присоединения потребителей к тепловым сетям. Тепловой пункт.
- •54. Аэродинамический расчет систем вентиляции.
- •55. Воздухообмен. Способы организации воздухообмена.
- •56) Топочные устройства.
- •57) Тепловые сети.
- •58.Трубы для устройства систем отопления.
- •59. Котельные установки.
- •60. Подбор циркуляционных насосов в систему отопления
- •61. Теплоснабжение строительной площадки
- •62. Использование нетрадиционных источников тепла
- •63. Местное отопление.
- •64. Холодоснабжение
- •65. Газовые распределительные сети
- •66)Топливо. Основные характеристики топлива.
- •67. Техника безопасности при эксплуатации газопроводов.
- •68) Природный и сжиженный газы.
- •69) Прокладка газопроводов в зданиях.
- •70. Газораспределительный пункт (грп) и установки (гру).
- •71. Обслуживание систем газоснабжения. Техника безопасности при строительстве и эксплуатации систем газоснабжения.
- •72. Устройство газоснабжения в зданиях.
- •73) Тепловой баланс котлоагрегата и его кпд. Потери теплоты в котельном агрегате.
- •74. Понятия об энергоэффективных зданиях.
- •75)Централизованное теплоснабжение.
- •76. Классы жилых и общественных зданий по потреблению тепловой энергии на отопление и вентиляцию.
- •77. Нормативные теплотехнические показатели зданий.
- •78) Местная вентиляция.
- •79) Вторичные энергетические ресурсы (вэр) и возобновляемые источники энергии.
- •80.Вентиляторы. Вытяжные центры.
1. Термодинамика как наука. Основные параметры состояния газа. Уравнение состояния идеального газа.
Термодинамика – это наука о свойствах энергии в различных ее
видах, а также о закономерностях перехода энергии от одних тел к другим
и из одного вида в другой. Основой этой науки являются два закона при-
роды:первый и второй законы термодинамики.
Фундаментальными понятиями технической термодинамики являются теплота(характеризует энергию, передаваемую от одного тела к другому
микрофизическим путем) и работа(характеризует энергию, предаваемую от одного тела к другому макрофизическим путем). Оба эти понятия неразрывно связаны с процессами передачи энергии от одних тел к другим.
В термодинамике введено два понятия о газе. Газы, молекулы которых обладают силами взаимодействия и имеют конечные, хотя и весьма
малые геометрические размеры, называются реальными газами. Газы, молекулы которых не обладают силами взаимодействия, а сами молекулы
представляют собой материальные точки с ничтожно малыми объемами,
называются идеальными газами.
Физические величины, характеризующие рабочее тело в состоянии равновесия, называют термодинамическими параметрами состояния. К основным параметрам состояния газов относятся: давление, абсолютная температура и удельный объем.
Давлением вообще называется сила, действующая на единицу площади поверхности тела перпендикулярно последней.
Абсолютная температура газа является мерой интенсивности хаотического движения его молекул. Это параметр, характеризующий тепловое состояние тела. Абсолютная температура всегда положительна, а нулевое значение ее соответствует состоянию полного покоя молекул.
Удельный объем – это величина, представляющая собой отношение объема газа V , м3, к заключенной в нем массе M , кг,
Термодинамические параметры идеального газа в любом его состоянии связаны зависимостью р ⋅ Vm = R ⋅T , которая и представляет собой уравнение состояния идеального газа . Впервые эта зависимость была получена Клапейроном и поэтому часто называется уравнением Клапейрона.
Умножая обе части равенства на массу газа M и учитывая, что
M ⋅ Vm =V , получается уравнение состояния произвольного количества идеального газа: р ⋅V = M ⋅ R ⋅T .
2. Смесь идеальных газов. Теплоемкость газа.
В теплотехнике гораздо чаще имеют дело с газовыми смесями, нежели с отдельно взятыми однородными газами. Под смесью идеальных
газов понимается механическая смесь различных газов при условии отсутствия в них химических реакций, т.е. химически между собой не взаи-
модействующих. Смесь идеальных газов подчиняется всем законам для
идеального газа. Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми или объемными долями. Массовая доля – отношение массы отдельного газа , входящего в
смесь, к массе всей смеси .
Каждый компонент смеси занимает весь располагаемый объем, в ко-
тором заключена смесь, и соответственно оказывает на стенки сосуда свое
так называемое парциальное давление.
Сумма парциальных давлений всех компонентов газовой смеси равна
общему (абсолютному) давлению газовой смеси.
Это положение называется законом Дальтона. Определить парциальное давление проще всего, если известны объемные доли компонентов смеси
pi=p⋅ri
Теплоёмкость идеального газа — отношение количества теплоты, сообщённого газу, к изменению температуры δТ, которое при этом произошло.
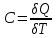
Теплоемкостью тела в каком либо процессе изменения его состояния называется количество теплоты, необходимой для повышения его темпер на один градус. Теплоемкость, отнесенная к единице количества вещества, является его удельной теплоемкостью, однако обычно ее тоже называют просто теплоемкостью. В зависимости от того, к какой единице количества вещества ее относят, различают массовую, объемную и мольную теплоемкости. Соответственно, единицы измерения кДж/(кг⋅град), кДж/(м3⋅град) и кДж/(кмоль⋅град). Количество теплоты, подводимой для повышения температуры на 1°, существенным образом зависит от характера процесса. Особое значение для нагревания или охлаждения газа имеют условия, при которых происходит процесс подвода или отвода теплоты. В теплотехнике наиболее важным является нагревание (или охлаждение) при постоянном объеме и нагревание (или охлаждение) при постоянном давлении. Теплоемкость в первом случае называется изохорной, а во втором – изобарной и обозначается соответственно сυ и ср..
Связь между этими теплоемкостями устанавливается уравнением
Майера ср.= сυ+R.
