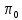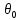Министерство образования и науки Российской Федерации
Государственное образовательное учреждение
высшего профессионального образования
“Ивановский Государственный энергетический университет
им. В.И. Ленина”
Кафедра ТОТ
Контрольная работа
по курсу
«Техническая термодинамика ч.1»
Выполнил:
Студент гр. 2-75
Беляев А.Н. (512002)
Иваново 2014.
Содержание:
|
3 |
|
3 |
|
3 |
|
5 |
|
7 |
|
10 |
|
10 |
|
13 |
|
16 |
Контрольная работа 1.
Задание 1: Провести расчет процесса закономерного (политропного) изменения состояния смеси идеальных газов и изобразить этот процесс в P,V- и T,s-диаграммах.
Задание 1.1 «Расчет основных характеристик смеси идеальных газов».
Исходные данные задания 1.1.
|
№ |
N4 |
N5 |
Газ 1 |
Газ 2 |
μ1, кг/кмоль |
μ2, кг/кмоль |
μcvсм, Дж/(кмоль∙К) |
|
2 |
0 |
0 |
H2 |
CH4 |
2 |
16 |
22864 |
Выполнение задания 1.1:
Определение мольной изобарной теплоемкости газов:
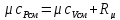
где
Rμ
– универсальная
газовая постоянная (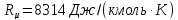 );
);

Объемные доли определяются на основании уравнения мольной теплоемкости смеси газов и равенства r1+r2=1:

и мольных теплоемкостей каждого из газов:


где i – число степеней свободы данного газа.
Подставим мольные теплоемкости газов 1 и 2 в уравнения мольной теплоемкости смеси этих газов, получим объемные доли r1 и r2:
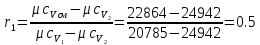

Далее находим условную мольную массу смеси газов:

Расчет массовых долей смеси газов:

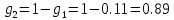
Определение газовой постоянной смеси газов:
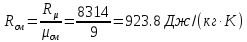
Расчет удельных массовых изохорных и изобарных теплоемкостей смеси газов:

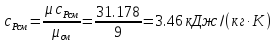
Определение коэффициента Пуассона смеси газов:
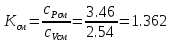
Таблица: «Характеристики смеси идеальных газов»
|
Газ 1 – H2, газ 2 – CH4 |
||||||||||
|
g1 |
g2 |
r1 |
r2 |
μсм, кг/кмоль |
Rсм, Дж/(кг ∙К) |
μcVсм, Дж/(кмоль∙К) |
μcPсм, Дж/(кмоль∙К) |
cVсм, кДж/(кг∙К) |
cPсм, кДж/(кг∙К) |
Kсм |
|
0.11 |
0.89 |
0.5 |
0.5 |
9 |
923.8 |
22864 |
31178 |
2.54 |
3.46 |
1.362 |
Задание 1.2 «Расчет политропного процесса смеси идеальных газов».
Исходные данные задания 1.2.
|
№ |
N4 |
N5 |
P1, МПа |
V1, м3/кг |
Процесс 1-2 |
P2, МПа |
|
2 |
0 |
0 |
0.01 |
11.645 |
T-const |
0.05 |
Выполнение задания 1.2:
Определение термических параметров газового процесса.
Определение термических параметров газа в начале и конце процесса ведется по закономерностям обратимого изотермического процесса и уравнению состояния идеального газа:
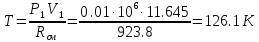
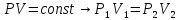

Таблица: «Термические параметры начального и конечного состояний смеси идеальных газов политропного процесса»
|
P1, МПа |
t1, °C |
V1, м3/кг |
P2, МПа |
t2, °C |
V2, м3/кг |
|
0.01 |
-147.05 |
11.645 |
0.05 |
-147.05 |
2.329 |
Определение энергетических характеристик газового процесса.
Энергетические характеристики газового процесса рассчитываются по первому закону термодинамики с учетом закономерностей процесса. Процесс обратимый изотермический, следовательно, изменение внутренней энергии и энтальпии равны нулю (ΔU=0, Δh=0), а работа изменения объема равна теплоте процесса:
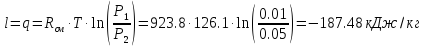
Изменение энтропии определяется как:
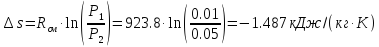
Таблица: «Результаты расчета политропного процесса смеси идеальных газов»
|
Процесс (изотермический) |
n |
q, кДж/кг |
l, кДж/кг |
ΔU, кДж/кг |
Δh, кДж/кг |
Δs, кДж/(кг∙К) |
|
T=const |
1 |
-187.48 |
-187.48 |
0 |
0 |
-1.487 |
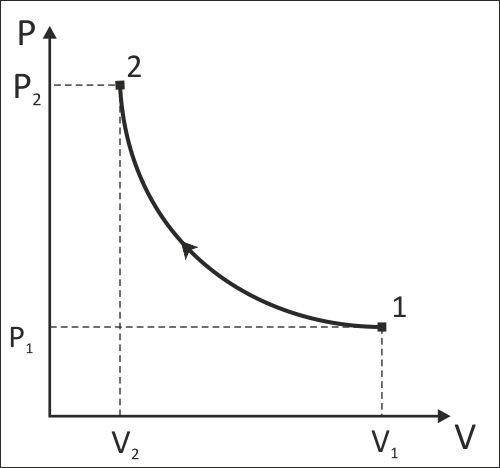
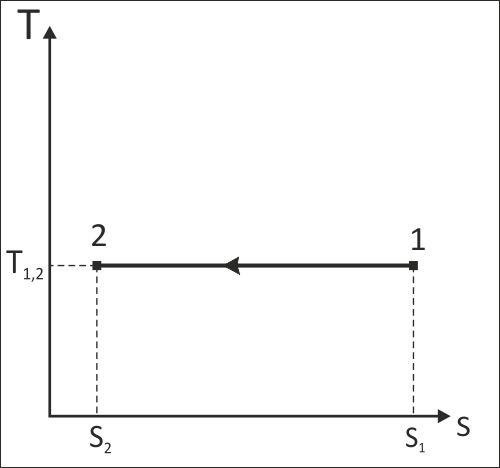
Схематичное изображение расчетного изотермического процесса смеси идеальных газов 1-2 в P,V- и T,s-диаграммах.
Качественный и количественный анализ процесса:
Работа изменения объема данного процесса отрицательная (l<0), т.к. объем газа уменьшается (V2<V1), изменение внутренней энергии и энтальпии равны нулю (ΔU=0, Δh=0), т.к. процесс изотермический (T=const). Первый закон термодинамики в данном расчете выполняется: ΔU=0; q-l=-187.48+187.48=0.
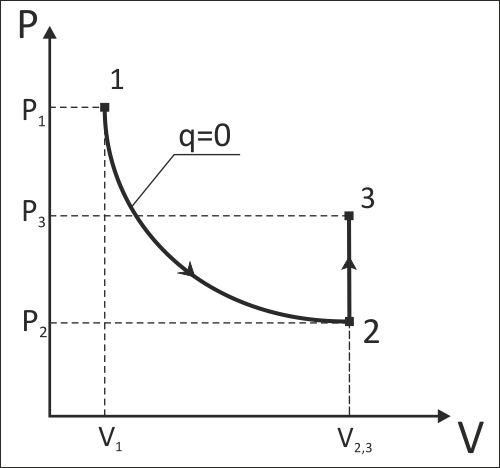
Задание 2: Выполнить расчет комбинированного процесса 1-2-3 идеального воздуха, с учетом влияние температуры на его изобарную и изохорную теплоемкости, т.е. при ср=f(t) и сv=f(t). Процесс 1-2 – обратимый адиабатный (s=const), а 2-3 – изохорный (V=const) или изобарный (P=const).
Исходные данные задания 2.
|
№ |
N4 |
N5 |
t1, °C |
V1, м3/кг |
Процесс 1-2 |
P2, МПа |
Процесс 2-3 |
P3, МПа |
|
2 |
0 |
0 |
175 |
0.2573 |
s=const |
0.1 |
V=const |
0.16 |
Выполнение задания 2:
Определение термических параметров и энергетических характеристик в характерных точках процесса 1-2-3.
Адиабатный процесс 1-2:
По уравнению состояния идеального газа найдем давление в начальной точке процесса:
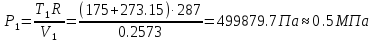
где
R
– удельная
газовая постоянная для сухого воздуха
(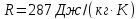 ).
).
По таблице свойств идеального воздуха найдем его термодинамические параметры при t1=175°C:
|
t, °C |
T, К |
h, кДж/кг |
U, кДж/кг |
|
|
s0, кДж/(кг∙К) |
|
175 |
448.15 |
450.04 |
321.38 |
5.6911 |
2260.7 |
7.11 |
Рассчитываем
 во второй точке процесса по отношению
давлений адиабатного процесса:
во второй точке процесса по отношению
давлений адиабатного процесса:
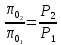
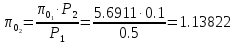
По
величине
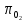 определяем по таблице термодинамических
свойств идеального воздуха его температуру
и калорические параметры:
определяем по таблице термодинамических
свойств идеального воздуха его температуру
и калорические параметры:
|
|
t, °C |
T, К |
h, кДж/кг |
U, кДж/кг |
|
s0, кДж/(кг∙К) |
|
1.13822 |
10 |
283.15 |
283.35 |
202.06 |
7179 |
6.6464 |
Задавшись (произвольно) величиной P0=1 бар, рассчитываем абсолютные значения энтропий:
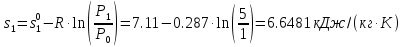

Равенство значений энтропии s1=s2 (в пределах погрешности расчета) указывает на правильность определения параметров обратимого адиабатного процесса.
По уравнению состояния идеального газа найдем объем в конечной точке процесса:

Разность энтальпий, разность внутренних энергий и работа изменения объема для адиабатного процесса 1-2 определяется в соответствии с первым законом термодинамики:

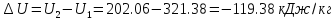


Изохорный процесс 2-3:
Определяем температуру в конечной точке процесса по уравнению состояния идеального газа:

По таблице свойств идеального воздуха найдем его термодинамические параметры при t3=180°C:
|
t, °C |
T, К |
h, кДж/кг |
U, кДж/кг |
s0, кДж/(кг∙К) |
|
180 |
453.04 |
455.15 |
325.05 |
7.1213 |
Задавшись (произвольно) величиной P0=1 бар, рассчитываем абсолютные значения энтропии:

Рассчитываем изменение энтальпии и внутренней энергии. Теплота в изохорном процессе равна изменению внутренней энергии, т.к. работа изменения объема равна нулю:
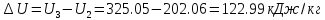
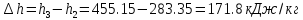
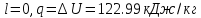
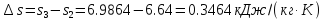
Определяем теплоту, работу изменения объема, изменение внутренней энергии, энтальпии и энтропии на всем процессе 1-2-3:



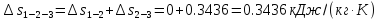
Таблица: «Результаты расчета процесса 1-2-3»
|
Точка |
P, МПа |
t, °C |
V, м3/кг |
U, кДж/кг |
h, кДж/кг |
s, кДж/(кг∙К) |
|
1 |
0.5 |
175 |
0.2573 |
321.38 |
450.05 |
6.64 |
|
2 |
0.1 |
10 |
0.8126 |
202.06 |
283.35 |
6.64 |
|
3 |
0.16 |
180 |
0.8126 |
325.05 |
455.15 |
6.9864 |
|
Процесс |
q, кДж/кг |
l, кДж/кг |
ΔU, кДж/кг |
Δh, кДж/кг |
Δs, кДж/(кг∙К) |
|
|
1-2 |
0 |
119.38 |
-119.38 |
-166.7 |
0 |
|
|
2-3 |
122.99 |
0 |
122.99 |
171.8 |
0.3464 |
|
|
1-2-3 |
122.99 |
119.38 |
3.61 |
5.1 |
0.3436 |
|
Схематичное изображение 1-2-3 процесса идеального воздуха в P,V- и T,s-диаграммах.