
- •Министерство образования и науки Российской Федерации
- •Научный редактор
- •Введение
- •1. Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.1. Задачи
- •1.2. Контрольные вопросы
- •2. Законы и уравнения состояния идеальных газов. Смеси идеальных газов
- •2.1. Задачи
- •2.2. Контрольные вопросы
- •3. Теплоемкости газов и газовых смесей
- •3.1. Задачи
- •3.2. Контрольные вопросы
- •4. Первый закон термодинамики для закрытой системы
- •4.1. Задачи
- •4.2. Контрольные вопросы
- •5. Политропные процессы изменения состояния идеальных газов
- •5.1. Задачи
- •5.2. Особенности расчета процессов идеальных газов при учете влияния температуры на их изобарную и изохорную теплоемкости
- •5.3. Задачи
- •5.4. Контрольные вопросы
- •6. Термодинамические свойства воды и водяного пара. Процессы водяного пара
- •6.1. Задачи
- •6.2. Контрольные вопросы
- •7. Влажный воздух
- •Основные характеристики влажного воздуха
- •Характеристики атмосферного влажного воздуха
- •Область влажного ненасыщенного воздуха h,d- диаграммы
- •Область перенасыщенного влажного воздуха h,d- диаграммы
- •Пример пользования h,d- диаграммой
- •7.1. Задачи
- •7.2. Контрольные вопросы
- •8. Второй закон термодинамики
- •8.1. Задачи
- •8.2. Контрольные вопросы
- •9. Первый закон термодинамики для потока. Работа изменения давления в потоке. Эксергия в потоке
- •Работа изменения давления в потоке для адиабатных процессов
- •Эксергия в потоке
- •9.1. Задачи
- •9.2. Контрольные вопросы
- •10. Истечение газа и пара через сопловые каналы
- •Особенности расчета процесса истечения через сопло реальных веществ
- •Необратимое истечение газов и паров через сопло
- •Процессы торможения. Параметры заторможенного потока
- •Методика расчета соплового канала при истечении через него газа или пара с начальной скоростью больше нуля
- •10.1. Задачи
- •10.2. Контрольные вопросы
- •11. Дросселирование газов, паров и жидкостей
- •11.1. Задачи
- •11.2. Контрольные вопросы
- •12. Процессы смешения газов и паров
- •Смешение в объёме
- •Смешение в потоке
- •Смешение при заполнении объёма
- •12.1. Задачи
- •12.2. Контрольные вопросы
- •13. Циклы двигателей внутреннего сгорания
- •Цикл двс с подводом теплоты к рабочему телу при постоянном объеме
- •Цикл двс с подводом теплоты к рабочему телу при постоянном давлении
- •Цикл двс со смешанным подводом теплоты к рабочему телу
- •13.1. Задачи
- •13.2. Контрольные вопросы
- •14. Циклы воздушных реактивных двигателей
- •Цикл прямоточного врд
- •Цикл турбокомпрессорного врд
- •14.1. Задачи
- •14.2. Контрольные вопросы
- •15. Циклы газотурбинных установок
- •Методика расчета тепловой экономичности обратимого цикла гту
- •Тепловая экономичность реального цикла гту
- •Регенеративный цикл гту
- •Регенеративный цикл гту с двухступенчатым сжатием и расширением рабочего тела
- •15.1. Задачи
- •15.2. Контрольные вопросы
- •16. Циклы паротурбинных установок
- •16.1. Базовый цикл пту – цикл Ренкина
- •Расчет простого обратимого цикла пту
- •Расчет необратимого цикла простой пту
- •Система кпд цикла пту
- •16.2. Цикл пту с вторичным перегревом пара
- •16.3. Регенеративный цикл пту
- •Выбор оптимальных давлений отборов пара турбины на регенеративные подогреватели пту
- •Особенности расчета регенеративных пту с подогревателями поверхностного типа
- •16.4. Теплофикационные циклы пту
- •Теплофикационные пту с отборами пара на тепловые потребители
- •16.5. Термодинамические особенности расчета циклов аэс на насыщенном водяном паре
- •16.6. Задачи
- •16.7. Контрольные вопросы
- •17. Циклы парогазовых установок
- •17.1. Цикл пгу с котлом-утилизатором
- •17.2. Циклы пгу со сжиганием топлива в паровом котле
- •Цикл пгу с низконапорным парогенератором
- •Цикл пгу с высоконапорным парогенератором
- •Полузависимая пгу
- •17.3. Задачи
- •17.4. Контрольные вопросы
- •18. Циклы холодильных установок и тепловых насосов
- •18.1. Цикл воздушной холодильной установки (вху)
- •Методика расчета вху
- •18.2. Цикл парокомпрессорной холодильной установки
- •Методика расчета цикла пкху
- •18.3. Парокомпрессорный цикл теплового насоса
- •Методика расчета цикла парокомпрессорного теплового насоса
- •18.4. Задачи
- •18.5. Контрольные вопросы
- •Заключение
- •Библиографический список
- •Приложения
- •Оглавление
- •Чухин Иван Михайлович
- •Редактор н.Б. Михалева
- •153003, Г. Иваново, ул. Рабфаковская, 34.
11.2. Контрольные вопросы
1. Приведите примеры технических устройств, в которых идут процессы дросселирования потока вещества.
2. Напишите уравнение адиабатного процесса дросселирования и охарактеризуйте изменение энтальпии, скорости и давления газа (пара) в этом процессе.
3. Объясните, чем вызвано снижение давления газа (пара) в процессе дросселирования.
4. Покажите в h,s- диаграмме, как изменяются работа изменения давления и эксергия потока вещества в процессе его дросселирования.
5. Как изменяется температура идеального газа в процессе его дросселирования ?
6. Объясните, чем вызвано изменение температуры в процессах дросселирования реальных газов, паров и жидкостей – эффект Джоуля–Томсона.
7. Покажите в h,s- диаграмме процесс дросселирования водяного пара с уменьшением его температуры и фазовым переходом из области перегретого пара в область влажного насыщенного пара.
8. Покажите в h,s- диаграмме процесс дросселирования жидкой фазы воды с увеличением ее температуры.
12. Процессы смешения газов и паров
Смесь из нескольких веществ, находящихся в газообразном или жидком состоянии, может быть получена при осуществлении процесса смешения по одному из следующих способов:
– смешение в объёме;
– смешение в потоке;
– смешение при заполнении объёма.
Смешение в объёме
Смешение в объёме – это смешение веществ (газов, паров, жидкостей) за счёт их взаимного диффузионного проникновения после удаления (разрушения) разделяющих их непроницаемых перегородок и без изменения суммарного объёма веществ (рис.12.1).
Определение параметров газа (пара) после процесса смешения ведется по известному массовому составу и параметрам газов до смешения с использованием следующих уравнений.
Масса смеси равна сумме масс смешивающихся газов:
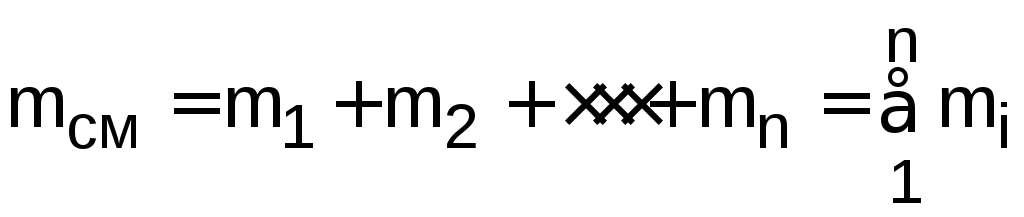 ,
,
а объём – сумме первоначальных объёмов этих газов:
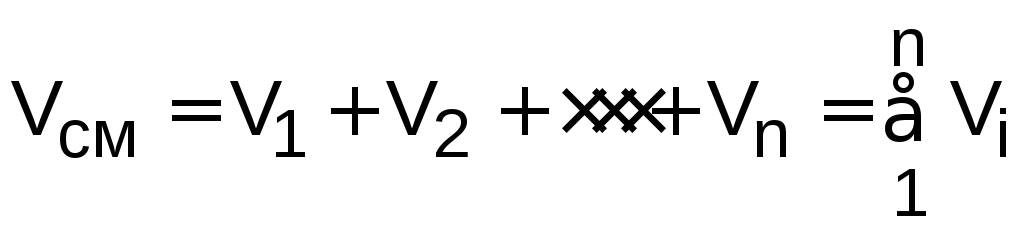 ;
;
удельный объём смеси газов
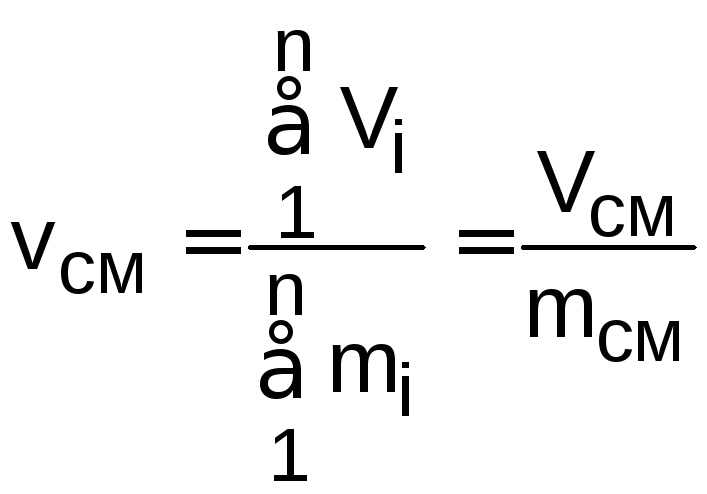 ,
(12.1)
,
(12.1)
где n – число смешивающихся компонентов газа.
При адиабатном смешении газов (Q=0) изменения внутренней энергии в системе нет (U=0), т.е. внутренние энергии газов после процесса их смешения равны сумме внутренних энергий этих газов до смешения:
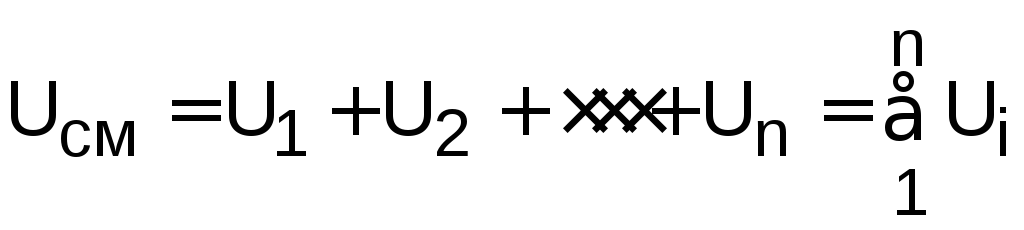 .
(12.2)
.
(12.2)
После деления выражения (12.2) на массу смеси, получим расчётное выражение удельной внутренней энергии газа после смешения:
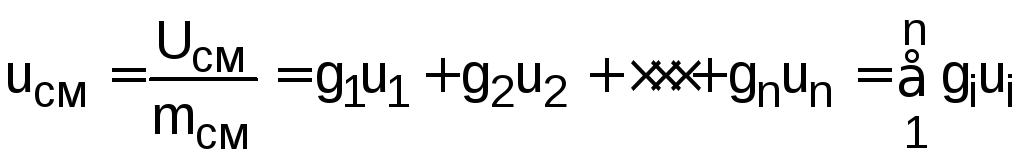 ,
(12.3)
,
(12.3)
где gi – массовые доли компонентов смеси газов.
У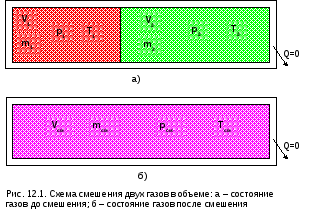 дельный
объём (vсм)
и удельная внутренняя энергия (uсм)
определяют состояние газа после смешения.
По ним могут быть найдены остальные
параметры смеси: tсм,
рсм,
sсм
и т.д..
дельный
объём (vсм)
и удельная внутренняя энергия (uсм)
определяют состояние газа после смешения.
По ним могут быть найдены остальные
параметры смеси: tсм,
рсм,
sсм
и т.д..
Изменение энтропии системы за счет необратимости процесса смешения определяется как сумма изменений энтропий компонентов смеси газа:
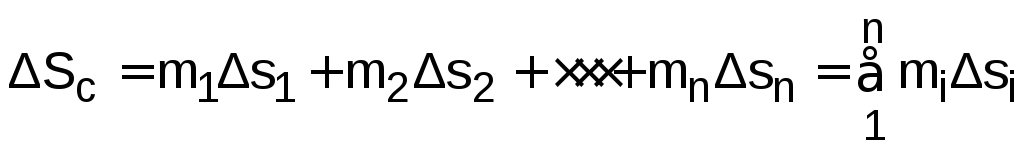 ,
(12.4)
,
(12.4)
где Δsi=siсм-si – изменение энтропии одного из компонентов смеси газа при изменении его состояния от начальных параметров до параметров смеси.
Для идеальных газов внутренняя энергия – функция только температуры, и поэтому расчетные выражения для процесса смешения в объеме идеальных газов будут иметь следующий вид:
выражение (12.3) примет вид
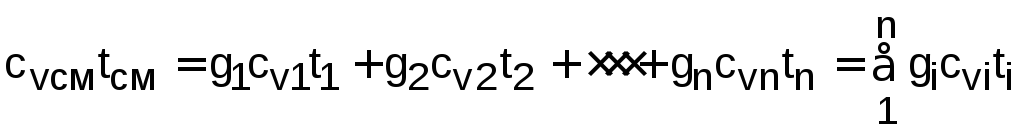 ;
(12.5)
;
(12.5)
расчётное выражение для температуры смеси идеальных газов
 ,
(12.6)
,
(12.6)
где cvi – массовые изохорные теплоёмкости компонентов смеси газов;
ti – температура компонентов смеси газов до начала процесса смешения, oC.
Выражение (12.6) справедливо и при подстановке в него всех температур по абсолютной шкале Кельвина.
Зная Vсм и Tсм для идеальных газов, можно определить давление смеси, используя уравнение состояния идеального газа
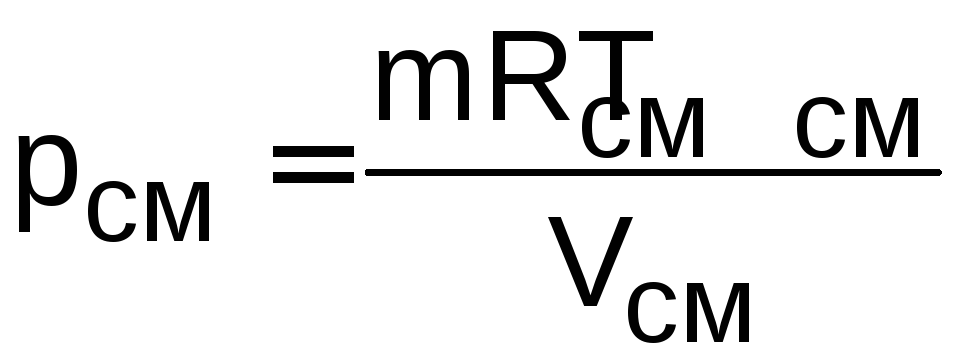 ,
,
где
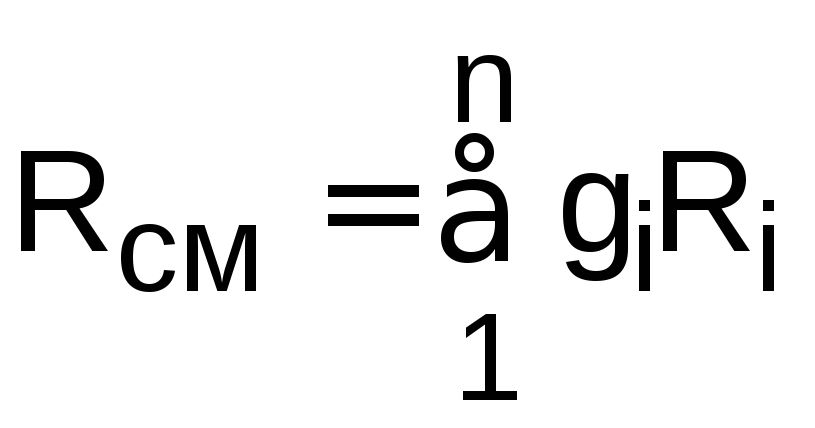 .
.
Изменение энтропии системы в расчёте на 1 кг смеси определяется как сумма изменений энтропий компонентов смеси газа:
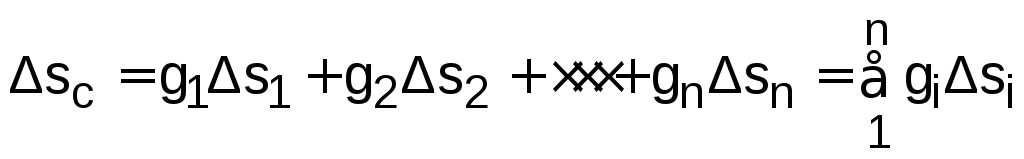 .
(12.7)
.
(12.7)
Для идеальных газов Δsi рассчитывается по формулам идеальных газов через любую пару параметров. Например, используя температуру и давление данного компонента смеси газа до и после смешения, его изменение удельной энтропии определяются как
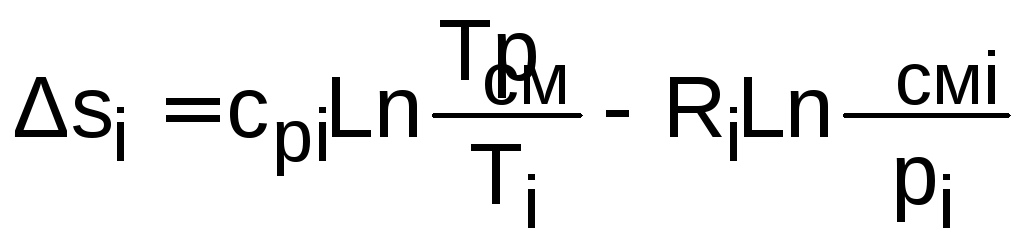 ,
(12.8)
,
(12.8)
где
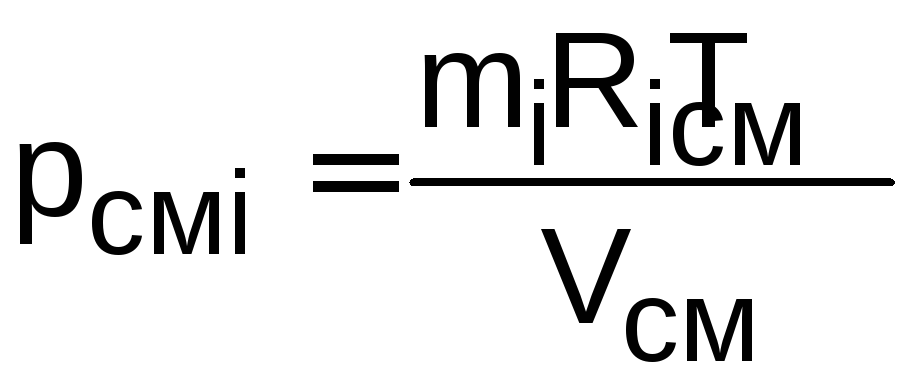 – парциальное давление данного компонента
смеси газа при температуре смеси, когда
этот газ занимает весь объем, также
– парциальное давление данного компонента
смеси газа при температуре смеси, когда
этот газ занимает весь объем, также![]() ,
где объемная доля данного компонента
смеси газа может быть определена через
массовую долю как
,
где объемная доля данного компонента
смеси газа может быть определена через
массовую долю как
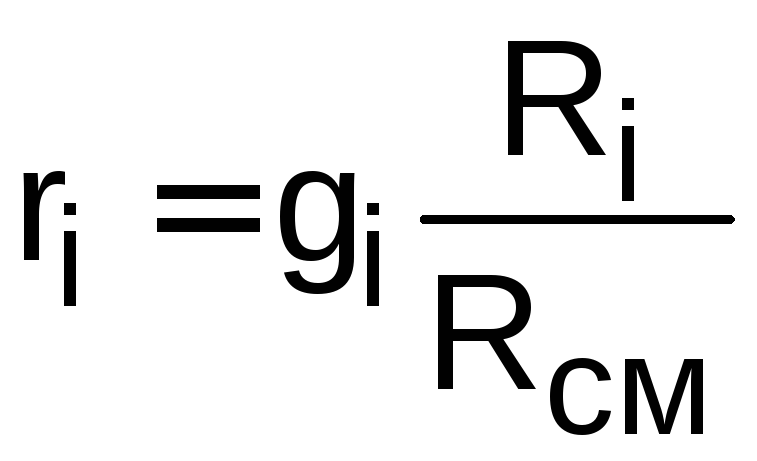 .
.
Потеря
потенциальновозможной полезной работы
газа (эксергии) в этом необратимом
процессе определяется традиционно по
теореме Гюи–Стодолы [1] как
![]() .
.
