
Лекция_АХ3
.pdfЛЕКЦИЯ 3
МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ В АНАЛИЗЕ
1.Осаждение и соосаждение
2.Сорбция.
3.Экстракция.
4.Электрофорез.
5.Диализ и электродиализ.
6.Другие методы разделения и концентрирования.
7.Хроматография
МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ В АНАЛИЗЕ
Методами маскирования не всегда удаётся повысить специфичность аналитических сигналов. В этом случае прибегают к методам разделения веществ.
Кроме того, учитывая существующий предел обнаружения сигнала, при анализе микропримесей их необходимо сконцентрировать – увеличить их концентрацию. Для этого прибегают к методам концентрирования. Часто разделение и концентрирование осуществляется одновременно, слито в один метод.
1.Осаждение и соосаждение
Воснове всех разделений методом осаждения лежит различие в растворимости соединений определяемого и нежелательных элементов. Теоретическая возможность и условия успешного разделения определяются главным образом величинами произведений растворимости. Используют органические и неорганические осадители.
Типы осадков:
1.Кислоты и гидроксиды (H2SiO3, H2SnO3, H2WO4, Al(OH)3, Fe(OH)3).
2.Малорастворимые соединения некоторых кислот (MeS, MeSO4, MeCO3, MePO4, MeClx и др.).
3.Осадки с органическими реагентами (малорастворимые хелаты и ионные ассоциаты).
4.Вещества, выделяемые в элементном состоянии (Hg, Se, Te, Au). Специфичность (селективность) осаждения можно увеличить, варьируя
pH раствора. В табл. 3.1 приведены значения рН начала осаждения некоторых гидроксидов из водных растворов:
Таблица 3.1. Значения pH осаждения гидроксидов
pH |
Ион металла |
3 |
Fe(III), Zr(IV), Sn(II) |
4 |
Th(IV), U(VI) |
5 |
Al3+ |
6 |
Zn2+, Be2+, Cu2+, Cr3+ |
7 |
Fe2+, Pb2+ |
8 |
Co2+, Ni2+, Cd2+ |
9 |
Ag+, Mn2+, Hg2+ |
11 |
Mg2+ |
Из данных табл. 3.1 видно, что поддерживая рН на подходящем уровне, методом осаждения можно разделить различные катионы.
Но осаждение можно использовать как метод концентрирования. В основе этого лежит явление соосаждения (т.е. совместного осаждения). Эффективность соосаждения как метода разделения очень высока. Микрокомпонент можно выделить из раствора при его соотношении к макрокомпоненту 1:1015.
Соосаждением называется распределение микрокомпонента между раствором и твёрдой фазой (осадком), причём сам микрокомпонент осадка не образует. Осадок, на котором происходит соосаждение, называется
коллектор.
Так, ионы радия Ra2+, свинца Pb2+, железа Fe3+, меди Cu2+ извлекаются из раствора формирующимся осадком сульфата бария BaSO4. При образовании аморфного осадка гидроксида железа Fe(OH)3 из водного раствора, содержащего катионы хрома(III) и алюминия(III), вместе с осадком осаждаются и эти катионы.
Коллекторы – это малорастворимые неорганические и органические соединения, которые должны полностью захватывать нужные и не захватывать мешающие микрокомпоненты и компоненты матрицы.
Коллекторы могут быть:
1.Неорганические – гидроксиды, сульфиды, фосфаты, сульфаты, галогениды металлов. Распространенные коллекторы Fe(OH)3 и МnО2.
2.Органические коллекторы:
2.1.Малорастворимые ассоциаты. Например, объемистый органический катион кристаллического фиолетового КФ+ или метиленового синего МФ+ и анион SCN– или I–.
2.2.Хелаты (дитизонаты, дитиокарбаминаты, β-дикетонаты).
2.3 Индиферентные органические соединения без комплексообразующих группировок.
Различают поверхностное (внешнее) и внутреннее соосаждение.
При поверхностном соосаждении соосаждаемое вещество адсорбируется на поверхности коллектора и удаляется вмести с ним из

раствора. Поверхностное соосаждение характерно для аморфных осадков, отличающихся развитой неупорядоченной поверхностью.
Адсорбция на поверхности осадка происходит вследствие:
1)электростатических взаимодействий
2)межмолекулярных взаимодействий
3)ионообменных взаимодействий
Число адсорбированных ионов возрастает с увеличением поверхности осадка, т.е. мелкокристаллические и аморфные осадки адсорбируют больше ионов, чем крупнокристаллические. С увеличением температуры адсорбция уменьшается.
Внутреннее соосаждение характерно для кристаллических осадков. Оно может быть вызвано процессом, который называется окклюзия. Окклюзия – это захват присесей из раствора внутрь кристалла.
У процессов соосаждения есть свои отрицательные и положительные стороны. В результате соосаждения происходит загрязнение осадка, что отрицательно влияет на точность гравиметрического анализа. В то же время на процессах соосаждения основано выделение микропримесей из раствора и их концентрирование.
2. Сорбция
Сорбция – процесс поглощения газов, паров и растворенных веществ твердыми и жидкими поглотителями (сорбентами).

Основные количественные характеристики сорбции – коэффициент распределения и степень извлечения. Коэффициент распределения представляет собой отношение концентрации вещества Ств в фазе сорбента к концентрации Св его в водной фазе:
D= Cтв
Св
Ванализе используют разнообразные сорбенты: активные угли, ионообменные и хелатообразующие синтетические смолы, обычные и химически модифицированные кремнеземы и целлюлозу, сорбенты на
неорганической основе А12О3.
Примеры использования: свинец эффективно сорбируют из атмосферного воздуха; кальций, барий, стронций – из концентрированных растворов щелочей, солей; хром, молибден, ванадий – из воды и рассолов ртутного электролиза. Определение элементов проводят непосредственно в концентрате (сжигание в канале спектрального угольного электрода) или концентрат облучают потоком нейтронов или после десорбции азотной кислотой.
3.Экстракция
Экстракцией называется переведение вещества из одной фазы в другую, не смешивающуюся с ней.
Когда говорят об экстракции, то чаще всего имеют ввиду две жидкие фазы – водную и органическую. При экстракции одновременно протекают процессы: образование экстрагируемых соединений; распределение экстрагируемых соединений между водной и органической фазами, реакции в органической фазе (диссоциация, ассоциация, полимеризация). Соединение (обычно в органической фазе), ответственное за образование экстрагируемого соединения, называют экстрагентом.
Инертные органические растворители (хлороформ, четыреххлористый углерод, бензол), применяемые для улучшения физических и экстракционных свойств экстрагента, называют разбавителями.
Органическую фазу, отделенную от водной фазы и содержащую экстрагированные соединения, называют экстрактом. Перевод вещества из органической фазы в водную называют реэкстракцией, а раствор, используемый для реэкстракции, – реэкстрагентом.
ТИПЫ ЭКСТРАГИРУЮЩИХСЯ СОЕДИНЕНИЙ
1)Неионизованные:
1.1.Координационно-несольватированные соединения с ковалентной
связью I2, HgCl2, SbCl3, AsBr3, Hgl2, RuO4 и OsO4. Экстрагируются различными растворителями, а четырёххлористым углеродом и бензолом – избирательно.
1.2.Внутрикомплексные соединения. Например, оксихинолинат алюминия экстрагируется хлороформом при рН = 4,5-11.

1.3.Координационно-сольватированные нейтральные комплексы
MClnLx, M(NO3)nLy, где L – нейтральный экстрагент, например трибутилфосфат, М – Sc(III), Zr(IV), Hf(IV), Th(IV), Au(III), UO22+.
2)Ионные ассоциаты:
2.1.Координационно-несольватированные ассоциаты [В+][А–].
Например, KФ+SbCl6–, R4N+AuCl4–, R4N+A–, где КФ+ – катион красителя кристаллического фиолетового; А– – С1О4–, ReO4–, MnO4–, IO4–.
2.2.Комплексные кислоты. Hp-qMXp. Например, HFeCl4, H2CdI4,
HSbCl6. Экстрагенты – основные и нейтральные (диэтиловый эфир, амины,например, R3NН+FeCl4–).
Экстрагируются только электронейтральные частицы. Ионы металла можно связать в незаряженный комплекс; комплексы, имеющие заряд, можно экстрагировать в виде ионных ассоциатов. При экстракции ионных ассоциатов важны заряд и размер ионов; экстракция ухудшается с увеличением заряда и уменьшением размера ионов. Кроме того следует учитывать растворимость вещества в воде и в органическом растворителе; чем ниже растворимость вещества в воде, тем выше степень его извлечения. Растворимость вещества в полярных и неполярных растворителях зависит от многих факторов, в частности от наличия гидрофильных или гидрофобных групп в молекуле.
Процесс переноса растворённого вещества из одной фазы в другую характеризуется законом распределения:
отношение концентраций растворённого вещества в обеих фазах при постоянной температуре постоянно и не зависит от общей концентрации растворённого вещества.
Количественно закон распределения характеризуется коэффициентом
распределения D и константой распределения KD.
Для выяснения разницы между этими двумя понятиями рассмотрим
экстракцию йода из йодной настойки:
I2 + I– Ù I3– (бурого цвета)
При соприкосновении фаз происходит перенос вещества из одной фазы в другую и устанавливается равновесие. Например, если встряхнуть раствор йодной настойки с вазелиновым маслом или четырёххлористым углеродом, происходит экстракция йода (органическая фаза становится фиолетовой, а водная фаза обесцвечивается). Уравнение реакции экстракции:
I2(вф) Ù I2(оф)
Константа распределения KD– это отношение активностей вещества в одной определённой форме в органической фазе к его активности в той же форме в водной фазе:
K D = a(I2 )оф – термодинамическая константа a(I2 )вф
Если коэффициенты активности неизвестны, то используют реальную константу распределения:

K D = [I2 ]оф
[I2 ]вф
Коэффициент распределения D– это отношение суммарной
(аналитической) концентрации всех форм вещества в органической фазе к концентрации всех форм вещества в водной фазе. В нашем случае:
D = |
[I2 ]оф |
[I2 ]вф +[I3 − ]вф |
Степень экстракции R (или фактор извлечения) – это отношение количества вещества в органической фазе к общему количеству вещества в системе:
R = Cоф 100%
Собщ
R = 100D
D + Vвф
Vоф
Фактор разделения S – это отношение коэффициентов распределения двух веществ:
S = DA/DB
Чем больше фактор разделения, тем более полно можно отделить одно вещество от другого.
Константа экстракции Кex. Запишем уравнение экстракции металла(II) c экстрагентом 8-оксихинолином в органическом растворителе:
М2+вф + 2НОхоф ↔ МОх2 оф + 2Н+вф, где НОх – оксихинолин
Кex = [H + ]2 вф [MOx2 ]оф [M 2+ ]вф [HOx]2 оф
Экстракция широко применяется в клинических исследованиях и в фармацевтическом анализе.
Экстракционно-фотометрические методы используют при определении некоторых витаминов. Так, при определении витамина А водный раствор, полученный после щелочной предварительной обработки анализируемого образца лекарственной формы (растертые в порошок драже или таблетки), содержащего витамин А, обрабатывают водой и щелочью, после чего эфир отгоняют. Остаток растворяют в пропаноле и в полученном растворе определяют витамин А спектрофотометрически.
При одном из способов определения витамина Е в его лекарственных формах на первоначальной стадии анализа применяют экстракцию эфиром из водного раствора.
Особенно широко экстракционные методы используют при анализе растительного лекарственного сырья, а также для получения настоев, отваров, настоек, экстрактов лекарственных веществ.
4. Электрофорез
Электрофорез – основан на различии в скоростях движения частиц разного заряда, формы и размера в электрическом поле.
Скорость движения:
V = z·H / 6πrη,
где V – скорость движения; z – заряд иона; H – напряжённость поля; r – радиус частицы; η – вязкость среды.
Скорость движения частицы характеризуется подвижностью, т.е. расстоянием, проходимым за одну секунду под действием электрического поля напряженностью 1 В/см.
Различают два варианта электрофореза: фронтальный (простой) и зонный (на носителе). В первом случае небольшой объем раствора, содержащего разделяемые компоненты, помещают в трубку с раствором электролита. Во втором случае передвижение происходит в стабилизирующей среде, которая удерживает частицы на местах после отключения электрического поля (рис. 3.1):
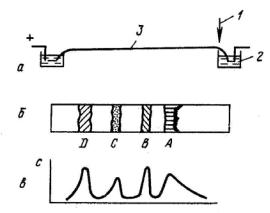 L
L
Рис. 3.1. Электрофоретическое разделение на бумаге:
а – установка для электрофореза (1 – старт; 2 – буферный раствор; 3 – полоска бумаги); б – полоска носителя (А, В, С, D – зоны разделяемых веществ); в – кривая количественной оценки
На скорость движения частиц сильно влияет состав раствора, в частности рН, что используют для повышения селективности. Главная область применения – биохимический анализ (разделение белков, нуклеиновых кислот, ферментов, алкалоидов).
В последнее время интенсивно развивается капиллярный электрофорез. Длина капилляра 10-100 см, внутренний диаметр 25-100 мкм. Он изготовлен из плавленого кварца. В капилляре находится либо буферный раствор, либо гель или раствор полимера. Для получения электрического поля 30 кВ к платиновым электродам прикладывают высокое напряжение. Ввод пробы осуществляют либо за счёт гравитационных сил, либо электрокинетическим методом (за счёт электроосмотического потока). Детекторы – УФ или флуоресцентные.

5. Диализ и электродиализ
Метод основан на различии скоростей проникновения разных частиц через мембрану. Если разделяемые вещества – ионы, то можно использовать разновидность метода – электродиализ (диализ с наложением напряжения). Скорость диализа двух веществ с разными молекулярными массами подчиняется уравнению:
V1 |
= |
M 2 |
V2 |
|
M1 |
Уравнение справедливо для частиц одинаковой формы и строго выполняется для сферически симметричных частиц. Сравнивая скорости диализа исследуемого вещества и вещества с известной молекулярной массой, можно рассчитать молекулярную массу неизвестного вещества. Одна из наиболее важных областей применения диализа – удаление солей и низкомолекулярных примесей из белков.
6.Другие методы разделения и концентрирования
•Дистилляция. Метод дистилляции основан на различной летучести
веществ. Этим методом мышьяк, осмий и рутений в виде AsCl3 или AsBr3, OsO4 и RuO4 можно отделить от многих ионов.
•Отгонка. Простая отгонка (выпаривание) – одноступенчатый процесс разделения и концентрирования. При выпаривании удаляются вещества, которые находятся в форме готовых летучих соединений. Например, один из самых чувствительных испецифических методов определения мышьяка основан на образованиилетучего гидрида АsН3 (криминалистика).
•Управляемая кристаллизация.
•Фильтрация. Твердые частицы, всвещенные в жидкостях или газах, передвигаясь через пористую среду, задерживаются.
•Сублимация (или возгонка) – процесс непосредственного переходатвёрдого вещества в газообразное состояние, миную жидкую фазу.
•Зонная плавка – контейнер с веществом медленно передвигается через нагреватель. Твёрдое вещество плавится, а затем выкристаллизовывается вболее чистое вещество, а примеси остаются в расплаве и передвигаются к концу контейнера.
•Флотация – метод разделения смесей твёрдых частиц веществ, основанныйна различии в их смачиваемости. Распространён в гидрометаллургии какспособ обогащения полезных ископаемых. Поверхностно-активныевещества, добавленные к суспензии измельченного сырья, адсорбируются наповерхности частиц извлекаемого компонента и понижают их смачиваемость. Затем через суспензию пропускают воздух и флотируют извлекаемые микрокомпоненты.
7. Хроматография - принцип метода. Классификация хроматографических методов анализа
Современные хроматографические методы характеризуются как эффективные методы концентрирования, разделения и определения неорганических соединений с близкими химическими свойствами и органических соединений, которые имеют похожие структуры. Новейшими хроматографическими методами можно проанализировать газообразные, твердые и жидкие вещества с молекулярной массой от 1 до 106. Это могут быть изотопы Н, ионы металлов, полимерные белки, нефть. Применение хроматографических методов для разделения белков оказало огромное влияние на развитие современной биохимии, фармацевтики, криминалистики, терапевтического мониторинга в связи с ростом нелегального употребления наркотиков, идентификации антибиотиков, допинг-контроля, анализа наиболее важных классов пестицидов.
Это важнейший аналитический метод. Более 10 работ, выполненные с применением хроматографических методов, были удостоены Нобелевских премий.
Хроматография – это физико-химический метод разделения веществ, основанный на распределении компонентов между двумя фазами – неподвижной и подвижной. Неподвижной (стационарной) фазой служит твердое вещество (сорбент) или пленка жидкости, нанесенная на твердое вещество; подвижной фазой – жидкость или газ. Подвижную фазу, вводимую в слой неподвижной фазы, называют элюентом, а подвижную фазу, выходящую из колонки и содержащую разделенные компоненты, –
элюатом.
Компоненты анализируемой смеси (сорбат) вместе с подвижной фазой передвигаются вдоль стационарной фазы. Ee обычно помещают в стеклянную или металлическую трубку, называемой колонкой.
B зависимости от силы взаимодействия с поверхностью сорбента (по какому-либо механизму) компоненты перемещаются вдоль колонки с разной скоростью.
Одни компоненты остаются в верхнем слое сорбента, другие, с меньшей степенью взаимодействия с сорбентом, оказываются в нижней части колонки, некоторые покидают колонку вместе с подвижной фазой. Таким образом компоненты разделяются.
B отличие от других методов, основанных на распределении компонентов между фазами, хроматография – это динамический метод, обеспечивающий многократность актов сорбции – десорбции разделяемых компонентов, так как разделение происходит в потоке подвижной фазы. Этим обусловлена большая эффективность хроматографического метода по сравнению с методами сорбции и экстракции.

Предложил хроматографию русский ботаник M.C. Цвет. Ha колонке, заполненной CaCO3, он разделял пигменты растений. Подвижной фазой служил диэтиловый эфир. Именно этим методом он обнаружил, что в экстракте зеленых листьев содержится 2 хлорофилла, 4 ксантофила и каротин.
В табл. 4.1. представлена классификация хроматографических методов. Таблица 4.1. Классификация видов хроматографии
Вид |
Подвижная |
Неподвижная |
Форма |
Механизм |
|
фаза |
фаза |
размещени |
распределен |
|
|
|
я |
ия |
|
|
|
неподвижн |
|
|
|
|
ой фазы |
|
ГАЗОВАЯ |
|
|
|
|
|
|
|
колонка |
|
Газо- |
газ |
твердая |
адсорбцион |
|
адсорбционна |
|
|
|
ный |
я |
|
|
колонка |
|
Газо- |
газ (H2, He) |
жидкость |
распредели |
|
жидкостная |
|
|
|
тельный |
ЖИДКОСТН |
|
|
|
|
АЯ |
|
|
колонка |
|
Твердо- |
жидкость |
твердая |
адсорбцион |
|
жидкостная |
|
|
|
ный |
|
|
|
колонка |
|
Жидкостно- |
жидкость |
жидкость |
распредели |
|
жидкостная |
(изооктан, |
|
|
тельный |
|
бензол) |
|
колонка |
|
Ионообменна |
жидкость |
твердая |
ионный |
|
я |
|
|
тонкий |
обмен |
ТОНКО- |
жидкость |
твердая |
адсорбцион |
|
СЛОЙНАЯ |
|
|
слой |
ный |
|
|
|
тонкий |
|
|
жидкость |
жидкость |
распредели |
|
|
|
|
слой |
тельный |
БУМАЖНАЯ |
жидкость |
жидкость |
лист |
распредели |
|
|
|
бумаги |
тельный |
|
|
|
колонка |
|
СИТОВАЯ |
жидкость |
жидкость |
по |
|
(ГЕЛЬ- |
|
|
|
размерам |
ПРОНИКА- |
|
|
|
молекул |
ЮЩАЯ) |
|
|
|
|
|
|
|
|
|
Из данных табл. 4.1 видно, что классификация хроматографических методов проходит:
–по агрегатному состоянию фаз;
–по механизму распределения;
–по технике выполнения.
