
2015Сибирский НИИ сыроделия, сборник научных трудов
.pdfТаблица 4
Распределение лактобактерий, выделенных из растительных объектов по органолептическим показателям
Вкус и аромат, |
Кол-во штам- |
% от общего |
Внешний вид, |
Кол-во штам- |
% от общего |
баллы |
мов |
числа штам- |
консистенция, |
мов |
числа штам- |
|
|
мов |
баллы |
|
мов |
1 |
0 |
0,00 |
1 |
0 |
0,00 |
2 |
1 |
5,26 |
2 |
5 |
26,32 |
3 |
6 |
31,58 |
3 |
14 |
73,68 |
4 |
5 |
26,32 |
|
|
|
5 |
7 |
36,84 |
|
|
|
Таблица 5
Штаммы L. lactis, выделенные из растительных объектов, перспективные для использования в производственных целях
Кол-во отобран- |
% от всех выделенных |
% от выделенных штам- |
Номера отобранных |
|
ных штаммов |
штаммов |
мов L. lactis |
штаммов |
|
|
|
|
Р14-11 |
|
|
|
|
Р14-13 |
|
6 |
31,58 |
46,15 |
Р14-14 |
|
Р14-35 |
||||
|
|
|
||
|
|
|
Р14-30 |
|
|
|
|
Р14-50 |
Из объектов животного происхождения было выделено 34 штамма лактобактерий. Источниками выделения служили: коровье молоко, козье молоко, пчелиный хлеб, а также алтайские национальные (чеген, курут) самоквасные продукты.
Среди выделенных штаммов 32 штамма оказались мезофильными, 2 штамма – термофильными. По форме клеток: 31 штамм имели кокковидную форму, 3 штамма – палочковидную. Выделенные штаммы были идентифициро-
ваны как: 16 штаммов – L. lactis ssp. lactis, 13 щтаммов – L. lactis ssp. diacetilactis; 2 штамма – L. lactis ssp. cremoris; 2 штамма – термофильные молочнокислые палочки, 1 штамм – мезофильные молочнокислые палочки.
Все штаммы были проверены на время образования сгустка и титруемую кислотность.
По времени образования сгустка 43,75 % выделенных штаммов L. lactis (большая часть) свернули обрат за 18 ч; 37,5% – в течение 19–24 ч; доля слабых штаммов составила 18,75 %. У большинство штаммов L. diacetilactis (более 69 %) время образования сгустка составило 18 ч., в равном соотношении (по 15 %) обнаружены штаммы сворачивающие обрат за 19–24 ч и свыше 24 ч.
По кислотообразованию основную группу среди L. lactis (более 43 %) составили штаммы со средней активностью кислотообразования (70–90 оТ), штаммов, которые обладали кислотностью более 90 оТ – 31% от общего числа. Из L. diacetilactis основная доля (более 53 %) пришлась также на штаммы, об-
111
ладающие средней способностью кислотообразования. 30,77 % L. diacetilactis оказались сильными кислотообразователями (свыше 90 оТ).
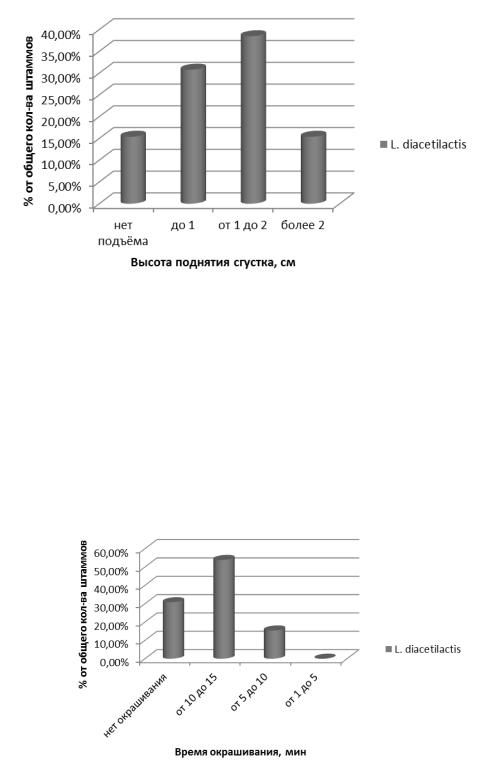
Штаммы L. diacetilactis были проверены по таким критериям как: время образования сгустка, активность кислотообразования, активность газо- и ароматообразования (рис. 1, 2).
Рис. 1.Процентное соотношение штаммов L. diacetilactis по активности газообразования
По газообразованию у большинства штаммов высота поднятия сгустка была в пределах 1-2 см.
При проверке на ароматообразование у большинствоа штаммов (53,85 %) окраска в ходе реакции реакции произошла в течение 10–15 минут (штаммы средней активности). 15% штаммов обладали активной способностью к ароматообразованию (окрашивание проявлялось через 5–10 минут. У 30,77 % окрашивание так и не проявилось.
Рис. 2. Процентное соотношение штаммов L. diacetilactis по активности ароматообразования
112
Штаммы L. lactis ssp. cremoris были проверены на время образования сгустка, на активность кислотообразования и на активность ароматообразования (табл. 6).
|
|
|
|
|
|
Таблица 6 |
|
|
Технологически-ценные свойства L. cremoris |
||||
|
|
|
|
|
|
|
№ |
Название |
Время образова- |
Активность |
кислотообра- |
Активность ароматообра- |
|
|
штамма |
ния сгустка, ч |
зования, оТ |
|
зования, мин |
|
1 |
Н14-22 |
20,00 |
± 0,00 |
85,00 ± 1,73 |
|
12,33 ± 0,33 |
2 |
Н14-23 |
28,00 |
± |
70,00 ± 1,53 |
|
12,00 ± 0,00 |
Выделенные молочнокислые палочки также были проверены на время образования сгустка и активность кислотообразования (табл. 7).
Таблица 7
Технолологически-ценные свойства выделенных молочнокислых палочек
|
№ |
Название |
Отношение к тем- |
Время образования |
Активность кислотообра- |
|
штамма |
пературе |
сгустка, ч |
зования |
|
|
|
||||
1 |
|
Н14-24 |
мезофил |
22,00 ± 0,00 |
76,67 ± 0,67 |
2 |
|
Н14-26 |
термофил |
18,00 ± 0,00 |
140,67 ± 1,86 |
3 |
|
Н14-27 |
термофил |
20,00 ± 1,00 |
65,33 ± 0,88 |
Все штаммы, выделенные из объектов животного происхождения, были продегустированны в чистом виде и оценены по бальной системе. Результаты представлены в таблице 8.
Таблица 8
Распределение лактобактерий, выделенных из объектов животного происхождения, по органолептическим показателям
Вкус и аромат, |
Кол-во штам- |
% от общего |
Внешний вид, |
Кол-во штам- |
% от общего |
|
баллы |
мов |
числа штам- |
консистенция, |
мов |
числа штам- |
|
мов |
баллы |
мов |
||||
|
|
|
||||
1 |
0 |
0,00 |
1 |
1 |
2,94 |
|
2 |
5 |
14,70 |
2 |
7 |
20,59 |
|
3 |
6 |
17,65 |
3 |
26 |
76,47 |
|
4 |
9 |
26,47 |
|
|
|
|
5 |
14 |
41,18 |
|
|
|
Исходя из данных, полученных в ходе дегустации, большую часть (более 29 %) составили штаммы, набравшие максимальное количество баллов по 2-м показателям (вкус, аромат; внешний вид, консистенция). Более 30 % штаммов проявили низкие показания в ходе дегустации.
В результате из всех штаммов, выделенных из объектов животного происхождения, было выбрано 10 штаммов, что составило 29, 41 % от общего количества выделенных штаммов.
113
Среди 10 отобранных штаммов, выделенных из объектов животного происхождения, 5 штаммов – L. lactis, 3 штамма – L. diacetilactis, 1 штамм – L. cremoris, 1 штамм – термофильная палочка.
Отобранные штаммы, которые могут быть перспективными для использования в производственных целях при составлении бактериальных заквасок представлены в таблице 9.
Таблица 9
Штаммы, выделенные из объектов животного происхождения, перспективные для применения в производстве
|
L. lactis |
L. diacetilactis |
L. cremoris |
Термофильные |
|
|
|
|
палочки |
Кол-во отобран- |
5 из 16 |
3 из 13 |
1 из 2 |
1 из 2 |
ных штаммов |
|
|
|
|
% от выделенных |
31,25 |
23,08 |
50 |
50 |
штаммов |
|
|
|
|
Номера штаммов |
КМ14-16 |
КМ14-18 |
Н14-23 |
Н14-26 |
|
КМ14-45 |
ПХ14-36 |
|
|
|
КМ14-46 |
КМ15-59 |
|
|
|
КМ14-48 |
|
|
|
|
КМ15-60 |
|
|
|
Было проведено сравнение штаммов L. lactis и L. diacetilactis, выделенных из растительных и животных объектов по технологически-ценным свойствам с целью выявить отличаются ли штаммы по свойствам, в зависимости от источника выделения.
Штаммы L. lactis сравнивались по таким показателям как время образования сгустка и активность кислотообразования.
По данным, полученным в ходе наших исследований, получилось, что по времени образования сгустка чуть более активными являются штаммы, выделенные из источников животного происхождения (рис. 3).
Рис. 3 Сравнение L. lactis, выделенных с растительных и животных объектов по времени образования сгустка
114
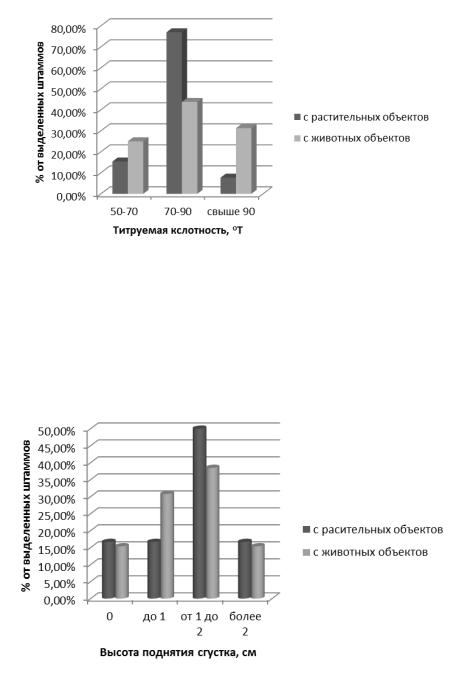
По титруемой кислотности, штаммы выделенные из растительных источников, имеют больший процент по средней кислотности (70–90 оТ), но всё же сильную группу кислотообразователей составляют в основном штаммы животного происхождения (рис. 4).
Рис. 4. Сравнение штаммов L. lactis растительного и животного происхождения по активности кислотообразования
Штаммы L. diacetilactis сравнивали по активности газо- и ароматообразования. По способности к газообразованию более активными являются штаммы, выделенные из растительных объектов (рис. 5).
Рис. 5. Сравнение штаммов L. diacetilactis растительного и животного происхождения по активности газообразования
По способности к ароматообразованию результаты разделились: в группе, в которой окрашивание происходит в течение 5–10 мин (сильные штаммы), преобладали растительные штаммы, а в группе, где реакция проявлялась через 10–15 мин, преобладали штаммы животного происхождения (табл. 10).
115
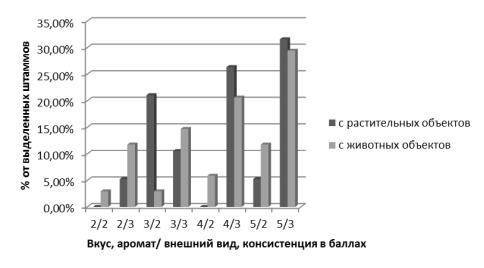
Таблица 10
Сравнение штаммов L. diacetilactis по активности ароматообразования
Время окрашивания, мин |
% от штаммов растительного |
% от штаммов животного |
|
происхождения |
происхождения |
нет окрашивания |
60,00 % |
30,77 % |
1–5 |
0,00 % |
0,00 % |
5–10 |
20,00 % |
15,38 % |
10–15 |
20,00 % |
53,85 % |
Также проводилось сравнение всех штаммов растительного и животного происхождения по дегустационной оценке (рис. 6).
Рис. 6. Сравнение выделенных штаммов растительного и животного происхождения по дегустационной оценке
По наивысшей оценке за органолептические показатели штаммы растительного и животного происхождения имели практически равное процентное соотношение.
Таким образом, в качестве объектов естественного происхождения, для выделения чистых культур молочнокислых бактерий, могут использоваться источники животного и растительного происхождения. Технологически-ценные штаммы, перспективные для создания бактериальных заквасок и препаратов, можно получать и с растительных и с животных объектов. Конечно, стоит учитывать, что по одним показателям более активными являются растительные штаммы, по другим – штаммы животного происхождения. Поэтому при выборе штаммов, необходимо руководствоваться тем, для каких именно целей будет использоваться данный штамм и какие свойства от него нам требуются.
116
БИОХИМИЧЕСКИЕ АСПЕКТЫ МОЛОЧНОЙ ОТРАСЛИ
УДК 637.325:543.54
Разработка технологии производства молокосвертывающего препарата для сыроделия. 7. Исследование полипептидного состава и протеолитической специфичности препаратов говяжьего пепсина методом электрофореза
В.В. Ельчанинов, к.т.н., А.Д. Коваль, к.т.н. А.Н. Белов, к.т.н.
ФГБНУ «Сибирский научно-исследовательский институт сыроделия», Барнаул
Продолжение серии публикаций, посвященных разработке технологии производства жидкого молокосвертывающего ферментного препарата (МФП) для сыроделия [1-5].
Работа выполнена в рамках НИР (Тема № 10.02.03.06), целью которой является создание технологии получения жидкого препарата говяжьего пепсина. Задачей очередного этапа работы было исследование полипептидного состава и протеолитической специфичности жидкого препарата говяжьего пепсина (ГП).
Материалы и методы.
Определение молокосвертывающей активности (МА) молокосвертывающих ферментных препаратов и подготовку препаратов жидкого говяжьего пепсина производили в соответствии с ранее опубликованными методиками [1-6].
Исследуемые препараты.
1.ГП-СибНИИС - зкспериментальный жидкий образец говяжьего пепсина.
Исследовался свежеприготовленный препарат и препарат, хранившийся при температуре 5-100С в течение 7 месяцев.
2.ГП-МЗСФ - коммерческий препарат сухого говяжьего пепсина производства (ОАО "МЗСФ", Россия). Использовался в качестве контрольного пре-
парата говяжьего пепсина. Контрольный препарат (сухой порошок) хранился при температуре 5-100 С в течение 7 месяцев.
Электрофорез в присутствии додецилсульфата натрия (ЭФ-ДСН). Полипептидный состав образцов молокосвертывающих препаратов и фер-
мент-субстратных смесей (ФСС) исследовали методом электрофореза в присутствии додецилсульфата натрия по методу Laemmli [7,8]. В качестве маркеров молекулярной массы (ММ) использовали стандартную белковую смесь производства фирмы "Amersham Biosciences" (Швеция), которая имела следующий состав: фосфорилаза b (94,0 кДа); бычий сывороточный альбумин (67,0 кДа); овальбумин (43,0 кДа); карбоангидраза (30,0 кДа); соевый ингибитор трипсина (20,1 кДа); α-лактальбумин (14,4 кДа). Для детектирования белков на пластинах полиакриламидного геля, использовали краситель Coomassie Brillian Blue R- 250. Денситометрические параметры полученных элекрофореграмм получали с помощью программы OneDScan (v.1.3, "Scanalytics", США).
117
Подготовка образцов для исследования полипептидного состава. Экс-
периментальный жидкий препарат ГП фильтровали через ячейки Minisart-plus
0,45 мкм (Sterile, CA-membrane, GF-prefilter) производства фирмы "Sartorius Stedim Biotech" (Германия). Сухой ГП (ОАО "МЗСФ) разводили дистиллированной водой из расчета 1 гр/50 мл, перемешивали в течение 30 минут при комнатной температуре и фильтровали с использованием Minisart-plus и обессоливали.
Для обессоливания использовали мини-колонки HiTrap Desulting Column (5 ml), производства "GE Healthcare" (Швеция). Процедуру обессоливания проводили в соответствии с протоколом фирмы-производителя. Обессоленные образцы концентрировали. Перед концентрированием в обессоленных образцах определяли оптическую плотность при длине волны 280 нм (D280).
Для концентрирования использовали ячейки для ультрафильтрации Vivapore 5ml Concentrator ("VIVA Science", США) с отсечкой по молекулярной массе - 7,5 kD. Ячейку заполняли раствором обессоленного МФП с известным значением D280 и концентрировали в течение 2-8 часов при температуре 8-100 С, до значений D280 = 8-10 единиц оптической плотности.
Сконцентрированные препаратов МФП смешивали 1:1 с буфером для образца (0,125 М TRIS-HCl, 4% додецилсульфат Na, 20% (объем/объем) глицерол, 0,2 М дитиотреитол, 0,02% бромфеноловый синий, рН=6,8), выдерживали на кипящей водяной бане в течение 120 секунд и охлаждали до комнатной температуры. Подготовленные образцы исследовали в течение дня или хранили в замороженном состоянии (-200С) не более 1 недели.
Подготовка образцов для исследования протеолитической специфич-
ности. Контрольный препарат – порошок говяжьего пепсина ("ОАО МЗСФ") готовили следующим образом. Готовили 1% раствор ферментного препарата в 0,04 М Na-ацетатном буфере (рН=5,6). МА полученного раствора составляла ~1000 УЕ/мл. По этому значению МА (~1000 УЕ/мл) нормировали экспериментальный жидкий препарат ГП. Перед исследованием растворы ферментов прогревали на водяной бане при 350С в течение 15 минут.
В качестве субстрата использовали 1% раствор казеина по Гаммерстену. Для подготовки раствора субстрата в мерную, 100-мл колбу вносили 1,0 гр. казеина и 3,8 гр. Na3PO4 х 12 H2O, добавляли 80 мл дистиллированной воды и перемешивали при комнатной температуре до полного растворения казеина. Полученный раствор титровали 1,0 М HCl до рН=5,6 и доводили объем до 100 мл.
Подготовка образцов фермент-субстратной смеси (ФСС). В пробирки отмеряли по 5,0 мл субстрата (1% раствора казеина по Гаммерстену) и инкубировали 15 минут в водяном термостате при 350С. Затем в пробирки вносили по 0,1 мл исследуемого ферментного препарата, тщательно перемешивали и отмечали время начала инкубации при 350С.
Отбирали аликвоты сразу после смешивания компонентов ФСС (0 минут) и через 180 минут инкубации. Аликвоты смешивали 1:1 с буфером для образца, быстро перемешивали, выдерживали на кипящей водяной бане в течение 120 секунд и охлаждали до комнатной температуры. Подготовленные таким обра-
118
зом образцы исследовали в течение дня или хранили в замороженном состоянии (-200С) не более 1 недели.
Подготовка образцов казеина по Гаммерстену. Аликвоты 1% раствора казеина по Гаммерстену разводили 1:1 буфером для образца, перемешивали, выдерживали на кипящей водяной бане в течение 120 секунд и охлаждали до комнатной температуры. Подготовленные образцы исследовали в течение дня или хранили в замороженном состоянии (-200С) не более 1 недели
Математическую обработку первичных экспериментальных данных и построение диаграмм проводили с использованием табличного редактора Microsoft Excell®.
Результаты и обсуждение.
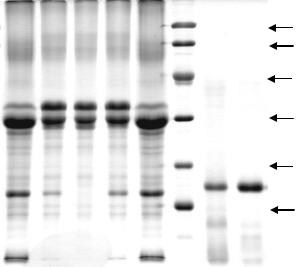
Исследование полипептидного состава. Результаты исследования полипептидного состава и протеолитической специфичности препаратов ГП производства ОАО МЗСФ (ГП-МЗСФ) и опытного образца ГП (ГП-СибНИИС) методом ЭФ-ДСН представлены на Рисунках 1 и 2.
|
|
|
|
|
|
|
|
|
Рисунок 1. – Результаты исследо- |
|
|
|
|
|
|
|
|
|
|
вания полипептидного состава и |
|
|
|
|
|
|
|
|
|
94,0 |
протеолитической специфичности |
|
|
|
|
|
|
|
|
|
67,0 |
препаратов ГП методом ЭФ-ДСН. |
|
|
|
|
|
|
|
|
|
|
Препарат ГП-СибНИИС – свеже- |
|
|
|
|
|
|
|
|
|
43,0 |
приготовленный. |
|
|
|
|
|
|
|
|
|
|
Обозначения треков: |
|
|
|
|
|
|
|
|
|
30,0 |
1 |
- 180 минут инкубации ГП-МЗСФ |
|
|
|
|
|
|
|
|
|
2 |
- 0 минут инкубации ГП-МЗСФ |
|
|
|
|
|
|
|
|
20,1 |
3 |
- казеин по Гаммерстену |
|
|
|
|
|
|
|
|
4 |
- 0 минут инкубации ГП- |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
СибНИИС |
|
|
|
|
|
|
|
|
|
14,4 |
5 |
-180 минут инкубации ГП- |
|
|
|
|
|
|
|
|
ММ |
СибНИИС |
|
|
|
|
|
|
|
|
|
(кДа) |
6 |
- маркеры молекулярной массы |
|
|
|
|
|
|
|
|
|
7 |
– ГП-МЗСФ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
||
|
8 |
– ГП-СибНИИС |
||||||||
|
|
|
|
|
|
|
|
|
||
Справа указаны значения молекулярных масс маркеров.
Контрольный (ГП-МЗСФ) и опытный (ГП-СибНИИС) препараты (Рисунок 1, треки №№ 7-8) имеют близкий качественный состав. В каждом препарате присутствуют: один основной компонент с ММ ~17 кДа (маркерный полипептид, обнаруживается во всех коммерческих препаратах натурального говяжьего пепсина), по 4 минорных компонента с ММ в диапазоне 33-42 кДа и 4-5 низкомолекулярных компонентов с ММ в диапазоне 14-9 кДа.
Количественный состав контрольного и опытного препаратов имеют отличия: относительное содержание основных компонентов (ММ 17 кДа), различается в 1,71 раза (ГП-МЗСФ – 42,0%, ГПСибНИИС – 71,7%.
119
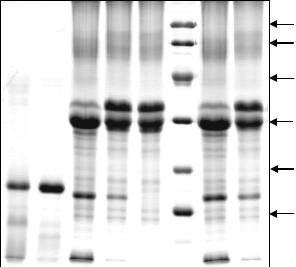
|
Рисунок 2. – Результаты исследова- |
||||
|
ния полипептидного состава и про- |
||||
94,0 |
теолитической специфичности пре- |
||||
67,0 |
паратов ГП методом ЭФ-ДСН. Пре- |
||||
43,0 |
парат ГП-СибНИИС – хранился 7 |
||||
месяцев при температуре 5-10 |
0 |
С. |
|||
|
|
||||
30,0 |
Обозначения треков: |
|
|
||
1 |
– ГП-МЗСФ |
|
|
||
|
|
|
|||
|
2 |
– ГП-СибНИИС |
|
|
|
20,1 |
3 |
– 180 минут инкубации ГП-МЗСФ |
|||
4 |
– 0 минут инкубации ГП-МЗСФ |
||||
|
|||||
14,4 |
5 |
– казеин по Гаммерстену |
|
|
|
6 |
– маркеры молекулярной массы |
||||
ММ7 – 180 минут инкубации ГП-
|
|
|
|
|
|
|
|
(кДа) |
СибНИИС |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 – 0 минут инкубации ГП- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
СибНИИС Справа указаны значения молеку-
лярных масс маркеров.
Количественно отличается и содержание полипептидных компонентов с ММ<14 кДа. Предположительно, низкомолекулярные примеси обоих препаратов, являются белками тканей желудков КРС, использованных в качестве сырья, а также продуктами их частичного протеолиза пепсинами, образующимися в процессе экстракции, активации и формулирования молокосвертывающих препаратов. Суммарное относительное содержание этих компонентов в ГПМЗСФ и ГП-СибНИИС составляет, соответственно, 48,4% и 23,6%.
Высокое содержание балластных белковых примесей в препаратах ГПМЗСФ и ГП-СибНИИС обусловлено тем, что для их получения используются методы грубой очистки - одностадийного высаливания и макрофильтрация. Получение МФП, имеющих более гомогенный полипептидный состав, предполагает использование, более совершенных биотехнологических схем и высокоселективных методов очистки белков, что неизбежно ведет к удорожанию продукта. Однако высокая степень очистки МФ необходима лишь в том случае, когда балластные примеси проявляют нежелательную ферментативную активность, негативно влияющую на качество сыра. Если балластные белки коагуляционно неактивны и не проявляют негативной с точки зрения сыроделия, ферментативной - прежде всего протеолитической и липолитической - активности, то их присутствие в МФП вполне допустимо. Различия в количественном и качественном составе препаратов ГП-МЗСФ и ГП-СибНИИС объясняются, вероятно, различиями в технологии производства.
В процессе длительного хранения препарата ГП-СибНИИС (Рисунок 2, треки №№ 1-2), его полипептидный состав претерпевает незначительные количественные и качественные изменения. Относительное содержание полипептидов с ММ в диапазоне 33-42 кДа уменьшается в 3,29 раза (с 4,6% до 1,4%). Меняется и качественный состав этих фракций – с 4 компонентов в исходном препарате до 2-х в препарате, хранившемся в течение 7 месяцев.
120
