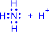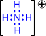Документ Microsoft Office Word
.docx-
Скорость химической реакций и связанный с ней механизм их протекания изучает химическая кинематика. При определении скоростей учитывается, что реакции м/б гомогенными – протекающими в однофазной системе и гетерогенными – протекающими в системах, состоящих более чем из одной фазы(С(т)+О2(г)=СО2(г)).
Гомогенные реакции протекают во всем объеме системы, а гетерогенные -только на поверхности раздела фаз, где реагирующие вещества могут
соприкасаться друг с другом. Скорость последних реакций измеряется количеством вещества системы, вступающего в реакцию или образующегося в результате, реакции за единицу времени на единице поверхности раздела фаз.
Скорость химической реакции зависит от: 1)природы реагирующих в-в; 2) условий, при которых протекает реакция, - концентраций реагирующих, веществ, температуры, давления (для газов), облучения квантами света и др.; 3) присутствия катализаторов,
Зависимость скорости реакции от концентрации дается- законом действующих масс: скорость химической реакции прямо пропорциональна - произведению концентраций реагирующих веществ.
единице. Зависимость скорости реакции от концентрации и дается законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Увеличение
скорости
реакции
с повышением температуры объясняется
увеличением числа
так называемых активных молекул,
т.е. молекул, обладающих достаточной
энергией
для
осуществления
химического взаимодействия при
их столкновении. Та минимальная
избыточная
энергия
по сравнению со
средней энергией, которой должны
обладать
молекулы, чтобы реакция
между ними стала
возможной,
называется энергией
активации Еа.
-
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, твердыми веществами и газами участвуют также находящиеся в растворе ионы. Поэтому сущность протекающих процессов наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. Например, уравнения реакций нейтрализации сильных кислот щелочами HClO4 + NaOH →NaClO4 + H2O.
На основании рассмотренных примеров можно сделать следующий вывод: реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей CH3COONa + HCl → CH3COOH + NaCl.
Таким
образом, реакции
в растворах электролитов идут до конца
если в результате взаимодействия
веществ происходит образование осадка,
выделение газа и образование слабого
электролита. При
написании ионно-молекулярных
уравнений реакций, слабые
электролиты, малорастворимые соединения
и газы записываются
в молекулярной форме, а находящиеся в
растворе сильные
электролиты – в виде составляющих их
ионов. Взаимодействие
кислой соли и щелочи приводит к
образованию средней
соли и воды.
Например:KHCO3 + KOH 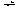 K2CO3 + H2O.При
взаимодействии основной
соли и кислоты образуется средняя
соль и вода. Например:NiOHNO3 +
HNO3
K2CO3 + H2O.При
взаимодействии основной
соли и кислоты образуется средняя
соль и вода. Например:NiOHNO3 +
HNO3 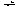 Ni(NO3)2 +
H2O.
Ni(NO3)2 +
H2O.
Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции и растворах электролитов фактически сводятся к реакциям между ионами. Реакции между ионами называют ионными реакциями, а уравнения таких реакций - ионными уравнениями. При составлении ионных уравнении следует руководствоваться тем. что формулы веществ малодиссоциирующих. нерастворимых и газообразных записываются в молекулярном виде.
Бели вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз, а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх.
Реакции, протекающие в растворах электролитов, эапис каются с помощью ионных уравнений. Эти реакции называл реакциями ионного обмена, так как в растворах электролиты обмениваются своими ионами. Таким образом, можно сделать два вывода. 1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому изображаются в виде ионных уравнений. Они проще молекулярных и носят более общий характер.
2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество. 1. Молекулярное и ионное уравнения реакций.
2. Реакции ионного обмена.
3. Реакции нейтрализации.
-
В основе современного понимания микромира лежит понятие о том, что эл.одновременно обладает св-ми частицы и св.волны.Быстродвиж.эл.может нах.в любой часи пространства окр.ядром и его различ.положения рассм.как электр.облако с опред. плотностью отриц.заряда. электроан атома водорода обр.электр.облако в форме шара вблизи ядра электр. плотность практич.=0. По мере удал.от ядра эл.плотность воззрастает и достигает макс.значение.
Пространство вокруг ядра в кот.наиболее вероятно нах-ие эл.наз.орбиталью. в нем заключено 90%эл.облака.
2.Квантовые числа. Расположение электронов в атоме опис.системой квант.чисел n,l,m,s.
2,1Главное кВ.число хар-ет номер энергет.уровня на кот.нах-ся электрон. послед.энерг.уровень соотв.номеру периоду в кот.нах-ся эл.
Увел происходит от1 к 7 эн.ур.
2,2. орбитальное L от 1 до н,хар-ет энергетич.подуровень и формулу эл.орбитами.
Кол-во энергетич подуровн=номеру уровня.
2,3 магнитное квантовое число M от –L до +L. М=2L+1 хар-ет ориентацию эл.облака в пространстве и кол-во орбиталей на данном подуровне.Квантовые числа m и L хар-ет движение электролита вокруг ядра.
2,4 спиновое квантовое число S хар-ет собственное движение электролита.
-
При химических реакциях происходит взаимное превращение внутренней в-в с одной стороны, и тепловой, лучистой, электрической или механической энергии, с другой. Реакции, протекающие с выделением энергии, наз. экзотермическими, а реакции, при которых энергия поглощается, - эндотермическими. Часто энтальпию системы называют теплосодержанием, поскольку она равна теплоте изобарного процесса.
Раздел химии, посвященный количественному изучению тепловых эффектов реакций, получил название термохимии.
В зависимости от конкретного процесса различают и конкретные тепловые эффекты. Тепловым эффектом химического процесса называется изменение энтальпии, произошедшее при осуществлении этого процесса, отнесенное к одному молю в-ва или одному молю эквивалентов в-ва.
Первый закон термохимии: если при образовании какого-либо соединения выделяется(поглощается) некоторое кол-во теплоты, то при разложении этого соединения в тех же условиях такое кол-во теплоты поглощается(выделяется): dH(реакция образования)= - dH(реакция разложения). Это положение вытекает из з-на сохр. энергии; чем больше теплоты выделяется при образовании того или иного соединения, тем больше энергии надо затратить на его разложение. Поэтому в-ва, при образовании которых выделяется большее кол-во теплоты, весьма прочны и трудно разлагаются.Все термохимические расчеты основываются на законе Гесса (Г. И. Гесс, 1840 г), являющимся частным случаем закона сохранения энергии:
тепловой эффект химического процесса зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Важное следствие закона Гесса: тепловой эффект химической реакции равен сумме энтальпий образования получающихся веществ за вычетом суммы энтальпий образования исходных веществ.
-
Принцип Паули. Данный принцип состоит в том, что в атоме не может быть электронов, имеющих одинаковый набор всех четырех квантовых чисел. Электрон может хар-ся только одним набором 4-х квантовых чисел (n, L, m1 и ms), а одной пространственной атомной орбитали (АО) соответствует состояние с фиксированными значениями 3-х квантовых чисел (n, L, m1). Тогда по принципу Паули для конкретной АО возможно лишь столько состояний электрона, сколько различных значений возможно для четвертого квантового числа тs. Для последнего возможны лишь два значения. Поэтому максимальное количество электронов для одной АО — 2. Пользуясь принципом Паули, подсчитаем, какое максимальное число электронов может находиться на различных энергетических подуровнях и уровнях в атоме. При L = 0, т. е. на s-подуровне, магнитное квантовое число тоже равно нулю. Следовательно, на s-подуровне имеется всего одна орбиталь. На каждой атомной орбитали размещается не более двух электронов, спины которых противоположно направлены. Итак, максимальное число электронов на s-подуровне каждой электронной оболочки равно 2. При L = 1 (p-подуровень) возможны уже три различных значения магнитного квантового числа (—1, О, +1). Следовательно, на р-подуровне имеется три орбитали, каждая из которых может быть занята не более чем двумя электронами. Всего на р-подуровне может разместиться 6 электронов. Подуровень d (L= 2) состоит из пяти орбиталей, соответствующих пяти разным значениям; здесь максимальное число электронов равно 10.
-
G- энергия Гиббса.[Дж, кДж] – стандартная энтропия образования.
G=H-T*S
dG=dH-T*dS(p=const, T=const) – изобарно-изотермический потенциал.
Химическая реакция будет самопроизв. Протекать в том напр, где dG<0, если dG=0, то система будет нах-ся в состоянии хим. равновесия, если dG>0, то хим.р. не протекает.
dG=nGпродуктов р -nGисходных в-в. [кДж/моль]
-
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
|
H• + •H ® H : H |
|
|
® |
|
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
|
|
® |
|
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:
|
|
® |
|
(или NºN) – тройная связь |
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Электроотрицательность - это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный - франций.
-
Все хим.р. можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих в-в. Обратимые р.протекают не до конца: при обратимой р. Ни одно из реагир.в-в не расходуется полностью. Это различие связано с тем, что необратимая р. Может протекать только в одном направлении. Обратимая же р. Может протекать как в прямом, так и в обратном направлениях. Когда скорости прямой и обратной р. становятся одинаковыми, наступает хим. равновесие. При увеличении какого-либо из в-в, участвующих в равновесии, равновесие смещается в сторону расхода этого в-ва, при уменьшении какого-либо из в-в равновесие смещается в сторону образования этого в-ва. При увеличении давления пуем сжатия системы равновесия сдвигается в сторону уменьшения числа молекул газов , т.е. сторону увеличения давления. При повышении температуры равновесие смещается в направлении эндотермической, а при понижении – в направлении экзотермической р. Принцип Ле-Шателье: если на систему, нах-ся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.?
-
Стандартной энергией разрыва химической связи называют изменение энтальпии при химической реакции, в которой происходит разрыв одного моля данной связи. При этом принимается, что исходное вещество и продукты реакции находятся в своих стандартных состояниях гипотетического идеального газа при давлении 1 атм и температуре 250 C[1]. Синонимами энергии разрыва химической связи считаются: энергия связи, энергия диссоциации двухатомных молекул, энергия образования химической связи. Длина химической связи — расстояние между ядрами химически связанных атомов. Длина химической связи — важная физическая величина, определяющая геометрические размеры химической связи, её протяжённость в пространстве. Полярность химических связей — характеристика химической связи (как правило ковалентной), показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. КРАТНОСТЬ СВЯЗИ- число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентнойхимической связи. Так, в молекуле этана Н 3 С-СН 3 связь С-С одинарная, К. с. равна единице (одна общаяпара электронов); в молекуле этилена Н 2 С = СН 2 связь С = С двойная, К. с. равна двум (две - парыобобществлённых электронов); в молекуле ацетилена НС СН тройная связь с тремя обобществлённымипарами электронов. Чем выше К. с., тем, как правило, меньше её длина и выше прочность. Ср. длина связиС-С в органич. соединениях 0,154 нм, С=С - 0,133 нм и С С - 0,121 нм. Прочность связи соответственно выше у связи С
 С.
Насыщаемость –
свойство атомов образовывать строго
определенное число ковалентных связей.
Благодаря насыщаемости связей молекулы
имеют определенный состав.
Направленность –
т. е. связь образуется в направлении
максимального перекрытия электронных
облаков. Относительно линии соединяющей
центры атомов образующих связь
различают: σ и π (рис.
9):
σ-связь – образована
перекрыванием АО по линии соединяющей
центры взаимодействующих атомов; π-связь
– это связь, возникающая в направлении
оси перпендикулярной прямой, соединяющей
ядра атома.
С.
Насыщаемость –
свойство атомов образовывать строго
определенное число ковалентных связей.
Благодаря насыщаемости связей молекулы
имеют определенный состав.
Направленность –
т. е. связь образуется в направлении
максимального перекрытия электронных
облаков. Относительно линии соединяющей
центры атомов образующих связь
различают: σ и π (рис.
9):
σ-связь – образована
перекрыванием АО по линии соединяющей
центры взаимодействующих атомов; π-связь
– это связь, возникающая в направлении
оси перпендикулярной прямой, соединяющей
ядра атома.
Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму.
-
Энтропия – мера вероятности состояния хим. системы.(мера беспорядка в системе)
S=R*Ln*W( энтропия равна логарифму равновероятных микросостояний, которыми м/б реализовано это микросостояние).
С повышением темп.энтропия всегда возрастает,т.к. возрастает интенсивность движения частиц,а след-но растет число способов их расположения. Так же возр.при превращении в-ва из кристаллического состояния в жидкое,и в особенности при переходе их жидкого состояния в газообразное. Энтропия зависит только от состояния системы и также явл.функцией состояния.\
-
Влияние природы реагирующих частиц определяется их атомным составом, пространственным строением и молекулярными св-вами. Скорость хим.р. определяется скоростью разрыва одних и образования др. хим. связей. Эти превращения происходят в элементарном акте реакции. Изменение длины хим. связи, валентных углов и др.геометр. параметров молекулы сопровождается изменением ее потенц. энергии. Поэтому и взаимодействие частиц в элементарном акте реакции так же должно хар-ся изменением потенциальной энергии всей системы. Поскольку реагирующие молекулы обычно содержат много атомов, то элементарный акт хим.р. хар-ся многомерной поверхностью потенциальной энергии. На этой пов-ти потенц. энергии отражается влияние изменения каждого геометрического параметра одной молекулы на энергии ее взаимодействия. При возрастании температуры хим. р. протекают быстрее.
-
Гибридизация.
У большинства атомов в образовании хим.связи учавствует несколько АО каждого атома. Свойства орбиталей одного центра смешиваться между собой с образованием новых орбиталей было введено в методе ВС для объяснения геометрии отдельных молекул и получило назв.гибридизация. наиболее эфекивно смешиваются орбитали близких энергий и подходящей симметрии. Наиболее простые типы гибридизации определяются смещением s-и p- орбиталей электронной оболочки. Благодаря вытянутой форме гибридных орбиталей досигается более полное перекрывание электронных облаков,в итоге обр.более прочные хим.связи. Гибридазация одной s-и одной р-орбитали,приводящей к образованию двух sp-орбиталей,наз. Sp-гибридизация(180 град).
Число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации. Так, при гибридизации одной s- и двух p-орбиталей(sp^2 гибридизация = 120 град) обр-ся три равноценные sp^2 орбиталей.
-
Если в гибридизации участвуют одна s и 3p орбитали(sp^3 гибридизация), то в результ. обр-ся 4 гибридные sp^3 орбитали, вытянутые в направлениях к вершинам тетраэдра, т.е. под углом 109 град.28мин. друг к другу(CH4).
Ионная связь считается осуществляемой в результ. взаимного э/статического притяжения противоположно заряженных ионов. Ионы м/б простыми, т.е. состоящими из одного атома(катионы Na+, анионыF- ) или сложными, т.е. состоящими из двух или более атомов(NH4+, OH-,NO3-).Х-ки:Энергия ионной связи прямо пропорциональна произведению зарядов ионов и обратно пропорциональна расстоянию м/у ионами(длине ионной связи), ионная связь не обладает направленностью, ионная связь не обладает насыщаемостью. В соединениях оксидов или сульфидов не обр-ся чисто ионная связь: здесь хим. связь всегда носит частично ковалентный х-р. Так же многозарядные сложные анионы м/б энергетически устойчивыми, поскольку избыточные электроны распределены м/у несколькими атомами, так что эффективный заряд каждого из атомов не превышает заряда электрона.
-
В водных р-рах сильные электролиты обычно полностью диссоциированы. Поэтому число ионов в них больше, чем в р-рах слабых электролитов той же концентрации. И если в р-рах слабых электролитов концентрация ионов мала, расстояния м/у ними велики и взаимодействие ионов друг с другом незначительно, то в не очень разб.р-рах сильных электролитов среднее расстояние м/у ионами сравнительно мала. Активность – эффективная, условная концентрация его, соответственно которой он действует при хим. р. Коэф. активности различных ионов различны. Они изменяются в зависимости от условий при изменении концентрации р-ра. В конц. р-рах коэф. активности обычно меньше единицы, а с разбавлением он приближается к единице. В разб. р-рах природа ионов мало влияет на значения их коэф.активности. Коэф. активности данного иона зависит только от его заряда и от ионной силой р-ра, под которой понимают полусумму произведений концентраций всех нах-ся в р-ре ионов на квадрат их заряда.
-
Электролиз – совокупность ОВР, протекающих на электродах при пропускании ч/з р-р или расплав электролита постоянного электрич. тока при этом электроэнергия превращается в химическую. Активные Ме на катоде никогда не выделяются. На катоде будут восстанавливаться окисленные формы электрохимич. систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наим.электродным потенциалом. З-н Фарадея: 1) масса образующегося при электролизе в-ва пропорциональна кол-ву прошедшего ч/з р-р электричества.2) при электролизе различных хим. соединений равные кол-ва электричества приводят к электрохимич. превращению эквивалентных кол-в в-в.
22. Гидролиз солей, образованных многоосновной к-той или слабым основанием многовалентного Ме протекает ступенчато. Первая ступень гидролиза карбоната натрия: Na2CO3+HOH =NAHCO3+NaOH
Образовавшаяся кислая соль подвергается гидролизу: NaHCO3 +HOH=H2CO3+NaOH
Поскольку первая константа диссоциации к-ты больше, чем вторая, то константа гидролиза по первой ступени всегда больше, чем константа гидролиза по первой ступени. Из-за этого гидролиз по первой ступени всегда протекает в большей степени, чем по второй.
45.Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового в-ва, наз. энергией активации.[Дж/моль]. Молекулы, обладающие такой энергией, наз. активными молекулами. Реакции, требующие для своего протекания заметной энергии активации, начинаются с разрыва или с ослабления связей м/у атомами в молекулах исходных в-в. При этом в-ва переходят в неустойчивое промежуточное состояние, хар-ся большим запасом энергии. Это состояние наз. активированным комплексом или переходным состоянием. Именно для его образования и необходима энергия активации. Неустойчивый активированный комплекс существует очень короткое время. Он распадается с образованием исходных в-в или продуктов реакции; при этом энергия выделяется.
48. Менделеев считал, что м/у всеми хим. элементами существует закономерная связь, объединяющая их в единое целое, и пришел к заключению, что в основу систематики элементов д/б положена их относительная атомная масса. Расположив все элементы в порядке возрастающих атомных масс, он обнаружил, что сходные в хим. отношении элементы встречаются ч/з правильные интервалы и что, таким образом, в ряду элементов многие их св-ва периодически повторяются. В 1869 г. Менделеев вывел периодический з-н: Св-во простых тел, а так же формы и св-ва соединений элементов нах-ся в периодической зависимости от величины атомных весов элементов.
Изменение св-в хим. элементов по мере возрастания их атомной массы не совершается непрерывно в одно и том же направлении, а имеет периодический х-р. Период – ряд элементов, в пределах которого св-ва изменяются последовательно.
50. Электролиты – в-ва, проводящие эл.ток своими ионами. При растворении в воде и в ряде неводных растворителей св-ва электролитов проявляют соли, к-ты и основания. Электролитами явл. Так же многие расплавленные соли, оксиды и гидроксиды, а так же некоторые соли и оксиды в тв. состоянии. Степенью диссоциации электролита наз. отношение числа его молекул, распавшихся в данном р-ре на ионы, к общему числу его молекул в р-ре. Смещение равновесия диссоциации слабого электролита можно вызвать не только путем увеличения концентрации одного из его ионов, но и путем уменьшения концентрации одного из его ионов в р-ре.
51. В р-рах комплексные соединения могут подвергаться первичной и вторичной диссоциации. Первичная диссоциация комплексного соединения – это его распад на комплексный ион, образованный внутренней сферой, и ион внешней сферы. В водных р-рах первичная диссоциация комплексных соединений обусловлена разрывом ионной связи м/у вн. и внешн. сферами, она практически необратима. Вторичная диссоциация комплексного соединения – это распад внутр.сферы комплекса на составляющие ее компоненты. Т.к. при этом разрушаются не ионы, а ковалентные связи комплексообразователя с лигандами, - это процесс затруднен и обратим. Он происходит ступенчато. Зная концентрацию комплексного иона и определив концентрацию свободных ионов Ме и «вымытых» из комплекса координированных групп можно найти числовую величину константы динамического равновесия, отвечающего вторичной электролитической диссоциации комплекса. Такого рода константы наз. константами нестойкости, обратные им величины наз. константами устойчивости. Чем меньше величина константы нестойкости, тем устойчивее комплекс.
52. В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества. Взаимодействие с неметаллами -щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность: оксид образует только литий:4Li + O2 = 2Li2O,натрий образует пероксид:2Na + O2 = Na2O2.С галогенами все щелочные металлы образуют галогениды:2Na + Cl2 = 2NaCl.Взаимодействие с водой - все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:2M + 2H2O = 2MOH + H2.Взаимодействие с кислотами -щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой.