
Теоретический курс_ХБАС_ЛЕЧ
.pdfGenerated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ТВЕРСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Кафедра химии и биохимии
ХИМИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ Теоретический курс
Учебно-методическое пособие для подготовки к лабораторно-практическим занятиям и экзамену
для студентов 1 курса лечебного и педиатрического факультетов
ТВЕРЬ
2012
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
УДК 54 ББК 24
Авторы-составители: Зубарева Г.М., Волкова Л.Р.
Под общей редакцией профессора, док.биол.наук. Зубаревой Г.М.
Рецензенты:
Е.А. Харитонова – канд. биол. наук, доцент кафедры биологии ГБОУ ВПО Тверская ГМА Минздрава России Н.Ю. Колгина – канд. мед. наук, доцент кафедры фундаментальной
фармакологии ГБОУ ВПО Тверская ГМА Минздрава России Учебно-методическое пособие утверждено ЦКМС ТГМА
Химия биологически активных соединений. Теоретический курс. [Текст]: учебно-методическое пособие для подготовки к лабораторно-практическим занятиям и экзамену для студентов 1 курса лечебного и педиатрического факультетов/ Лопина Н.П., Бордина Г.Е. // Под общей редакцией: Зубаревой Г.М. – Тверь: Ред.-издат. центр Твер. гос. мед. акад., 2012. – 129 с.
Учебно-методическое пособие составлено коллективом кафедры химии и биохимии Тверской государственной медицинской академии и предназначено в помощь студентам I курса лечебного и педиатрического факультетов для подготовки к лабораторно-практическим занятиям и экзамену.
Авторы-составители – сотрудники кафедры химии и биохимии Тверской государственной медицинской академии:
Галина Мефодьевна Зубарева – док. биол. наук, профессор кафедры химии и биохимии Лариса Рафаэльевна Волкова – ассистент кафедры химии и биохимии
УДК 54 ББК 24
© Зубарева Г.М., Волкова Л.Р. 2012 © Оформление, оригинал-макет. Редакционно-издательский центр Тверской государственной медицинской академии, 2012
2
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
ОГЛАВЛЕНИЕ
Предисловие……………………………………………………………..4 Тема 1…………………………………………………………………….5
Классификация и реакционная способность органических соединений
Тема 2…………………………………………………………………….12
Электронные эффекты заместителей Пространственное строение органических молекул
Тема 3…………………………………………………………………….20
Классификация химических реакции и механизмы их осуществления
Тема 4…………………………………………………………………….27
Спирты. Фенолы. Альдегиды. Кетоны
Тема 5. ………………………………………………………………….. 39
Карбоновые кислоты и их функциональные производные
Тема 6…………………………………………………………………….49
Углеводы
Тема 7…………………………………………………………………….61
Сложные углеводы.Олиго- и полисахариды
Тема 8…………………………………………………………………….72
α-аминокислоты
Тема 9…………………………………………………………………….79
Пептиды. Белки
Тема 10……………………………………………………………………85
Мононуклеотиды. Полинуклеотиды. Нуклеиновые кислоты
Тема 11……………………………………………………………………97
Полифункциональные и гетерофункциональные соединения.
Тема 12……………………………………………………………………110
Омыляемые липиды
Тема 13……………………………………………………………………119
Неомыляемые липиды
Библиографический список……………………………………………..129
3
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
ПРЕДИСЛОВИЕ
Учебно-методическое пособие соответствует примерной программе по дисциплине «Химия биологически активных соединений» для специальностей 060101 – лечебное дело и 06103 - педиатрия утвержденной Руководителем Департамента образовательных программ и стандартов профессионального образования Минобразования России (Москва, 2002 г.).
Химия биологически активных соединений изучает строение, свойства и реакционную способность органических соединений, участвующих в процессах жизнедеятельности, во взаимосвязи с их биологическими функциями. Основными объектами ее изучения являются биополимеры (белки, полисахариды, нуклеиновые кислоты); липиды; природные и синтетические биорегуляторы (витамины, гормоны, ферменты, лекарственные препараты).
Химия биологически активных соединений тесно связана и оказывает большое влияние на развитие дисциплин медико-биологического профиля, таких, как: молекулярная биология, биохимия, фармакология, токсикология, нормальная и патологическая физиология.
Фундаментальной проблемой химии биологически активных соединений является выяснение взаимосвязи структуры соединения с механизмом его биологического действия. Так, изучение в рамках химии биологически активных соединений структуры и свойств таких биополимеров, как белки и нуклеиновые кислоты, стимулировало развитие представлений о матричном биосинтезе белка и роли нуклеиновых кислот в хранении и передаче генетической информации. Возможность получения синтетических аналогов природных соединений методом органического синтеза открыла пути к выяснению механизмов действия химических соединений в клетке. Поэтому химии биологически активных соединений отводится большая роль в выяснении таких важнейших вопросов, как молекулярный механизм иммунитета, процессов зрения, дыхания, памяти, нервной проводимости, а также механизмов действия ферментов и лекарственных препаратов в организме.
Химия биологически активных соединений базируется на основных понятиях, положениях и методах органической химии, являющейся, преимущественно, химией соединений углерода. Многообразие органических соединений обусловлено способностью атома углерода образовывать разнообразные углеродные цепи, а также специфическим явлением, называемым изомерией.
Новизна учебно-методического пособия заключается в том, что оно составлено согласно рекомендациям образовательного стандарта III поколения. Учебно-методическое пособие выполняет обучающую и прикладную функции, дает возможность студенту самому оценить уровень сформированности знаний по дисциплине.
Мы заранее благодарны всем коллегам, которые, ознакомившись с данным пособием, сообщат нам о замеченных ими просчетах или недостатках.
Авторы-составители
4
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Тема 1 Классификация и реакционная способность органических соединений
Ключевые слова и понятия: функциональная группа, энергия связи, длина связи, электроотрицательность, полярность связи, поляризуемость связи
Классификация органических соединений проводится с учетом строения углеродной цепи и наличием в молекуле функциональных групп. Функциональная группа – это атом или группа атомов неуглеводородного характера, которая, являясь заместителем в углеводородной цепи, определяет принадлежность вещества к определенному классу органических соединений и одновременно его типичные химические свойства.
По строению углеродной цепи органические соединения делятся на: Органические соединения
ациклические (с незамкнутой цепью) |
циклические (с замкнутой цепью) |
||
насыщенные |
ненасыщенные |
карбоциклические |
гетероциклические |
(предельные) |
(непредельные) |
(цикл включает |
(цикл включает |
|
|
только атомы |
кроме атомов |
а) алканы (−) |
а) алкены (=) |
углерода) |
углерода атомы |
|
б) алкины (≡) |
|
других элементов) |
|
|
ароматические |
|
|
|
(содержат бензольное кольцо) |
|
В зависимости от природы функциональных групп производные углеводородов подразделяются на классы: галогенопроизводные, спирты, амины, эфиры, карбоновые кислоты и т.д. Особо важную роль в биологических процессах играют спирты, альдегиды, кетоны, карбоновые кислоты и их функциональные производные, а также гетероциклические соединения.
Реакционная способность органических соединений и факторы, ее определяющие
Реакционная способность и химические свойства органических соединений определяется типом химических связей, природой связываемых атомов и их взаимным влиянием в молекуле. Эти факторы, в свою очередь, зависят от электронного строения атомов и типа взаимодействия их атомных орбиталей.
Часть пространства, в которой вероятность нахождения электрона максимальна, называется атомной орбиталью (АО). В органической химии широко используется понятие о гибридных орбиталях атома углерода, которые характеризуются одинаковой энергией и формой и образуются при взаимодействии между собой двух любых (s, p, d) атомных орбиталей, близких по энергии. Гибридные орбитали за счет большего перекрывания образуют
5

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
более прочные связи, чем негибридизованные. В зависимости от числа вступивших в гибридизацию орбиталей различают три вида гибридизации, соответствующие трем валентным состояниям атома углерода.
В первом валентном состоянии при sp3-гибридизации при взаимодействии одной 2s и трех 2p-атомных орбиталей возбужденного атома углерода возникают четыре равноценные sp3-гибридные орбитали, направленные в пространстве к вершинам тетраэдра под углами 109˚28’. Этот вид гибридизации характерен для атомов углерода в молекулах насыщенных углеводородов и их производных.
Второе валентное состояние, sp2-гибридизация, возникает при взаимодействии одной 2s и двух 2p-атомных орбиталей. Образующиеся три равноценные sp2-гибридные орбитали располагаются в одной плоскости под углом 120˚ друг к другу; а негибридизованная 2p-атомная орбиталь - в перпендикулярной к ней плоскости. В состоянии sp2-гибридизации атом углерода находится в молекулах алкенов, в карбонильной >С=О и карбоксильной
О
−С
ОН группах.
В третьем валентном состоянии при sp-гибридизации у атома углерода имеются две равноценные sp-гибридные орбитали, расположенные линейно под углом 180˚ друг к другу, и две 2p-негибридизированные атомные орбитали, находящиеся в двух взаимноперпендикулярных плоскостях. Такое валентное состояние атома углерода характерно для соединений с тройной связью – алкинов − С≡С− и нитрилов −С≡N.
C 1s22s22p2 |
|
↑↓ |
↑ ↑ |
2s2 |
2p2 |
C* 1s22s12p3 |
|
↑ |
↑ ↑ ↑ |
2s1 |
2p3 |
|
|
sp |
|
алкины − С≡С−, нитрилы −С≡N σ, π |
||
|
|
|
алкены >C=C<, карбонильная >C=O, |
|||
|
|
|
|
|||
|
|
|
|
|||
|
|
sp2 |
|
карбоксильная −С=О , σ, π |
||
|
|
sp3 |
|
|
|
ОН |
|
|
|
|
|
||
|
|
|
||||
|
|
|
алканы −С |
−С− , σ |
||
Основным типом химических связей в органических молекулах являются ковалентные связи, образующиеся за счет обобществления электронов связываемых атомов. Для органических соединений характерны ковалентные σ- и π-связи. σ-связь образуется при осевом перекрывании двух любых (s, p или гибридных) атомных орбиталей по прямой, соединяющей центры связываемых
6
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
атомов. π-связь образуется при боковом перекрывании негибридизированных p- атомных орбиталей с максимумом перекрывания по обе стороны от прямой, соединяющей центры атомов. Кроме одинарных, существуют кратные – двойные (одна σ и одна π) и тройные (одна σ и две π) ковалентные связи.
Характеристиками ковалентной связи являются:
1.Энергия связи – Энергия, выделяющаяся при образовании данной связи, или затрачивающаяся для разъединения двух связанных атомов. Чем больше энергия связи, тем связь прочнее.
2.Длина связи - расстояние между центрами связанных атомов.
3.Электроотрицательность – способность атома притягивать к себе электроны, обобществляемые при образовании химической связи. Чем больше электроотрицательность атома, тем сильнее он притягивает электроны ковалентной связи.
4.Полярность связи – обусловлена различием в электроотрицательности связываемых атомов и выражается в неравномерности обобществления электронов атомами. Полярность связи тем больше, чем больше разность электроотрицательностей связанных атомов.
5.Поляризуемость связи – мера смещения электронов связи под влиянием внешнего электрического поля, включая поле других частиц и атомов. Поляризуемость определяется подвижностью электронов, которые тем подвижнее, чем дальше расположены от ядер. Поэтому поляризуемость π-связи, у которой максимум электронной плотности находится дальше от связываемых ядер, значительно выше, чем σ-связи. Поляризуемость в большей степени, чем полярность, определяет реакционную способность молекул по отношению к полярным реагентам.
Важной разновидностью ковалентной связи, которая реализуется в органических молекулах и играет большую роль при формировании пространственной структуры белков, углеводов, нуклеиновых кислот, является водородная связь. Она образуется, когда атом водорода в молекуле связан с сильно электроотрицательным атомом (O, N, S), благодаря чему он становится электронодефицитным (электроположительным) и способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома, находящегося либо в этой же молекуле (внутримолекулярная), либо в другой молекуле (межмолекулярная связь).
Взаимное влияние атомов и способы его передачи в органических молекулах. Сопряжение
В органических молекулах двойная связь, являющаяся сочетанием σ- и π- связей, может располагаться локализовано; например, в углеводородных цепях алкенов – между двумя углеродными атомами. В органических соединениях других классов – в углеводородном радикале, а также между атомом углерода и гетероатомом (O, N, S). При этом, поскольку электронная плотность π-связи охватывает только два ядра связываемых атомов, связь называется локализованной, двухцентровой. Такие связи часто встречаются
7
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
в природных соединениях, например, в ненасыщенных высших карбоновых кислотах.
Однако, особо большое значение в биологических процессах имеют сопряженные системы – соединения с чередующимися двойными и одинарными связями. Образование сопряженной многоцентровой системы сопровождается частичным выравниванием длин связей (нет «чистых» одинарных и «чистых» двойных); обобществлением p-электронов и делокализацией электронного облака. При этом происходит выделение энергии; система переходит на более низкий энергетический уровень, становясь более устойчивой и стабильной. Мерой термодинамической устойчивости такой системы является энергия сопряжения, которая выражается разностью полной π-электронной энергии несопряженной системы (с локализованными связями) и π-электронной энергии всей сопряженной системы. Чем длиннее цепь сопряжения, тем больше выигрыш энергии при ее образовании. Различают сопряженные системы с открытой и замкнутой цепью; с π,π или p,π сопряжением, с углеродной цепью или цепью, содержащей гетероатом.
Системы с открытой цепью сопряжения Сопряжение в открытых системах, т.е. в незамкнутых цепях возникает
при следующих условиях:
1.в молекуле имеется чередование одинарных и двойных связей;
2.атомы углерода, участвующие в образовании сопряженной системы, находятся в состоянии sp2-гибридизации. Вместе со всеми σ-связями они лежат в одной плоскости, образуя плоский σ-скелет молекулы;
3.pz-орбитали всех атомов перпендикулярны плоскости σ-скелета и параллельны друг другу, что обуславливает их перекрывание и делокализацию электронной плоскости.
Простейшей π,π-сопряженной системой с открытой углеродной цепью является бутадиен-1,3. В его молекуле все атомы углерода находятся в состоянии sp2-гибридизации. Вместе с атомами водорода и σ-связями они лежат в одной плоскости и образуют σ-скелет молекулы. Негибридизованные pz- орбитали каждого атома углерода, имеющие по одному электрону, перпендикулярны плоскости σ-скелета и параллельны друг другу, что способствует их взаимному перекрыванию. Перекрывание происходит как между атомами С1 и С2, С3 и С4, так и частично между атомами С2 и С3, что приводит к усреднению длин связей и обобществлению электронов. Четыре p- электрона одновременно находятся в поле ядер четырех атомов углерода, образуя единое делокализованное π-электронное облако. Выигрыш энергии, т.е. энергия сопряжения, - 15 кДж/моль. Такой тип является π,π-сопряжением, т.к. перекрываются p-орбитали π-связей.
8
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
бутадиен-1,3 Н2С=СН−СН=СН2 → С1 − С2 − С3 − С4
Сопряжение возможно не только в углеводородной цепи с чередующимися двойными и одинарными связями между атомами углерода, но и в гетероуглеродных молекулах, когда двойные и одинарные связи чередуются как между атомами углерода, так и между атомом углерода и гетероатомом (О, N, S). При этом возникает как π,π, так и р,π-сопряжение.
К открытым р,π-сопряженым системам с гетероатомом в цепи относятся α,β-ненасыщенные карбонильные соединения, содержащие структурный
фрагмент |
Х |
−СН=СН−С |
, |
в котором гетероатом Х (кислород), связанный с углеродным атомом двойной связью, поставляет в цепь сопряжения р-орбиталь с одним электроном. Примером может служить пропеновый альдегид (акролеин), у которого в сопряжение вступают четыре р-орбитали (от трех атомов углерода и атома кислорода), имеющие по одному электрону. В результате единое четырехэлектронное π-облако делокализуется на четырех атомах цепи:
О |
О |
Н2С=СН−С |
→ С − С − С |
Н |
|
К открытым р,π-сопряженым системам с гетероатомом в цепи относятся соединения, содержащие структурный фрагмент −СН=СН−Х, где гетероатом Х (О, N, S, галоген), отделенный от двойной связи одинарной σ-связью, поставляет в систему сопряжения р-орбиталь с неподеленной электронной парой. Примером может служить молекула дивинилового эфира, в котором в сопряжение вступают четыре четыре р-орбитали четырех атомов углерода, имеющие по одному электрону, и р-орбиталь атома кислорода, содержащая неподеленную электронную пару. При этом образуется единое шестиэлектронное облако, делокализующееся на пяти атомах цепи:
Н2С=СН−О−СН=СН2 → С − С − О − С − С
Сопряжение в открытых системах широко распространено в биологически важных соединениях – каротиноидах (растительные пигменты), витаминах (ретинол, ретиналь), которые в общем случае можно назвать полиенами.
9
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Сопряжение системы с замкнутой цепью. Ароматичность Среди сопряженных систем с замкнутой цепью наибольший интерес
представляют соединения, обладающие ароматичностью, т.е. совокупностью признаков, обуславливающих их повышенную термодинамическую устойчивость по сравнению с открытыми сопряженными системами. В 1931 году Хюккель сформулировал критерии ароматичности, согласно которым, система обладает ароматичностью, если:
1.Молекула имеет циклическое строение и содержит чередующиеся двойные и одинарные связи;
2.Все атомы углерода находятся в состоянии sp2-гибридизации. Вместе со всеми σ-связями они лежат в одной плоскости, образуя плоский σ-скелет молекулы;
3.Все pz-орбитали перпендикулярны σ-скелету и параллельны друг другу, что обуславливает их взаимное перекрывание;
4.Образуется делокализованная π-электронная система, охватывающая все
атомы цикла и содержащая (4n+2) π-электронов; n=1,2…
Замкнутой сопряженной системой с углеводородным циклом, которая соответствует всем критериям ароматичности Хюккеля, является бензол. В его молекуле шесть атомов углерода находятся в состоянии sp2- гибридизации и образуют цикл. Система С−С и С−Н σ-связей составляют плоский σ-скелет молекулы. Перпендикулярно ему располагаются шесть негибридизованных р-орбиталей шести углеродных атомов, дающие в сопряжение по одному электрону. Взаимно перекрываясь р-орбитали образуют замкнутую сопряженную систему. В ней все связи имеют одинаковую длину, среднюю между длинами одинарных и двойных связей, а единое π-электронное облкко делокализуется, охватывая все шесть атомов углерода. При этом оно располагается симметрично над и под плоскостью σ- скелета. При n=1 такая сопряженная система содержит (4n+2), т.е. шесть π- электронов. Выигрыш энергии при ее образовании, т.е. энергия сопряжения, 150 кДж/моль. Поэтому бензол термодинамически очень устойчив – выдерживает нагревание до 900˚С.
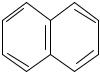
Конденсированные бензоидные системы, в которых нет атомов, общих более чем для двух циклов, также соответствуют критериям Хюккеля и являются ароматическими. Например нафталин при n=2 его сопряженная система содержит 10 π-электронов:
нафталин
Гетероциклические ароматические соединения
10
