
- •Термохимия
- •Описание устройства калориметра
- •Определение постоянной калориметра
- •Обработка результатов калориметрических измерений и проведение расчетов
- •Определение теплоты растворения соли в воде
- •Определение теплоты реакции нейтрализации
- •Определение теплоты образования кристаллогидрата
- •Химическое равновесие
- •Определение констант равновесия реакции комплексообразования
- •Определение константы устойчивости
- •Результаты измерений оптической плотности
- •Изучение зависимости константы устойчивости комплекса от температуры
- •Температурная зависимость константы устойчивости
- •Влияние температуры на равновесие в системе жидкость - пар
- •Порядок работы на установке
- •Зависимость температуры кипения жидкости от давления
- •Обработка экспериментальных данных
- •Электрохимия растворов электролитов
- •Электропроводность растворов электролитов
- •Порядок работы на кондуктометре «Эксперт-002»
- •Определение константы сосуда
- •Определение константы диссоциации органической кислоты
Термохимия
Цель работы. Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами. Определение тепловых эффектов различных реакций калориметрическим методом.
Описание устройства калориметра
При выполнении работ по термохимии основным прибором для измерения тепловых эффектов является калориметр.
Калориметры бывают нескольких типов, классификация их проводится по таким признакам, как принцип действия, тип исследуемых процессов, агрегатное состояние рабочего тела, способ перемешивания и другие. Если перемешивание проводится с помощью мешалки, такой калориметр называется статическим. Особое внимание уделяется измерению изменения температуры, при этом всегда стремятся достичь наибольшей точности. В качестве измерителя температур используются: термометр Бекмана (термометр расширения), термометры сопротивления, термопары и другие датчики температуры.
Наиболее часто в лабораторном практикуме применяются изопериболический жидкостной калориметр смешения (растворения), в котором учитывается теплообмен с окружающей средой путем введения поправки при расчете изменения температуры в ходе проведения опыта.
Схема калориметрической установки, используемой в работе, приведена на рис I.1.
1
2
3
4
5
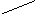




Она состоит из реакционного сосуда (3) с двойными стенками (сосуд Дьюара), минимизирующего теплообмен с окружающей средой, закрытого крышкой. На его дно опущен магнит в защитной оболочке (4). Через крышку в реакционный сосуд вводится термодатчик (1) и воронка (2) для загрузки реагирующих веществ. В качестве рабочего тела используется дистиллированная вода (200 мл). Перемешивание реакционной смеси проводится с помощью магнитной мешалки (5).
В качестве измерителя температур - термометр сопротивления. Принцип его действия основан на том, что металлы и полупроводники могут изменять свое сопротивление при изменении температуры. Достоинствами термометров сопротивления являются: высокая точность измерения температуры, возможность автоматической записи, передача показаний на расстояние и др. Термометр сопротивления соединен с измерительным блоком «Эксперт-001» в качестве регистрирующего прибора. На дисплее прибора в реальном времени отображается график изменения температуры. Возможно подключение к компьютеру.
Определение постоянной калориметра
Независимо от выбранной системы измерения для расчета теплоты растворения (или другого процесса) необходимо знать так называемую постоянную калориметра К.Эта величина представляет собой сумму теплоемкостей всех частей калориметра:
К = Сkmk(Дж/К), (I.0)
где Сkудельные теплоемкости каждой из частей калориметра (Дж/г К),mkмассы отдельных частей калориметра: мешалки, стакана, воды, термометра сопротивления (г) или любого другого датчика температур.
По физическому смыслу К представляет собой количество тепла, которое требуется для нагревания калориметра на один градус. Постоянная калориметра может быть определена опытным путем. Одним из методов определения является расчет её через теплоту растворения точной навески вещества с известной удельной теплотой растворения по уравнению:
![]() (Дж/ К) (I.0)
(Дж/ К) (I.0)
где qР В - удельная теплота растворения вещества (Дж/г ),mР В– точная навеска растворяемого вещества (г),- изменение температуры калориметра в процессе растворения вещества (К)
Таблица I.1
|
t0C |
10-3кг/м3 |
t0C |
10-3кг/м3 |
t0C |
10-3кг/м3 |
|
20 |
0,99823 |
24 |
0,99732 |
28 |
0,99626 |
|
21 |
0,99802 |
25 |
0,99707 |
29 |
0,99597 |
|
22 |
0,99780 |
26 |
0,99681 |
30 |
0,99567 |
|
23 |
0,99756 |
27 |
0,99654 |
35 |
0,99406 |
При определении постоянной калориметра в качестве растворителя используется дистиллированная вода, а в качестве растворяемого вещества - хлорид калия. Необходимая для расчета К величина удельной теплоты растворения хлорида калия при условиях опыта приведена в табл.31 на стр.46 “Краткого справочника физико-химических величин” [1]. По данным таблицы строится график зависимости интегральной теплоты растворения 1 моль хлорида калия от конечной концентрации раствора, выраженной числом моль соли, растворенных в 1000 г воды. По построенному графику определяется теплота растворения 1 моль хлорида калия при температуре опыта. В проведенном опыте по определению постоянной калориметра измеренными величинами являются объем воды и величина навески соли. Для расчета конечной концентрации раствора соли необходимо знать еще и массу воды, которую легко рассчитать по известной плотности. Данные по плотности воды приведены в табл.I.1. Найденная из графика величина теплоты растворения пересчитывается на удельнуюq[Дж/г], которая и используется для определения постоянной калориметра по уравнению (I.2).
