- •Исследование спектров люминесценции
- •Ультрафиолетовое излучение. Первичные механизмы действия ультрафиолетового излучения на биологические объекты.
- •Уф условно делится на три области
- •2. Устройство и принцип работы ртутных ламп
- •Вопрос 3. 10 минут
- •3. Инфракрасное излучение. Первичные механизмы действия инфракрасного излучения на биологические объекты. Аппараты светолечения.
- •4. Люминесценция, ее виды. Характеристики люминесценции (спектр, длительность, квантовый выход). Законы Вавилова и Стокса.
- •Фотолюминесценция. Правило Стокса.
- •Флуоресценция и фосфоресценция.
- •Синглетная
- •Хемилюминесценция. Собственная, активированная и биолюминесценция Классификация хемилюминесценции.
- •Молекулярный механизм хемилюминесценции.
- •Собственное свечение клеток и тканей животных
- •Реакции с участием активных форм кислорода и азота
- •Свечение при реакциях цепного окисления липидов
- •Активированная хемилюминесценция
- •Биолюминесценция
Лабораторная работа №20
«Определение собственной люминесценции белка»
Цель работы:При помощи экспериментальной установки определить спектр собственной люминесценции белка.
Вопросы теории ( исходный уровень)
Люминесценция, ее виды. Характеристики люминесценции (спектр, длительность, квантовый выход). Законы Вавилова и Стокса. Люминесцентный анализ. Люминесцентные метки и зонды. Медицинское применение люминесцентных методов исследования. Лекция № 14)
Содержание занятия:
1.Выполнить работу по указаниям в руководстве к данной работе.
2.Оформить отчет.
3.Защитить работу с оценкой.
4.решить задачи.
Задачи
Исследование спектров люминесценции
Спектром люминесценции называется кривая зависимости интенсивности люминесценции от длины волны (или частоты): I = f (), Интенсивность люминесценции выражается обычно в величинах пропорциональных энергии или числу квантов.
Качественный и количественный анализ веществ в растворе и в живой клетке может производиться по спектрам люминесценции аналогично тому, как это было описано выше для спектров поглощения. Преимуществом люминесцентного метода является его более высокая чувствительность.
Интенсивность
люминесценции пропорциональна количеству
света, поглощаемого объектом в единицу
времени. Как
видно из уравнения
![]() ,
поглощение (I0
I)
не пропорционально концентрации, а
изменяется при
увеличении концентрации по логарифмическому
закону, асимптотически приближаясь кполному поглощению,
Изменение интенсивности люминесценции
с концентрацией следует тому же закону.
,
поглощение (I0
I)
не пропорционально концентрации, а
изменяется при
увеличении концентрации по логарифмическому
закону, асимптотически приближаясь кполному поглощению,
Изменение интенсивности люминесценции
с концентрацией следует тому же закону.
При малых концентрациях интенсивность люминесценции прямо пропорциональна концентрации. Поэтому количественное определение концентрации люминесцирующих веществ проводят при минимальной оптической плотности раствора (D0,10,2).
Свет люминесценции частично вновь поглощается в самой толще объекта. Это явление носит название реабсорбции люминесценции. В результате реабсорбции происходит уменьшение интенсивности и искажение спектров люминесценции. Эффект реабсорбции наиболее выражен в концентрированных растворах и при измерениях в толстых слоях. Поэтому, чтобы уменьшить реабсорбцию, следует измерять люминесценцию в тонких слоях и при возможно меньших концентрациях раствора(D 0,1 — 0,2).
Измерение спектров люминесценции является одним из основных методов изучения состояния веществ в биологических системах, так как даже незначительные изменения состояния вещества: агрегация, комплексообразование, изменение кислотно-основного равновесия и т. д., часто очень сильно сказывается на его люминесцентных свойствах.
На основании данных о люминесценции можно судить также о величине кванта энергии, запасаемой в молекуле (по положению максимума люминесценции), о времени сохранения энергии возбуждения в молекуле (по скорости затухания люминесценции) и о процессах растраты энергии молекулой (по интенсивности люминесценции). Если в системе поглощают молекулы одного вещества, а флуоресцируют молекулы другого вещества, то проводя измерения спектров поглощения и люминесценции, можно изучать механизм межмолекулярных переносов энергии (миграции энергии).
Лабораторная работа. Измерение спектров люминесценции
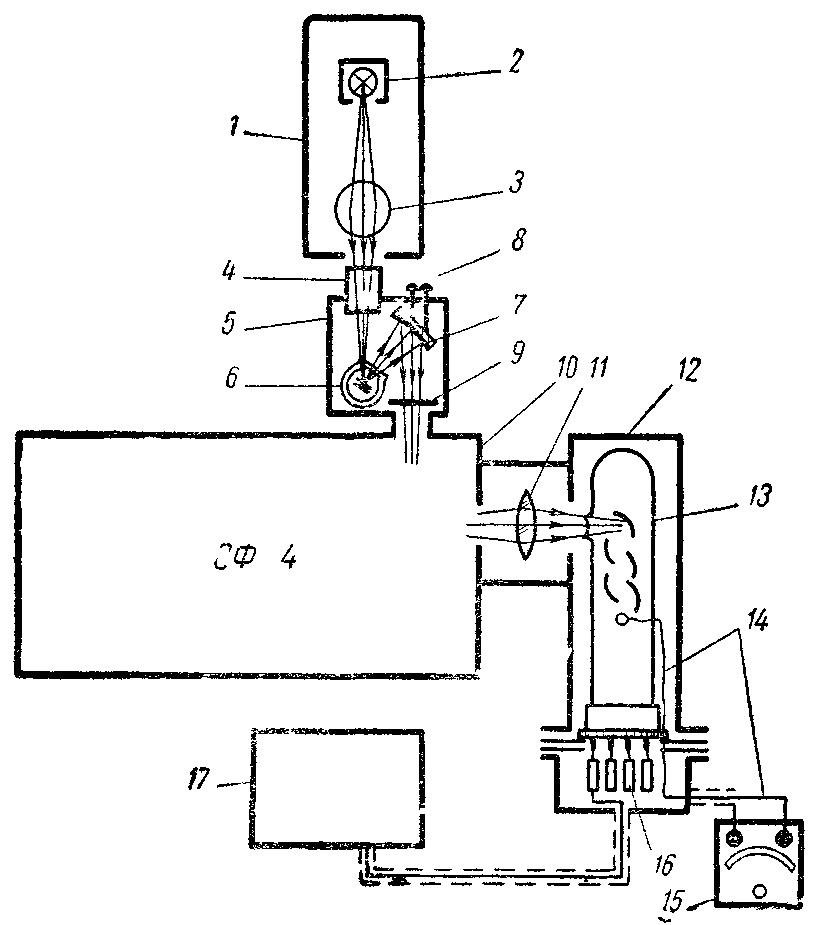
Схема установки для измерения спектров люминесценции в видимой и ультрафиолетовой области приведена на рис. 80. Возбуждающий свет ртутно-кварцевой лампы фокусируется на объект, укрепленный в держателе, а свет люминесценции фокусируется вогнутым алюминированным зеркалом на входную щель монохроматора СФ-4. После выхода из моно-хроматора свет собирается кварцевой линзой на фотокатод фотоумножителя. Фототок измеряется с помощью какого-либо чувствительного гальванометра, например, М-91/А.
Возбуждение люминесценции. Люминесценция возбуждается светом ртутно-кварцевой лампы СВД-120 или СВДШ-250 с соответствующими светофильтрамии фокусирующими конденсорами (описание осветительных устройств см. стр. 348—352).
|
|
Рис. 80.Установка для измерения спектров люминесценции. 1— осветительное устройство, 2— лампа СВД-120 в кожухе, 3— кварцевая колба с раствором Бекштрема (светофильтр и конденсор), 4— газовый хлор-бромный фильтр,5 — светонепроницаемая камера для объекта,6 — сосуд Дьюарас держателем объекта (при измерениях при комнатной температуре вместо сосуда Дьюара ставится обойма для кюветодержателя — см. рис. 84), 7 — алюминиевое вогнутое зеркало, 8—котировочные винты для перемещения вогнутого зеркала, 9— светофильтр на входе монохроматора, 10 — монохроматор СФ-4,11 — кварцевая линза, фокусирующая свет на фотокатод,12— кожух фотоумножителя,13— фотоумножитель,14— выход сигнала с ФЭУ,15— гальванометр М-91/А, 16— делитель напряжения, 17— источник высокого напряжения для питания ФЭУ
|
Светофильтры используются для выделения отдельных участков спектра. Основной характеристикой всякого светофильтра является величина его пропускания (Т) при различных длинах волн:
![]() ,
,
где I0 —интенсивность падающего, а I —интенсивность пропущенного светофильтром монохроматического света.
Пропускание системы из двух светофильтров (Тав) равно Та Т в.
При измерении люминесценции существенно отделить рассеянный объектом возбуждающий свет от света люминесценции. Важно, чтобы светофильтр, помещенный на пути возбуждающего света передобъектом, совершенно не пропускал света в области, где измеряется люминесценция, и, наоборот, пропускалкак можно больше света в области поглощения объекта (рис. 86).
|
Рис.
86 |
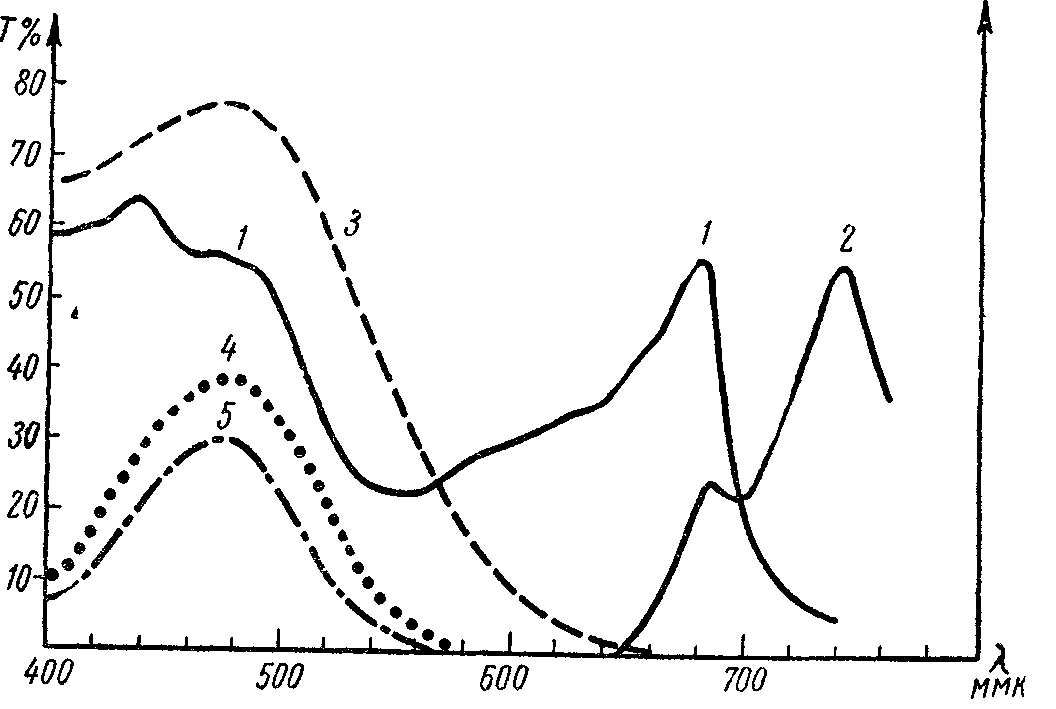
Рис. 86.Выбор светофильтра для возбуждениялюминесценции: 1— спектр поглощения листа фасоли, 2— спектр флуоресценции листа, 3— пропускание светофильтра СЗС-8 (светофильтр хорошо пропускает в области поглощения листа, но не может быть использован, т. к. пропускает и в области флуоресценции), 4 — пропускание светофильтра СЗС-9, применяемого при люминесценции в области более 640 ммк, 5— пропускание светофильтров СЗС-8 и СЗС-9, комбинация которых позволяет измерять спектры люминесценции этиолированных и зеленых листьев, начиная от 600 мм |
При выборе светофильтров следует исходить из спектра поглощения объекта и правила Стокса, согласно которому спектр люминесценции сдвинут в длинноволновую сторону по сравнению со спектром поглощения.
Система из двух различных светофильтров пропускает свет только тех длин волн, который пропускают оба светофильтра. Использование комбинации из нескольких фильтров часто позволяет выделять довольно узкие участки спектра. Кривые пропускания Т =f() нескольких стеклянных светофильтров,применяемых для измерения люминесценции, изображены на рис. 86. Стеклянные светофильтры, выпускаемые промышленностью, снабжаются паспортами, в которых приведены кривые пропускания и другие характеристики светофильтров. При работе в ультрафиолетовой области спектра приходится использовать наряду со стеклянными жидкостные и газовые светофильтры. Например, для возбуждения люминесценции белков в области 240—280 ммк используют комбинацию жидкостного светофильтра Бекштрема и газового хлорбромного фильтра от ультрафиолетового микроскопа МУФ.
Жидкостный фильтр Бекштрема представляет собой раствор сернокислого никеля (303 г/л) и сернокислого кобальта (86,5 г/л) в дистиллированной воде. Такой раствор, разведенный в три-пять раз, наливают в кварцевую колбу, которая служит одновременно светофильтром, тепловым фильтром и конденсором(см. рис. 80 и 81, Б). Концентрацию раствора Бекштрема в колбе желательно подобрать такой, чтобы светофильтр пропускал как можно больше света в области 240—480ммк, совершенно не пропуская света в области 282—530 ммк. Для проверки измеряют отражение света от алюминиевой пластинки, помещенной на месте объекта. Если светофильтр приготовлен правильно, то интенсивность линии 265 ммк должна быть максимальной и в то же время должна совершенно отсутствовать в отраженном свете линия 435 ммк. Для уменьшения интенсивности рассеянного возбуждающего света перед входной щелью монохроматора помещают светофильтры, пропускающие только светв исследуемой области люминесценции и не пропускающие возбуждающего света. Так, например, при исследовании белков используется светофильтр БС-2, отсекающий возбуждающий свет (240—280 ммк) и пропускающий более длинноволновую люминесценцию. При измерении спектров люминесценции хлорофилла применяют красный светофильтр, пропускающий только люминесценцию пигмента.
Камера для объекта. Газовый светофильтр, держатель объекта и зеркало для фокусировки светалюминесценции на щель монохроматора помещают в светонепроницаемой камере (например, из эбонита;» см. рис. 80). При комнатной температуре растворы измеряют в кюветах от спектрофотометра СФ-4, которые укрепляют в металлическом держателе, вставляемом в обойму (см. рис. 84, А). При низких температурах объект помещают в металлическую кювету, которую либо непосредственно погружают в сосуд Дьюара с жидким азотом, либо укрепляют в держателе, служащем холодопроводом (см. рис. 84, Б). Перемещение фокусирующего зеркала (поворот вокруг оси и приближение к щели) производят с помощью котировочных винтов.
Работа на установке. Включение установки и предварительная фокусировка возбуждающего света были описаны выше. Окончательную фокусировку лучшевсего производить, используя в качестве объекта раствор хорошо люминесцирующего вещества с известным спектром люминесценции.
При работе в ультрафиолетовой области объектом может служить пустая кювета от СФ-4 со стеклянной крышкой спектрофотометра, которая при возбуждении в области 240—280 ммк люминесцирует в области около 400ммк. Изменяя поворот зеркала и его расстояние от объекта, добиваются максимального отклонения стрелки гальванометра. Для фокусирования света на фотокатод перемещают фокусирующую линзу перед фотоумножителем, также добиваясь максимального показания прибора. Напряжение на ФЭУ подбирается согласно правилам, изложенным выше, так, чтобы величина темнового тока составляла 4—5 делений по шкале гальванометра (амплитуда шумовпри этом будет не более чем 1—2 деления). Ширина щелей монохроматора должна быть по возможности наименьшей, так как это обеспечивает наилучшее разрешение структуры спектра. Как правило, ширина щели устанавливается такой, чтобы при оптимальной фокусировке стрелка гальванометра отклонялась навсю шкалу при длинах волн, соответствующих максимуму в спектре люминесценции. Желательно, чтобы при измерении в области 300—400ммк ширина щелине превышала 0,1 мм, а в более длинноволновой области составляла несколько сотых миллиметра.
Для измерения люминесценции растворы наливают в пробирку или кювету, укрепляемую в держателе; при измерении в вакууме удобно пользоваться трубками Тунберга (см. рис. 84). Такие объекты, как листья растения, можно укрепить на держателе,изображенном на рис. 84.
Для контроля на рассеянный свет при измерениях растворов при комнатной температуре и растворов или гомогенатов при температуре жидкого азота производят измерения с растворителем. Показания прибора для каждой длины волны при измерении растворителя вычитают из показаний, полученных при измерении люминесценции раствора в той же самой кювете и в идентичных условиях.
Измерение люминесценции при низкой температуре. При низких температурах тормозятся биохимические процессы и темновые стадии фотохимических реакций. При измерениях люминесценции объект предохраняется от фотохимического действия интенсивного возбуждающего света. Низкотемпературные спектры люминесценции позволяют получить ряд
новых сведений о свойствах вещества и его состоянии в биологической системе.
Понижение температуры сопровождается усилением флуоресценции. При этом более четко проявляется тонкая структура спектров люминесценции. При глубоком охлаждении многих биологических объектов удается наблюдать и исследовать наряду с флуоресценцией также и их фосфоресценцию. Наиболее просто измерить люминесценцию при глубоком охлаждении объекта можно, поместив кювету с образцом непосредственно в жидкий азот (температура — 196°С), налитый в прозрачный (непосеребренный) сосуд Дьюара.
При изучении ультрафиолетовой люминесценции необходимо применять кварцевые сосуды Дьюара с впаянными окошками из прозрачного оптического кварца, так как обычный кварц сильно люминесцирует. При измерении люминесценции в жидком азоте необходимо проводить контрольные измерения люминесценции растворителя, кювет и сосуда Дьюара. Спектр, полученный при измерении растворителя, вычитается из спектра, полученного при измерении раствора в тех же условиях.
Работа с жидким азотом требует соблюдения ряда предосторожностей. При ударе сосуд Дьюара может взорваться и поранить осколками окружающих; попадание жидкого азота на кожу может привести к сильному обмораживанию. Сосуды Дьюара нельзя плотно затыкать пробками. На стеклянные сосуды Дьюара нужно надевать чехлы из плотной материи или металлические сетки; при работе рекомендуется надевать защитные стеклянные очки. Наливая жидкий азот в стеклянный сосуд Дьюара, нужно вначале «ополоснуть» его, чтобы охлаждение стенок не было слишком резким. При переливании жидкого азота из стеклянного сосуда необходимо медленно вращать сосуд, чтобы его края охлаждались равномерно. Резкое охлаждение теплых стенок стеклянного сосудаДьюара приводит к взрыву.
Жидкий азот бесцветен. Если налитый в сосуд Дьюара азот имеет голубоватый оттенок, это говорито примеси кислорода. С жидким азотом, содержащим кислород, а тем более с жидким воздухом работать опасно! Охлаждение биологического объекта жидким азотом нужно проводить быстро; при этом структура объекта меньше повреждается, и предотвращается образование агрегатов в растворе. Однако слишком быстрое замораживание может привести к повреждению кювет и растрескиванию образца. Поэтому рекомендуется производить охлаждение, быстро погружая кювету с раствором в жидкий азот и вынимая ее обратно несколько раз подряд, так, чтобы вся операция охлаждения занимала 15—39 сен. Объект для измерения люминесценции помещают в прозрачный сосуд Дьюара (см. рис. 84,Б). Если стенки сосуда запотевают, нужно смазывать их 5-процентным раствором глицерина в спирте. От обмерзания поверхности сосуда* Дьюара можно избавиться, обдувая окошко током воздуха. При замораживании водных растворов происходит увеличение объема, поэтому пробирки и трубки Тунберга при погружении в жидкий азот лопаются. Чтобы избежать этого, водные растворы охлаждаются либо на поверхности стеклянной пластинки, либо в предварительно охлажденной металлической кювете (кюветы от СФ-4 охлаждать нельзя).
Упражнение 1.
Измерение спектра люминесценции белка при комнатной и низкой температуре
Схема установки для измерения спектров люминесценции приведена на рис. 85. Люминесценция белка возбуждается с помощью осветителя с лампой СВД-120А (см. рис. 81, Б). Область возбуждения люминесценции 240—280 ммк выделяется с помощью комбинации светофильтров: жидкостного фильтра Бекштрема и газового хлорбромного светофильтра от ультрафиолетового микроскопа МУФ. Для уменьшения рассеянного света перед входом спектрофотометра помещается светофильтр БС-2, пропускающий только свет люминесценции (более 280 ммк). На выходе моно-хроматора СФ-4 помещают фотоумножитель ФЭУ-18 в кожухе.
Включение фотоумножителя и подбор напряжения питания — см. упражнение 1 на стр. 346, включение лампы СВД-120А и фокусировку осветительногоустройства — см. упражнение на стр. 350.
Приготавливают раствор белка (например, сывороточного альбумина человека) в концентрации 1 мг/мл. Заполняют им круглую кювету с кварцевыми крышками от спектрофотометра СФ-4. Кювету укрепляют в держателе, который помещают в обойму в камере для объекта (см. рис. 84, Л). Подбирают ширину щели, при которой отклонение стрелки гальванометра при 245 ммк будет равно 25—50 делениям. Вращают барабан длин волн и производят отсчеты по шкале гальванометра через каждые 5 ммк в интервале длин волн 285—450 ммк. Поскольку под действием возбуждающего света происходит «выцветание» белка, сопровождающееся уменьшением люминесценции, измерения нужно производить по возможности быстро, разумеется, не жертвуя .при этом точностью. Измерения спектра проводят два раза: один раз, вращая барабан длин волн в сторону больших, а другой раз — в сторону меньших длин волн,—и берут среднюю из двух измерений (I). Точно таким же образом производят контрольные измерения, поместив на место кюветы с раствором белка кювету с водой (IК ).
Затем следует рассчитать величину энергии излучения флуоресцирующего образца (в относительных единицах) при каждой длине волны:
![]()
где А — поправка на спектральную чувствительностьприбора.
На основании
полученных данных строят кривую спектра
люминесценции белка, откладывая по осиабсцисс длину волны,
а по оси ординат — энергию
излучения
![]() .
.
Измерения спектров люминесценции белка при температуре жидкого азота производятся на той же установке, но на место обоймы с кюветодержателем помещают сосуд Дьюара с кварцевыми окошками /см. рис. 84, Ь), в который наливают жидкий азот правила работы с жидким азотом см. стр. 380—381).
Раствор белка (1
мг/мл) наливают
в металлическую кювету,
предварительно охлажденную в жидком
азоте. Как только
раствор замерзнет, кювету опускают в
сосуд Дьюара, укрепленный в установке.
Угол между поверхностью образца и
направлением светового
пучка от осветителя должен быть почти
прямым. Сохраняя этот угол постоянным,
следует поворачивать сосуд Дьюара
вокруг оси, наблюдая за изменениями
величины фототока
при 340 ммк (I).
Эта величина будет
максимальной при хорошей фокусировке
света от образца
на входную щель монохроматора. Ту же
операцию следует
повторить, вынув кювету из сосуда Дьюара
и поставив длину волны 400ммк. Желательно
добиться того, чтобы фототок при этом
был минимальным,
так как он обусловлен флуоресценцией
стенок сосуда
Дьюара (IК).
Следует установить сосуд
Дьюара таким образом, чтобы отношение
![]() было наибольшим.
было наибольшим.
Измерение спектров люминесценции производится в области 285—530 ммк через каждые 5 ммк. В остальном измерение спектра и его построение производятся так же, как и в предыдущем упражнении.
Упражнение 2.
Измерение спектров люминесценции суспензии дрожжей в видимой области
Измерения производятся при комнатной температуре в основном так же, как и в предыдущем упражнении. Возбуждение осуществляется с помощью осветительного устройства с лампой ДРШ-250 (см. рис. 81, Л и стр. 350), свет проходит через светофильтрУФС-3 (область возбуждения 313—-366 мк). Объект исследования (5-процентная суспензия пекарских дрожжей в воде) помещают в кювете от СФ-4 в светонепроницаемую камеру. Перед входом в монохроматор помещают светофильтр ЖС-4, пропускающий только свет люминесценции в области 380 ммк. В качестве приемника света может быть использован фотоумножитель ФЭУ-18 или ФЭУ-17, Измерения производятся в области 400 — 600 ммк через каждые 5 ммк.
Контролем служит кювета с водой. В остальном измерение и построение спектра производится так же, как и в упражнении 1.
Упражнение 3.
Измерение спектров люминесценции раствора пигментов и листьев растений
Измерения проводятся на установке, схема которой представлена на рис. 80. Для возбуждения люминесценции используют осветитель с лампой ДРШ-250 (см. рис. 81, А), свет которой проходит через систему светофильтров СЗС-8 + СЗС-9, выделяющих область возбуждения 380-580 ммк. Образец опускают в стеклянный сосуд Дьюара, в который при низкотемпературных измерениях наливают жидкий азот. Перед входом в спектрофотометр СФ-4 помещают красный светофильтр КС-2, отсекающий рассеянный возбуждающий свет. В качестве приемника света необходимо использовать фотоумножитель ФЭУ-22, чувствительный в длинноволновой области спектра. Включение фотоумножителя и осветительного устройства см. стр. 346-355.
Готовят из листьев спиртовый экстракт с оптической плотностью при 660 ммк около 0,1—0,2 (см. упражнение 2 на стр. 359). Пробирку с экстрактом помещают в сосуд Дьюара в камере для объекта. Спектр люминесценции измеряют в области 630 — 760 ммк через каждые 5 — 10ммк. Раствор хлорофилла выцветает при освещении, поэтому измерения следует производить достаточно быстро и повторять регистрацию спектра дважды: с коротковолнового идлинноволного конца спектра (см. упражнение 1). Затем измеряют спектр новой порции того же экстракта при температуре жидкого азота.
Укрепляют зеленый лист растения (например, фасоли) на держателе в сосуде Дьюара (см. рис. 84, Б). Измерения при комнатной температуре проводят аналогично измерениям экстракта пигментов. Для измерения спектра при глубоком охлаждении берут второй лист (или половину листовой пластинки) с того же растения, который укрепляют в держателе и погружают в сосуд Дьюара, предварительно наполненный жидким азотом. Измерение спектра производят в области 640—800 ммк однократно (при температуре жидкого азота пигмент почти не выцветает).
На основании полученных данных следует построить спектры флуоресценции экстракта и зеленого листа при низкой и комнатной температуре и проанализировать, как отличается спектр нативного пигментаот спектра пигмента в растворе и каким образом влияет охлаждение на спектр люминесценции.