
- •1.139. При хлорировании 3,36 г порошкообразного железа газовой смесью хлора и хлороводорода получили 9,04 г продуктов реакции. Определите плотность исходной газовой смеси по водороду.
- •4.73. Определите массу нитрида магния, подвергшегося полному разложению водой, если для солеобразования с продуктами гидролиза потребовалось 150 мл 4%-ой соляной кислоты (ρ 1,018 г/мл).
- •4.74. Карбид алюминия обработали 320 г 22%-ой соляной кислоты. При этом выделилось 6,72 л метана (н. У.). Рассчитайте массовые доли веществ в полученном растворе.
- •4.108. Определите массу натрия, который надо внеси в 5%-ный раствор гидроксида натрия массой 120 г, чтобы массовая доля щелочи повысилась до 25%.
- •4.109. В каких массовых соотношениях надо взять 78%-ный раствор серной кислоты и 10%-ный олеум для получения 100%-ой серной кислоты?
- •5.90. Определите массу меди, выделившейся на катоде, при пропускании электрического тока через раствор хлорида меди (II) в течение 10 мин. Сила тока в цепи 2а.
- •6.338. Какой объем (н. У.) сероводорода необходимо пропустить через раствор хлорида железа (III), чтобы масса хлорида железа (II) оказалась равной 2,54 г?
- •6.339. Через 300 г раствора, содержащего 58,5 г хлорида железа (III), пропустили 3,36 л (н. У.) сероводорода. Определите массовые доли веществ в полученном растворе.
- •6.402. При растворении 2,8 г сплава меди и серебра в концентрированной азотной кислоте образовалось 5,28 г смеси нитратов. Определите массовые доли металлов в смеси.
- •7.317. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
- •7.337. Определите процентное содержание дихромата аммония в технической соли, если при разложении 32 г ее образовалось 20 г твердого остатка (химический состав примесей при этом не изменяется).
- •7.356. При частичном термическом разложении 15,04 г нитрата меди (II) образовалось 8,56 г твердого остатка. Определите степень разложения нитрата меди (II) и состав полученного остатка.
- •7.386. Как получить не менее восьми сложных веществ, имея в своем распоряжении два твердых вещества – силикат кальция и гидрокарбонат натрия? Напишите уравнения реакций, укажите условия.
- •7.393. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
- •7.418. На воздухе прокалили смесь медного порошка и малахита, масса смеси при этом не изменилась. Рассчитайте массовые доли веществ в исходной смеси и конечном продукте.
1.73. Определите массовую долю основного карбоната меди (II) (CuOH)2CO3 в малахите, если на растворение этого вещества из навески малахита массой 8,8 г израсходовано 0,14 моль азотной кислоты. Содержащиеся в малахите примеси с азотной кислотой не реагируют.
(CuOH)2CO3 + 4HNO3 = 2Cu(NO3)2 + CO2 + 3H2O
n((CuOH)2CO3) = (¼)n(HNO3) = 0,035 моль
m((CuOH)2CO3) = 0,035*222 = 7,77 г
ω((CuOH)2CO3) = (7,77/8,8)*100% = 88,3%
Ответ: ω((CuOH)2CO3) = 88,3%
1.79. Смесь из перманганата калия и нитрата натрия массой 6,56 г подвергли полному термическому разложению, в результате чего выделилось 0,672 л кислорода (н. у.). Каково молярное соотношение солей в исходной смеси?
2KMnO4 = K2MnO4 + MnO2 + O2
2NaNO3 = 2NaNO2 + O2
n(O2) = 0,672/22,4 = 0,03 моль
Пусть в смеси было 2x моль перманганата калия и 2y моль нитрата натрия.
Тогда: 2xKMnO4 = xK2MnO4 + xMnO2 + xO2
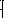 2yNaNO3
= 2yNaNO2
+ yO2
2yNaNO3
= 2yNaNO2
+ yO2
6,56 = 2x*158 + 2y*85
x + y = 0,03
x = 0,03 – y
6,56 = 316(0,03 - y) + 170y
6,56 = 9,48 – 146y
146y = 2,92
y = 0,02
x = 0,01
x : y = 1 : 2
Ответ: 1 KMnO4 : 2 NaNO3
1.87. В 150 г раствора, содержащего смесь соляной и азотной кислот, полностью растворили 24,0 г оксида меди (II). Далее раствор упарили, остаток прокалили. Полученный остаток количественно прореагировал с раствором гидроксида натрия. Образовавшийся раствор вновь упарили и прокалили. Масса остатка составила 35,7 г. Определите массовые доли кислот в исходном растворе.
Растворение:
СuO + 2HCl = CuCl2 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Прокаливание:
Cu(NO3)2 = CuO + 2NO2↑ + (½)O2↑
Реакции в растворе щелочи:
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Прокаливание:
Cu(OH)2 = CuO + H2O↑
Остаток: NaCl, CuO
Пусть в реакцию с соляной кислотой вступило x моль СuO, а в реакцию с азотной – y моль CuO. Тогда:
xСuO + 2xHCl = xCuCl2 + xH2O
yCuO + 2yHNO3 = yCu(NO3)2 + yH2O
yCu(NO3)2 = yCuO + 2yNO2↑ + (½)yO2↑
xCuCl2 + 2xNaOH = xCu(OH)2 + 2xNaCl
xCu(OH)2 = xCuO + xH2O↑
Остаток: (x+y) моль CuO и 2x моль NaCl.
Масса остатка увеличилась на 11,7 г, по сравнению с массой исходного CuO, - это масса NaCl.
n(NaCl) = 11,7/58,5 = 0,2 моль
n(HCl) = n(NaCl) = 0,2 моль
x = 0,1
(x + y)*80 = 24
x + y = 0,3
y = 0,2
n(HNO3) = 2y = 0,4 моль
m(HCl) = 0,2*36,5 = 7,3 г
m(HNO3) = 0,4*63 = 25,2 г
ω(HCl) = (7,3/150)*100% = 4,87%
ω(HNO3) = (25,2/150)*100% = 16,8%
Ответ: ω(HCl) = 4,87%, ω(HNO3) = 16,8%
1.88. При приливании раствора, содержащего 1,02 г соли сероводородной кислоты, к раствору, содержащему 2,7 г хлорида двухвалентного металла, выпало 1,92 г осадка. Какие соли взяты для проведения реакции, если они прореагировали полностью?
Выпал или хлорид, или сульфид металла. Если бы выпадали и сульфид, и хлорид, то масса осадка превышала бы массу каждого из реагентов. Если хлорид некоторого металла нерастворим, то и сульфид тоже, т. к. металлов, сульфиды которых растворимы при нерастворимости их хлоридов, не существет. Это противоречит условию задачи, ведь сливали растворимые в воде вещества. Следовательно, выпал сульфид металла, который входил в состав хлорида.
S2- + XCl2 = XS↓ + 2Cl-
2,7/(M(X) + 71) = 1,92/(M(X) + 32)
(M(X) + 32)*2,7 = (M(X) + 71)*1,92
(2,7 – 1,92)M(X) = 136,32 – 86,4
M(X) = 64 г/моль
X – медь
M(KatS) = 1,02/(2,7/(64 + 71)) = 51 г/моль
M(Kat) = 51 – 32 = 19
Kat = NH4H
Ответ: NH4HS, CuCl2
1.91. На 44,83 г сплава, состоящего из двух металлов, один из которых цинк, подействовали избытком раствора щелочи. При этом выделилось 4,48 л (н. у.) газа. Для окисления нерастворившегося остатка потребовалось 5,6 л кислорода (н. у.). Определите качественный и количественный состав сплава, если известно, что оба металла окислились до степени окисления +2.
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
2X + O2 = 2XO
n(H2) = 4,48/22,4 = 0,2 моль
n(O2) = 5,6/22,4 = 0,25 моль
n(Zn) = n(H2) = 0,2 моль
m(Zn) = 0,2*65 = 13 г
m(X) = 44,83 – 13 = 31,83 г
n(X) = 2n(O2) = 0,5 моль
M(X) = 31,83/0,5 = 63,66 ≈ 64 г/моль
X – медь
Ответ: 13 г Zn, 31,81 г Cu
1.129. Смесь пропана с избытком кислорода объемом 100 мл сожгли. После конденсации водяного пара объем полученных газов, приведенный к первоначальным условиям, равен 55 мл. Определите объемную долю пропана в исходной смеси.
C3H8 + 7O2 = 3CO2 + 4H2O
При одинаковых условиях отношение молей двух газов равно отношению их объемов.
 Пусть
прореагировало x
мл пропана, а y
мл кислорода осталось. Тогда
Пусть
прореагировало x
мл пропана, а y
мл кислорода осталось. Тогда
100 = x + 7x + y
55 = 3x + y
y = 55 – 3x
100 = 8x + 55 - 3x
45 = 5x
x = 9
y = 28
ф(C3H8) = (9/100)*100% = 9%
Ответ: ф(C3H8) = 9%
1.139. При хлорировании 3,36 г порошкообразного железа газовой смесью хлора и хлороводорода получили 9,04 г продуктов реакции. Определите плотность исходной газовой смеси по водороду.
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + H2
Железо поглотило 9,04 – 3,36 = 5,68 г газовой смеси
n(Fe) = 3,36/55,8 = 0,06 моль
n(газовой смеси) = (5/3)*n(Fe) = 0,1 моль
M(газовой смеси) = 5,68/0,1 = 56,8 г/моль
D(газовой смеси, H2) = 58,6/2 = 29,3
Ответ: 29,3
4.55. Какой объем раствора с массовой долей азотной кислоты 53% (ρ
= 1,39 г/мл) потребуется для полного окисления 12,5 г пирита, содержащего 4% примесей? Реакция протекает по схеме:
FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O.
FeS2 + 8HNO3 = Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
m(FeS2) = 0,96*12,5 = 12 г
n(FeS2) = 12/120 = 0,1 моль
n(HNO3) = 8n(HNO3) = 0,8 моль
m(HNO3) = 0,8*63 = 50,4 г
m(HNO3, 53%) = 50,4*100/53 = 95,1 г
V(HNO3, 53%) = 95,1/1,39 = 68,4 мл
Ответ: 68,4 мл
4.73. Определите массу нитрида магния, подвергшегося полному разложению водой, если для солеобразования с продуктами гидролиза потребовалось 150 мл 4%-ой соляной кислоты (ρ 1,018 г/мл).
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
NH3 + HCl = NH4Cl
3Mg(OH)2 + 6HCl = 3MgCl2 + 6H2O
2NH3 + 2HCl = 2NH4Cl
1 молю нитрида соответствует 8 моль HCl.
m(HCl, 4%) = 150*1,018 = 152,7 г
m(HCl) = 152,7*4/100 = 6,108 г
m(Mg3N2) = 6,108*100/(8*36,5) = 2,1 г
Ответ: 2,1 г
4.74. Карбид алюминия обработали 320 г 22%-ой соляной кислоты. При этом выделилось 6,72 л метана (н. У.). Рассчитайте массовые доли веществ в полученном растворе.
Al4C3 + 12HCl = 3CH4 + 4AlCl3
n(CH4) = 6,72/22,4 = 0,3 моль
n(Al4C3) = n(CH4)/3 = 0,1 моль
m(Al4C3) = 0,1*144 = 14,4 г
m(CH4) = 0,3*16 = 4,8 г
m(полученного раствора) = 320 + 14,4 – 4,8 = 329,6 г
n(HCl необх.) = 12n(Al4C3) = 1,2 моль
m(HCl) = 0,22*320 = 70,4 г
n(HCl) = 70,4/36,5 = 1,93 моль
n(HCl ост.) = 1,93 – 1,2 = 0,73 моль
m(HCl ост.) = 0,73*36,5 = 26,6 г
n(AlCl3) = 4n(Al4C3) = 0,4 моль
m(AlCl3) = 0,4*133,5 = 53,4 г
ω(HCl) = (26,6/329,6)*100% = 8,07%
ω(AlCl3) = (53,4/329,6)*100% = 16,2%
Ответ: ω(HCl) = 8,07%, ω(AlCl3) = 16,2%
4.96. Упарили 2 л 12%-ого раствора хромата калия (ρ = 1,1 г/мл) до объема 1 л. Рассчитайте молярную концентрацию соли в конечном растворе.
m(исх. р-ра) = 2000*1,1 = 2200 г
m(соли) = 2200*0,12 = 264 г
n(соли) = 264/194 = 1,36 моль
c = 1,36 моль/л
Ответ: 1,36 моль/л
4.108. Определите массу натрия, который надо внеси в 5%-ный раствор гидроксида натрия массой 120 г, чтобы массовая доля щелочи повысилась до 25%.
Na + H2O = NaOH + (½)H2
m(NaOH нач) = 120*0,05 = 6 г
M(NaOH)/M(Na) = 40/23 – во столько раз больше образуется массы NaOH по сравнению с массой Na.
M(H)/M(Na) = 1/23
(1/23)x г водорода улетит
0,25 = (6 + (40/23)x)/(120 + x – (1/23)x)
30 + 0,25*(22/23)x = 6 + 40/23x
690 + 5,5x = 138 + 40x
34,5x = 552
x = 16
Ответ: 16 г
4.109. В каких массовых соотношениях надо взять 78%-ный раствор серной кислоты и 10%-ный олеум для получения 100%-ой серной кислоты?
Пусть масса раствора серной кислоты будет 100 г. Тогда масса воды – 22 г.
n(H2O) = 22/18 =11/9 моль
H2O + SO3 = H2SO4
n(SO3) = n(H2O) = 11/9 моль
m(SO3) = (11/9)*80 = 880/9 г
m(олеума) = (880/9)*10 = 8800/9
m(раствора серной кислоты)/m(олеума) = 900/8800 = 9/88
Ответ: 9 : 88
4.117. Какой объем 96%-ого раствора серной кислоты (ρ = 1,84 г/мл) необходимо взять для приготовления 100 мл 15%-ного раствора серной кислоты (ρ = 1,10 г/мл)?
m(2 р-ра) = 100*1,10 = 110 г
m(H2SO4) = 110*0,15 = 16,5 г
m(1 р-ра) = 16,5*100/96 =17,2 г
V(1 р-ра) =17,2/1,84 = 9,34 мл
Ответ: 9,34 мл
5.39. Окисление сероводорода водным раствором дихромата калия в кислотной среде протекает по схеме: K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + S + K2SO4 + H2O. Определите объем сероводорода (н. у.), который прореагирует с 250 мл 0,25 М раствора дихромата калия, и массу образовавшейся серы.
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O
n(K2Cr2O7) = 0,25*0,25 = 0,0625 моль
n(S) = 3n(K2Cr2O7) = 0,1875 моль
m(S) = 0,1875*32 = 6 г
n(H2S) = n(S) = 0,1875 моль
V(H2S) = 0,1875*22,4 = 4,2 л
Ответ: 4,2 л H2S, 6 г S
5.59. В раствор сульфата меди (II) массой 248 г поместили порошок магния массой 20 г. Через некоторое время металлический осадок собрали и высушили. Его масса составила 28 г. Определите массовую долю сульфата магния в полученном растворе.
Mg + CuSO4 = MgSO4 + Cu
m(полученного раствора) = 248 + 20 – 28 = 240 г
n(Mg) = 20/24 = 5/8 моль.
Предположим, Mg в недостатке, и он весь перешел в раствор. Тогда:
n(Cu) = 28/64 = 7/16 моль ≠ n(Mg). Следовательно, в раствор перешла только часть магния.
x = n(Mg прореаг.)
8 = 64x – 24x = 40x
x = 0,2
n(Mg прореаг.) = 0,2 моль
n(MgSO4) = n(Mg прореаг.) = 0,2 моль
m(MgSO4) = 0,2*120 = 24 г
ω(MgSO4) = (24/240)*100% = 10%
Ответ: 10%
5.78. Электролизу подвергли 350 мл раствора с массовой долей гидроксида натрия 9% (ρ = 1,098 г/мл). В результате на аноде выделилось 28 л газа (н. у.). Вычислите массовую долю вещества, находящегося в растворе после электролиза.
NaOH ↔ Na+ + OH-
K(-): 2H2O + 2e- = H2↑ + 2OH-
A(+): 2H2O – 4e- = O2↑ + 4H+
Итого: 2H2O = 2H2↑ + O2↑
n(O2) = 28/22,4 = 1,25 моль
n(H2) = 2n(O2) = 2,5 моль
m(O2) = 1,25*32 = 40 г
m(H2) = 2,5*2 = 5 г
m(р-ра до) = 350*1,098 = 384,3 г
m(р-ра после) = 384,3 – 40 – 5 = 339,3 г
m(NaOH) = 0,09*350 = 31,5 г
ω(NaOH) = (31,5/339,3)*100% = 9,28%
Ответ: 9,28%
5.81. Газы, полученные в результате электролиза раствора соли калия, прореагировали на свету. Образовавшийся продукт реакции растворили в воде. К полученному раствору добавили раствор нитрата серебра, при этом образовалось 5,73 г осадка. Определите, какую соль подвергли электролизу. Вычислите ее массу и объем газа (н. у.), который растворили в воде.
Судя по образованию осадка при взаимодействии с нитратом серебра и тому, что при электролизе соли калия на катоде образуется водород, продукт электролиза –галогеноводород, а соль – какой-то галогенид калия. Вероятнее всего – хлорид. Реакция между хлором и водородом на свету также хорошо известна.
K(-): 2H2O + 2e- = H2↑ + 2OH-
A(+): 2Cl- – 2e- = Cl2↑
H2 + Сl2 = 2HCl
Ag+ + HCl = AgCl↓ + H+
n(AgCl) = 5,73/143,5 = 0,0399 моль
n(KCl) = n(AgCl) = 0,0399 моль
m(KCl) = 0,0399*74,5 = 2,97 г
n(HCl) = n(AgCl) = 0,0399 моль
V(HCl) = 0,0399*22,4 = 0,894 л = 894 мл
Ответ, 2,97 г KCl, 894 мл HCl
