
Кудышкина экзамен / металлы с р-рами солей
.docx3)Взаимодействие
металлов с растворами солей(3
примера)
Причины
разрушения металлов (окисления, химической
коррозии) в растворах солей могут быть
различными в зависимости от состава
конкретной системы, с которой контактирует
металл. Чаще всего встречаются следующие
2 случая:
I.
Me+р-вор
соли менее активного Ме
Пример:
1.
Fe+CuCl2+(H2O)→Cu↓+FeCl2+(H2O)
Fe-
восстановитель
Cu
– окислитель
ΔEᵒ=+0,34-(-0,44)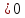 более
активный Ме вытесняет менее активный
из раствора соли
2. Mg+NiCl2+(H2O)→
Mg-
восстановитель
Ni–
окислитель
ΔEᵒ=-0,25-(-2,37)
более
активный Ме вытесняет менее активный
из раствора соли
2. Mg+NiCl2+(H2O)→
Mg-
восстановитель
Ni–
окислитель
ΔEᵒ=-0,25-(-2,37)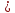 0
Вывод: любой
металл в ряду стандартных электродных
потенциалов обладает способностью
вытеснять все нижестоящие за ним металлы
из растворов их солей.
Активные
металлы вытесняют из солей менее активные
(металлы расположены в порядке убывания
активности в ряду напряжений):
0
Вывод: любой
металл в ряду стандартных электродных
потенциалов обладает способностью
вытеснять все нижестоящие за ним металлы
из растворов их солей.
Активные
металлы вытесняют из солей менее активные
(металлы расположены в порядке убывания
активности в ряду напряжений):
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Однако
это не означает, что вытеснение
обязательно происходит во всех
случаях. Например, алюминий вытесняет
медь из раствора хлорида меди (II) СuСl2,
но практически не вытесняет ее из
раствора сульфата меди (II) CuS04.
Это объясняется тем, что хлорид-ион
Сl- быстро
разрушает защитную поверхностную пленку
на алюминии, а сульфат-ион SO42-практически
не разрушает ее.
II.
Ме+р-вор соли более активного
Ме
1.Fe+Mg(NO3)2+H2O
(сильная кислота + слабое
основание)
ΔE=-2,37-(-0,44)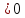 (сампороизвольно)
Однако,
нитрат магния подвергается гидролизу
(в состав соли входит катион слабого
основания и сильной кислоты), и реакции
среды будет кислая. Запишем уравнение
гидролиза той ступени, которая практически
идет:
1 ступень. Mg(NO3)2+HOH
(сампороизвольно)
Однако,
нитрат магния подвергается гидролизу
(в состав соли входит катион слабого
основания и сильной кислоты), и реакции
среды будет кислая. Запишем уравнение
гидролиза той ступени, которая практически
идет:
1 ступень. Mg(NO3)2+HOH MgOHNO3+HNO3р
І
×4
(Образующаяся
кислота взаимодействует с железом)
+
Fe+4HNO3р=Fe(NO3)3+2H2O+NO↑
______________________________________
Fe+4Mg(NO3)2+2H2O=Fe(NO3)3+4MgOHNO3+NO↑
В
данном растворе железо окисляется
разбавленной азотной кислотой,
образующейся при гидролизе нитрата
магния.
MgOHNO3+HNO3р
І
×4
(Образующаяся
кислота взаимодействует с железом)
+
Fe+4HNO3р=Fe(NO3)3+2H2O+NO↑
______________________________________
Fe+4Mg(NO3)2+2H2O=Fe(NO3)3+4MgOHNO3+NO↑
В
данном растворе железо окисляется
разбавленной азотной кислотой,
образующейся при гидролизе нитрата
магния.
2. Al+AlCl3+H2O (сильная кислота + слабое основание) 1 ступень. AlCl3+HOH⇄AlOHCl2+HCl І ×6 + 2Al+6HCl=2AlCl3+3H2↑ _____________________________________________ 2Al+6AlCl3+6H2O = 2AlCl3+6AlOHCl2+3H2↑ 3. Al/Al2O3+Na2CO3(Na2SO3,Na2S)+H2O (cильное основание +с лабая кислота) 1 ступень. Na2CO3+HOH⇄NaHCO3(NaHS,NaHSO3)+NaOH
2 ступень. Растворение оксидной пленки амфотерного характера Al2O3+2NaOH+3H2O⇄2Na[Al(OH)4] 3 cтупень. Растворение гидроксидной пленки. 2Al+6H2O=2Al(OH)3↓+3H2↑ + Al(OH)3+NaOH=Na[Al(OH)4] І×2 _________________________ 4 ступень. 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ + Na2CO3+H2O⇄NaHCO3+NaOH І×2 __________________________________ 2Al+2Na2CO3+8H2O=2Na[Al(OH)4]+2NaHCO3+3H2↑ Вывод: Разрушение Ме в растворе более активного Ме происходит за счет продуктов гидролиза соли (кислоты или щелочи)
