
Кудышкина экзамен / Химия теория
.pdfВопрос №1. Основные законы химии: сохранения массы и энергии, постоянство состава, эквивалентов и Авогадро.
Закон сохранения массы:
Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. Закон открыт Ломоносовым в 1848 г. Изначальная формулировка: Все встречающиеся в природе изменения происходят так: сколько к одному материи прибавилось, столько же и отнимется от другого. Благодаря тому закону химия перешла от науки качественной к науке количественной.
Из уравнения Эйнштейна для соотношения массы и энергии следует, что в любом процессе, сопровождающимся изменением энергии, будет происходить соответствующее изменение массы. Однако из-за большого значения с (3*108 м/с) тем энергиям, которые выделяются или поглощаются при химических реакциях, отвечают очень маленькие массы, лежащие вне пределов возможности измерений.
Закон сохранения энергии:
При любых взаимодействиях, имеющих место в изолированной системе, энергия той системы остается постоянной и возможны лишь переходы одного вида энергии в другой.
Практически это означает, что, если в ходе реакции энергия выделяется или поглощается, то запас энергии в продуктах реакции по сравнению с запасом ее в исходных веществах будет меньше или больше, соответственно. Запас энергии вещества принято называть теплосодержанием, а выделяющуюся или поглощающуюся энергию – теплом. Благодаря этому закону существует наука химическая термодинамика, изучающая вместе с другими явлениями тепловые эффекты химических реакций.
Закон постоянства состава:
Всякое химически индивидуальное вещество имеет один и тот же количественный состав независимо от способа его получения. Открыт Прустом в начале 19 века. Это означает, что соотношения между массами элементов, входящих в состав соединения, постоянны.
С+О2=СО2 |
СаСО 3=СаО+СО2 |
Н 2СО3=СО2+Н2О |
Закон всегда выполняется для газообразных и жидких веществ. Для веществ, находящихся в твердом состоянии, строго говоря, закон не справедлив. Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения. Это связано с тем, что в кристаллической структуре любого твердого вещества всегда имеются пустоты, примесные атомы других элементов и другие отклонения от идеальной структуры. На все это влияет температура, давление, технологии получения, выделения и очистки вещества. TiO1,9-2,0 Такая формула отражает границы состава вещества. Область гомогенности – интервал изменения состава вещества без изменения его свойств (GaP – узкая область гомогенности).
Закон кратных отношений:
Если 2 элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа (Дальтон, начало 19 в). Например, СО и СО2. Этот закон, как и закон постоянства состава, не является всеобщим и, строго
говоря, также не справедлив для веществ в твердом состоянии. Например, TiO1,46-1,56 и
TiO1,9-2,0.
Закон объемных отношений:
При одинаковых условиях объемы вступающих в реакцию газов, относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа (Гей-Люссак, начало 19 в). Например, при взаимодействии 2 объемов водорода и 1 объема кислорода образуется 2 объема водяного пара. Эти числа совпадают со стехиометрическими коэффициентами в уравнении реакции. На этом законе основаны методы газового анализа, применяемого в промышленности.
Закон Авогадро:
В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул. Закон позволил сделать выводы о числе атомов в молекулах газов (водород, хлор, кислород, азот).
Следствия: 1. Молекулы всех простых газов двухатомны, кроме 8а группы. 2. 1 моль (н.у.) – 22.4 л. 3. Nа=6,02*1023 частиц. 4. Можно определить молекулярные массы неизвестных газов.
Закон эквивалентов:
Химическим эквивалентом элемента называется количество элемента, взаимодействующее с 1 массовой частью молекулы водорода или 1/8 частью молекулы кислорода.
Все вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Массы реагирующих друг с другом веществ пропорциональны их молярным массам эквивалентов. Молярной массой эквивалентов вещества называется отношение массы вещества к его количеству вещества эквивалентов.
Вопрос №2. Закон постоянства состава с современной точки зрения. Соединения постоянного и переменного состава.
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые - бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Вопрос №3. Закон эквивалентов. Эквивалент элементов и соединений.
Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях. Поэтому в химии введено понятие эквивалента. Эквивалент – условные частицы вещества в целое число раз меньшие, чем соответствующие им формульные единицы. В формульной единице содержится n эквивалентов вещества (n – число эквивалентности). Эквивалентное число зависит от природы реагирующих веществ, типа и степени осуществления химической реакции. Поэтому различают эквивалентные числа элемента в составе соединения, отдельных групп, ионов и молекул. В обменных реакциях эквивалентное число определяют по стехиометрии реакции. В общем случае для обменной реакции xaA+xbB=xcC+xdD эквивалентное число рассчитывается по стехиометрии реакции na=xb/xa.
В окислительно-восстановительных реакциях значения эквивалентного числа окислителя и восстановителя определяют по числу электронов, которые принимает 1 ФЕ окислителя или отдает 1 ФЕ восстановителя.
Если известно количество вещества, то количество вещества эквивалентов всегда в число эквивалентности раз больше (или равно) количества вещества. В практических расчетах наиболее часто пользуются молярной массой эквивалентов.
Вопрос №4. Классы неорганических соединений.
Все вещества делятся на простые и сложные. Простые состоят из атомов одного элемента, в состав сложных входят атомы двух или более элементов.
Простые вещества разделяются на металлы и неметаллы.
Металлы – элементы, атомы которых имеют сравнительно мало электронов на внешней электронной оболочке (главным образом 1,2,3) и обладают низкой электроотрицательностью (меньше 2). Металлы обладают высокой тепло- и электропроводностью, металлическим блеском, под давлением становятся текучими, что определяет их гибкость и ковкость. Главным признаком металлов как химических веществ является их способность отдавать электроны атомам и ионам других веществ, т.е. выступать восстановителями. Главное влияние на физические свойства металлов оказывает электронное строение атомов металла и строение кристаллической решетки металла.
Неметаллы – элементы, внешний электронный уровень атомов которых близок к завершению. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов. У некоторых неметаллов наблюдается проявление аллотропии (существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам). Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм.
Оксиды – бинарные соединения химических элементов с кислородом в степени окисления -2, в котором сам кислород связан только с менее электроотрицательным элементом. По функциональным признакам оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие, в свою очередь, подразделяются на кислотные, основные и амфотерные. Основными называются оксиды, взаимодействующие с кислотами (или кислотными оксидами) с образованием солей. Присоединяя воду (непосредственно или косвенно), основные оксиды образуют основания. Кислотными называются оксиды, взаимодействующие с основаниями (или с основными оксидами) с образованием солей. Присоединяя (непосредственно или косвенно) воду, кислотные оксиды образуют кислоты. Амфотерными называются оксиды, образующие соли при взаимодействии как с кислотами, так и с основаниями. Несолеобразующие оксиды не способны взаимодействовать с кислотами или основаниями с образованием солей (N2O, CO).
Гидроксиды – вещества, содержащие гидроксогруппы ОН. основные гидроксиды (основания) — только гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства (Ca(ОН)2, KOH, NaOH и др.) При реакциях и диссоциации отщепляется группа -OH. Растворимые основные гидроксиды называются щелочами. Кислотные гидроксиды (кислородсодержащие кислоты) — гидроксиды неметаллов и металлов со степенью окисления +5, +6, проявляющие кислотные свойства (HNO3, H2SO4) При реакциях и диссоциации отщепляется протон. Амфотерные гидроксиды, гидроксиды металлов со степенью окисления +3, +4 и нескольких металлов со степенью окисления +2, которые проявляют амфотерные свойства. Амфотерные гидроксиды проявляют в зависимости от условий либо основные, либо кислотные свойства (Al(ОН)3, Zn(ОН)2).
К важнейшим классам неорганических соединений, выделяемых по функциональным признакам, относятся кислоты, основания и соли.
Кислотами с позиции теории электролитической диссоциации называются вещества, диссоциирующие в растворах с образованием ионов водорода. С точки зрения протонной теории кислот и оснований к кислотам относятся вещества, способные быть донорами протонов. Наиболее характерное химическое свойство кислот – их способность реагировать с основаниями с образованием солей. Кислоты классифицируют по силе, основности и наличию или отсутствию кислорода в составе кислоты.
Основаниями с позиции теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т.е. основные гидроксиды. Наиболее характерное химическое свойство оснований – их способность реагировать с кислотами с образованием солей. С позиции протонной теории кислот и оснований к основаниям относятся вещества, способные присоединять ионы водорода, т.е. быть акцепторами протонов. В зависимости от числа протонов, которые может присоединить основание, различают однокислотные, дикислотные основания и т.д. По силе основания делятся на сильные и слабые; к сильным относятся все щелочи.
К солям относятся вещества, диссоциирующие в растворах с образованием положительно заряженных ионов, отличных от ионов водорода, и отрицательно заряженных ионов, отличных от гидроксид-ионов. Соли можно рассматривать как продукты замещения атомов водорода в кислоте атомами металлов (или NH4) или как продукты замещения гидроксогрупп в основном гидроксиде кислотными остатками. При полном замещении получаются средние (нормальные) соли. При неполном замещении водорода – кислые соли, гиодроксо-групп – основные соли.
Вопрос №5. Модель строения атома Резерфорда.
Одна из первых моделей строения атома была предложена Томсоном в 1903 г. Атом представлялся положительно заряженной сферой с вкраплениями электронов, суммарный отрицательный заряд электронов приравнивался к заряду сферы.
Для проверки гипотезы Томсона и более точного определения строения атома Резерфорд провел серию опытов по рассеиванию альфа-частиц тонкими металлическими пластинками. Источник альфа-излучения помещали в свинцовый кубик с просверленным в нем каналом, так что удавалось получить поток альфа-частиц, летящих в определенном направлении. Попадая на экран, покрытый сульфидом цинка, альфа-частицы вызывали его свечение, причем в лупу можно было увидеть и подсчитать отдельные вспышки, возникающие на экране при попадании на него альфа-частицы. Между источником излучения и экраном помещали фольгу. По вспышкам на экране можно было судить о рассеянии альфа-частиц, т.е. об их отклонении от первоначального направления при прохождении через слой металла.
Оказалось, что большинство альфа-частиц проходит через фольгу, не изменяя своего направления, хотя толщина фольги соответствовала сотням тысяч атомных диаметров. Но некоторая доля альфа-частиц все же отклонялась на небольшие углы, а изредка альфачастицы резко изменяли направление своего движения и даже отбрасывались назад, как бы натолкнувшись на массивное препятствие. Случаи такого резкого отклонения альфачастиц можно было наблюдать, перемещая экран с лупой по дуге.
Из результатов опыта следовало, что подавляющая часть пространства, занимаемого атомом металла, не содержит тяжелых частиц – там могут размещаться только электроны. Ведь масса электрона много меньше массы альфа-частицы, так что столкновение с электроном практически не может повлиять на направление движения альфа-частицы. Случаи же резкого отклонения и даже отбрасывания альфа-частиц означают, что в атоме есть какое-то тяжелое ядро, в котором сосредоточена преобладающая часть всей массы атома. Это ядро занимает очень маленький объем (поэтому частицы так редко с ним сталкиваются) и обладает положительным зарядом, который и вызывает отталкивание одноименно заряженных альфа-частиц.
Результаты опыта Резерфорд объяснил, предложив «планетарную» модель атома, уподоблявшую его солнечной системе. Согласно этой модели в центре атома находится очень маленькое ядро, заключающее в себе почти всю массу атома и несущее положительных заряд. Вокруг ядра движутся электроны, число которых определяется зарядом ядра.
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Это противоречит реальным свойствам атомов, которые представляют собой устойчивые образования. Бор берет за основу «планетарную» модель атома, формулируя постулаты:
1.Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам. Эти орбиты получили название стационарных. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка mvr=nh/2π. Двигаясь по стационарной орбите электрон не излучает и не поглощает энергию.
2.Излучение или поглощение энергии происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.
Вопрос №6. Теория строения атома Бора. Недостатки теории Бора.
В своей теории Бор исходил из планетарной модели атома. Основываясь на положении квантовой теории света о прерывистой, дискретной природе излучения и на линейчатом характере атомных спектров, он сделал вывод, что энергия электронов в атоме не может меняться непрерывно, а изменяется скачками, т.е. дискретно. Поэтому в атоме возможны не любые энергетические состояния электронов, а лишь определенные. Иначе говоря, энергетические состояния электронов в атоме квантованы. Переход из одного разрешенного состояния в другое осуществляется скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения. Основные положения своей теории Бор сформулировал в виде постулатов (утверждение, принимаемое без доказательства)
1.Электрон может вращаться вокруг ядра только по определенным (стационарным) круговым орбитам. Двигаясь по стационарной орбите, электрон не излучает и не поглощает энергию.
2.Излучение или поглощение энергии происходит при переходе электрона с одной стационарной орбиты на другую.
Стационарными являются те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка: mvr=nh/2π.
Постулаты Бора находились в резком противоречии с положениями классической физики. С точки зрения классической механики электрон может вращаться по любым орбитам, а классическая электродинамика не допускает движения заряженной частицы по круговой орбите без излучения. Но эти постулаты нашли свое оправдание в результатах, полученных Бором при расчете спектра атома водорода. Теория Бора объяснила физическую природу атомных спектров как результата перехода атомных электронов с одних стационарных орбит на другие.
Переход электрона на уровень с большей энергией возможен, если энергия поглотится атомом. Частота излучения связана с энергией, поглощенной или излученной при электронном переходе. Таким образом, модель строения атома по Бору успешно объяснила появление линейчатого спектра и наличие серий в видимой части спектра испускания атомов водорода. При этом оказалось, что эти линии соответствуют переходу электрона с более удаленных орбит на вторую от ядра орбиту. Бор не ограничился объявлением уже известных свойств спектра водорода, но на основе своей теории предсказал существование и местоположение неизвестных в то время спектральных серий водорода, находящихся в ультрафиолетовом и инфракрасной областях спектра и связанных с переходом электрона на ближайшую к ядру орбиту и орбиты, более удаленные от ядра, чем вторая. Все это было впоследствии экспериментально подтверждено.
Оставался ряд невыясненных вопросов, связанных с постулатами Бора. Где находится электрон в процессе перехода с одной орбиты на другую? Как вытекает из теории относительности, ни один физический процесс не может распространяться со скоростью, превышающей скорость света. Поэтому переход на новую орбиту не
совершается мгновенно, а длится некоторое время. В течение этого времени электрон должен находиться где-то в промежутке между исходной и конечной орбитой, но такие промежуточные состояния запрещаются теорией.
Также теория не смогла объяснить некоторых важных спектральных характеристик многоэлектронных атомов и даже атома водорода. Например, оставалась неясной причина различной интенсивности линий в атомном спектре водорода; не объяснялась тонкая структура спектров атомов, заключающаяся в том, что их отдельные линии расщепляются на несколько других. Сами количественные расчеты многоэлектронных атомов оказались чрезвычайно сложными и практически неосуществимыми. Теория ошибочно описывала магнитные свойства атома водорода, принципиально не могла объяснить образование химической связи в молекулах.
Вопрос №7. Принцип квантовой механики: дискретность энергии, корпускулярноволновой дуализм, принципы неопределенности Гейзенберга.
В начале 20 в было установлено, что представление об электроне, как о частице, подчиняющейся законам классической механики было ошибочным. Изучение природы и распространения света показало, что он обладает как корпускулярными, так и волновыми свойствами. На первые указывает явление фотоэффекта, на вторые – явления интерференции и дифракции. Корпускулярные свойства фотона выражаются уравнением Планка E=hν, согласно которому фотон неделим и существует в виде дискретного образования. Волновые же свойства фотона находят выражение в уравнении λν=с, связывающим длину волны электромагнитного колебания с его частотой и скоростью распространения. Но фотон с энергией обладает массой в соответствии с уравнением Эйнштейна. Λ=h/mc, λ=h/p. Позже Луи де Бройлем было распространена идея о двойственности природы света на вещество. Движение частиц было сопоставлено с распространением волны. Позже появились подтверждающие экспериментальные данные, что пучки электронов и нейтронов могут давать интерференционные и дифракционные эффекты при пропускании их через кристаллическую решетку некоторых соединений. Таким образом, электрон в атоме и молекуле обладает как свойством частицы, так и волновыми свойствами.
В 1900 г М. Планк, изучавший тепловое излучение твердых тел, пришел к выводу, что электромагнитное излучение испускается в виде отдельных порций – квантов – энергии. Значение одного кванта энергии равно E=hν. Кванты энергии впоследствии назвали фотонами. Идея о квантовании энергии позволила объяснить происхождение линейчатых атомных спектров, состоящих из набора линий, объединенных в серии. Бальмер установил, что длины волн, соответствующие определенным линиям в спектре атомов водорода, можно выразить как ряд целых чисел. Предложенное им уравнение, позднее модифицированное Ридбергом: ν=R(1/n12-1/n22).
Гейзенберг сформулировал принцип неопределенности, заключающийся в принципиальной невозможности одновременно точно определить положение микрочастицы в пространстве и ее импульс: p* x=h/4π. Таким образом, чем точнее определена скорость, тем меньше известно о местоположении частицы, и наоборот. Поэтому для микрочастицы становится неприемлемым понятие траектории движения. Можно лишь говорить о вероятности обнаружить ее в какой-то области пространства.
E* t=h/4π.
Вопрос №8. Уравнение Шредингера. Основные идеи, положения в его основе. Смысл волновой функции.
(Принцип неопределенности Гейзенберга)
Функция ψ – функция, описывающая состояние электрона в атоме или молекуле, часто называется волновой функцией или орбиталью. Ψ2dV – вероятность обнаружения электрона в некотором объеме dV. Ψ2 выражает плотность вероятности нахождения электрона в соответствующей области пространства. Область пространства, где наиболее вероятно нахождение электрона, определяет форму электронного облака.
d2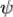 /dx2+ d2
/dx2+ d2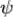 /dy2+ d2
/dy2+ d2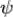 /dz2+8π2m/h2(E-U)=0
/dz2+8π2m/h2(E-U)=0
Точное решение уравнения есть только для водорода. Из решения возникают квантовые числа n,m,l.
Вопрос №9. Квантовые числа. Их значения и сущность.
Квантовые числа – это энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квантовое число (n): характеризует энергию электрона в атоме (энергию уровня E=-13,6/n2), размер атома (электронного облака) r=0,053*n2. В периодической системе число соответствует номеру периода. Принимает значения 1,2,3…
Орбитальное (побочное) квантовое число (l): l=0,1,2,3…(n-1)
n=1: l=0; n=2: l=0,1; n=3: l=0,1,2.
Характеризует подуровень. Характеризует момент количества движения электрона (момент импульса) и определяет форму электронного облака.
l=0 – s (сфера); l=1 – p (гантель); l=2 – d; l=3 – f; l=4 – g; l=5 – h.
Магнитное квантовое число (m или ml) m= -l…-1,0,1…l.
n=1 l=0 m=0; n=2 l=0,1 m=-1,0,1; n=3 l=0,1,2 m=-2,-1,0,1,2
Определяет возможные ориентации электронного облака в пространстве. Характеризует проекцию момента количества движения.
Волновая функция, описывающая состояние электрона в атоме, и полностью характеризуемая конкретными значениями квантовых чисел (n,l,m), называется (пространственной) атомной орбиталью.
Спиновое квантовое число (ms): отражает наличие у электрона собственного момента движения. Проекция собственного момента движения на избранное направление называется спином. Принимает значения ±1/2. При записи формул и составлении энергетических диаграмм, отражающих состояние электронов в атомах и молекулах,
наличие того или иного значения спинового квантового числа указывают стрелкой ↑ или ↓.
Вопрос №10. Понятие электронного уровня, подуровня, орбитали.
Атомная орбиталь – волновая функция, описывающая состояние электрона в атоме, и полностью характеризуемая конкретными значениями квантовых чисел (n,l,m). Каждая орбиталь характеризуется определенной зависимостью распределения ψ- функции в пространстве. Обладает определенной симметрией.
Энергетический уровень – совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Число энергетических уровней атома равно номеру периода, в котором расположен соответствующий химический элемент.
Энергетический подуровень – совокупность орбиталей, имеющих одинаковое значение главного и орбитального квантовых чисел (но отличающихся направлением в пространстве), находящихся на одинаковом уровне и имеющие одинаковую форму.
Вопрос №11. Правила и принципы, определяющие последовательность формирования электронных уровня и подуровня.
Принцип наименьшей энергии: в первую очередь заполняются уровни с наименьшей энергией.
Принцип запрета (принцип Паули): в атоме не могут находиться 2 электрона с одинаковым набором квантовых чисел. Так как одной атомной орбитали соответствует фиксированное значение 3 квантовых чисел (n,l,m), то на ней может располагаться только 2 электрона с противоположными спинами (такие электроны называются спаренными).
Правило Клечковского: в первую очередь формируются подуровни с наименьшей энергией, т.е. имеющие наименьшую сумму n+l. Если они равны, то там, где меньше значение n.
Правило Хунда: в наиболее устойчивом состоянии атома электроны размещаются в пределах орбитали подуровня так, чтобы их суммарный спин был максимален. Правило не запрещает другого распределения электронов в пределах подуровня. Состояние атома с меньшим суммарным спином будет энергетически менее выгодно и будет относиться к возбужденному состоянию.
Вопрос №12. s-, p-, d-, f- элементы. Взаимосвязи между электронным строением, химическими свойствами и положениями в Периодической системе.
Первоначально в таблице периодической системы Менделеева элементы были расположены на основании их атомных масс и химических свойств. В действительности оказалось, что решающий фактор при этом – не атомная масса, а заряд ядра и, соответственно, число электронов в нейтральном атоме.
s-, p-, d-, f- элементами называются элементы у которых формируются соответствующие подуровни. В периодической системе они объединены в группы.
Последовательное заполнение электронами уровней показывает, что элементы одних и тех же подгрупп ПС имеют близкие электронные конфигурации внешних электронных уровней.
Вопрос №13. Периодический закон Д.И. Менделеева. Периодичность в изменении различных свойств элементов (потенциал ионизации, сродство к электрону, атомные радиусы и т.д.).
Первоначальная формулировка: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Правило Менделеева: характеристика элемента – это среднее арифметическое соседних элементов.
В современной формулировке атомная масса заменена на заряд ядра, соответствующий порядковому номеру элемента.
Периодически повторяется структура внешнего электронного уровня, определяющего свойства элементов.
Энергия ионизации – наименьшая энергия, необходимая для удаления электрона на бесконечность. Численное значение – потенциал ионизации. Потенциалы определены почти для всех атомов и всех электронов (экспериментально).
На энергию ионизации влияют: эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях; радиально расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с атомом электрона; мера проникающей способности этого электрона и межэлектронное отталкивание среди наружных электронов.
Сродство к электрону – энергия, выделяющаяся или поглощающаяся при присоединении электрона к нейтральному атому. Определяет окислительную способность частицы. Молекулы с высокими значениями сродства к электрону – сильные окислители.
Электроотрицательность – способность атома притягивать общую электронную пару.
Электроотрицательность уменьшается справа налево и сверху вниз. Самый электроотрицательный элемент – F(4,0).
Справа налево и сверху вниз увеличиваются металлические и восстановительные свойства.
Атомные радиусы при перемещении слева направо уменьшаются, т.к. электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. При перемещении сверху вниз атомные радиусы элементов растут, потому что заполнено больше электронных уровней.
Вопрос №14. Сходство и различие химических свойств элементов главных и побочных подгрупп в связи с электронным строением атома.
В главные подгруппы входят s- и p- элементы, в побочные d- элементы (переходные элементы).
У атомов элементов главных подгрупп на внешнем электронном уровне находится число электронов, численно совпадающее с номером группы. У атомов элементов побочных подгрупп на внешней оболочке находятся 1-2 электрона, а атом Pd – не имеет электронов на внешнем электронном уровне.
