
- •1. Энергетика химических реакций. Что изучает химическая термодинамика?
- •2. Перечислите, какие вы знаете системы. Как называются реакции по тепловым эффектам?
- •3. Дайте понятия процессам: изобарный, изохорный, изотермический.
- •4. Что такое энтальпия образования?
- •5. Что такое термохимическое уравнение? Некоторые особенности термохимических уравнений
- •6. Закон Гесса, следствие из закона Гесса. Постулат Лавуазье Лапласса. Формулировка закона
- •8. Как для реакций, в которых участвуют газообразные вещества, без таблиц можно определить изменение энтропии?
- •11. Химическое равновесие и константа равновесия. От каких факторов зависит константа равновесия? Уравнение, связывающее термодинамические параметры и константу равновесия?
- •12. Принцип Ле-Шателье. Куда сместится равновесие при повышении и понижении давления, температуры и концентрации? При введении катализатора?
- •13. Дать понятие скорости химических реакций. Какие простые реакции Вы знаете? Привести примеры. Мономолекулярные, бимолекулярные и тримолекулярные реакции. Привести примеры.
- •14. Какие сложные реакции Вы знаете? Привести примеры последовательных, параллельных и цепных реакций. Чем отличаются сложные реакции от простых.
- •15. Гомогенные и гетерогенные реакции. Какие вещества не входят в кинетическое уравнение?
- •16. Закон действующих масс, формулировка. Написать любую реакцию и ее кинетическое уравнение.
- •21. Что такое катализ? Что такое гомогенный и гетерогенный катализ? Привести пример расчета во сколько раз увеличится скорость реакции с катализатором и без катализатора?
- •22. Какие электрохимические процессы Вы знаете?
- •24. Рассмотреть работу гальванического элемента на примере элемента Даниэля Якоби. Принцип составления схемы гальванического элемента. Как рассчитывается эдс гальванического элемента.
- •25. Концентрационный гальванический элемент, принцип работы и расчет эдс. Привести пример.
- •26. Что такое электролиз? Какие бывают электроды? Электролиз расплава. Привести пример.
- •27. Электролиз растворов. Привести все случаи в зависимости от активности металлов.
- •28. Анодное окисление. Привести примеры. Электролиз с растворимым анодом. Закон Фарадея. Выход по току. Напряжение разложения. Перенапряжение.
- •29. Коррозия. Химическая и электрохимическая. Привести пример электрохимической коррозии. Что такое протекторная защита?
- •30. Растворы. Коэффициент растворимости. Способы выражения концентрации растворов.
- •31. Свойства растворов не электролитов. От чего зависят коллигативные свойства? Первый закон Рауля. Второй закон Рауля. Явление осмоса. Осмотическое давление.
- •32. Свойства растворов электролитов, характеристики растворов электролитов: степень электролитической диссоциации. Константа диссоциации. Закон разбавления Оствальда.
- •33. Понятие изотонического коэффициента и формулы расчета коллигативных свойств для электролитов. Связь степени электролитической диссоциация и изотонического коэффициента.
- •34. Ионно-обменные реакции, полные и сокращенные. Направление протекания ионно-обменных реакций.
- •2 Примеры записи реакций ионного обмена
- •35. Электролитическая диссоциация воды, водородный показатель (рН). Расчет водородного показателя.
- •36. Гидролиз. Понятие и типы гидролиза. Степень гидролиза. Факторы, влияющие на степень гидролиза. Константа гидролиза.
- •37. Что такое произведение растворимости? Показать на примере.
1. Энергетика химических реакций. Что изучает химическая термодинамика?
Химические реакции сопровождаются выделением или поглощением энергии. Если энергия выделяется или поглощается в виде теплоты, то такие реакции записываются посредством уравнений химической реакций с указанием тепловых эффектов, при этом необходимо указывать фазовый состав реагирующих веществ. Химические реакции, протекающие с выделением тепла, называются экзотермическими, а с поглощением тепла – эндотермическими. Изучением тепловых эффектов реакций занимается термохимия. В термохимии тепловой эффект реакции обозначается Q и выражается в кДж.
Химическая термодинамика изучает энергетические эффекты химических реакций, позволяет определить возможность, направление и глубину протекания химической реакции в конкретных условиях, химическое равновесие и условия его смещения.
2. Перечислите, какие вы знаете системы. Как называются реакции по тепловым эффектам?
Каждое отдельное вещество или их совокупность представляет собой термодинамическую систему. Если термодинамическая система не обменивается с окружающей средой ни веществом, ни энергией, ее называют изолированной. Такая идеализированная система используется как физическая абстракция при рассмотрении процессов, исключающих влияние внешней среды. Система, обменивающаяся с окружающей средой только энергией, называется закрытой. Если же возможен энергетический и материальный обмен – система открытая.
Эндотерми́ческие реа́кции - химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
3. Дайте понятия процессам: изобарный, изохорный, изотермический.
1. Изотермический. Это обратимый процесс, проходящий при постоянной температуре (газ в термостате):Т=const=Т0. Для него уравнение состояния идеального газа принимает вид:
pV=νRT0=const. (1)
Это уравнение изотермы. Для любых двух точек на изотермеp1V1=p2V2.
2. Изохорный процесс. Это обратимый процесс, протекающий при постоянном объёме, т.е. в баллоне с жёсткими стенками:V=const=V0. Для него уравнение состоянияpV=νRTпримет вид:
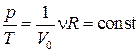 .
.
Это
уравнение изохоры. На изохоре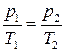
3. Изобарный процесс. Это обратимый процесс, протекающий при постоянном давлениир=р0=const. Для него уравнение состоянияpV=νRTпримет вид:
 .
.
Это
уравнение изобары. На изобаре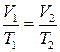
4. Что такое энтальпия образования?
Стандартная
энтальпия образования ![]() –
тепловой эффект реакции образования
одного моля вещества из простых веществ,
его составляющих, находящихся в устойчивых
стандартных состояниях.
–
тепловой эффект реакции образования
одного моля вещества из простых веществ,
его составляющих, находящихся в устойчивых
стандартных состояниях.
dH=dU+A dH=dHпр.-dHисх.
5. Что такое термохимическое уравнение? Некоторые особенности термохимических уравнений
Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ. Особенность термохимических уравнений заключается в том, что при работе с ними можно переносить формулы веществ и величины тепловых эффектов из одной части уравнения в другую. С обычными уравнениями химических реакций так поступать, как правило, нельзя.
Допускается также почленное сложение и вычитание термохимических уравнений. Это бывает нужно для определения тепловых эффектов реакций, которые трудно или невозможно измерить в опыте.
