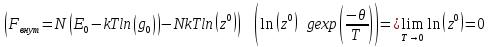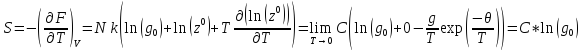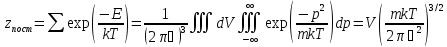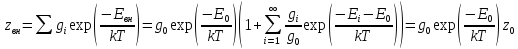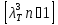7 семестр ИТАЭ / Экзаменционная программа ТТСВ
.docx-
Каким минимальным объемом исходной экспериментальной информации о термодинамическом поведении вещества необходимо располагать, чтобы на основе соотношений феноменологической термодинамики рассчитать любую термодинамическую функцию этого вещества? Чем определяется точность результатов таких расчетов? Каковы ограничения рассматриваемого подхода?
-
Поведение функции PVT, вполне достаточно, для определения всех термодинамических функций. Точность зависит от правильности уравнение состояния, и определение констант. Система не замкнута, требуется задать некоторое изменение количество теплоты в некотором процессе, нет возможности определение явной форме от температурной зависимости.
-
-
Изложите общий подход статистической термодинамики к вычислению термодинамических свойств веществ. Какими исходными данными необходимо располагать для проведения таких расчетов? Чем определяется точность результатов? Сравните этот подход с методом, основанным на применении соотношений феноменологической термодинамики.
-
Необходимостью определение статистической суммы вещества, с помощью ее можно определить (F), а зная ее, можно все определит. Для этого необходимо знание энергию электронных уровней, статистические веса, постоянную колебательную и вращательную энергию. Точность зависит от определение всех этих параметров. Феноменологический термодинамика позволяет определить все остальные термодинамические потенциалы и связь между ними, но она не система не замкнутая, статистический подход позволяет определить один из потенциалов и не более.
-
-
Выведите формулы для расчета статистической суммы и на этой основе – вкладов в термодинамические функции больцмановского идеального газа от поступательных и внутренних степеней свободы молекул. Укажите границы применимости статистики Больцмана.
-
-
Проанализируйте характер температурных зависимостей вкладов поступательных и внутренних степеней свободы молекул в термодинамические функции больцмановского идеального газа. Объясните, почему вклады внутренних степеней свободы молекул в термодинамические функции удовлетворяют требованиям теоремы Нернста, а вклады поступательных степеней свободы – не удовлетворяют.
-
Достаточно однозначно, нельзя ответить на этот вопрос. Самым простым способом рассмотрим это на примере (Cp), поступательная часть в этом случаи не меняется и постоянная, внутренняя при достижение определенной температуры дает некоторый вклад R/2. Так как первоначально выполнена предположение, что поступательная часть соответствует больцмоноскому статистике.
-
-
Изложите схему классификации электронных состояний атомов и способ подсчёта статических весов энергетических уровней. Объясните, как подчитать вклад электронных состояний атомов в термодинамические функции одноатомного идеального газа и какая при этом возникает трудность.
-
1 энергетический уровень электронный очень большой, посравнению с 0, а следующие еще больше, но разница между 0-1 уровней практически составляет 75% всей энергии. Статистические веса читается
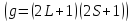 .
Как правила его практически и нету при
нормальных температурах, а статистическая
сумма равна 1. Трудность в возникает в
определение статистических весов.
.
Как правила его практически и нету при
нормальных температурах, а статистическая
сумма равна 1. Трудность в возникает в
определение статистических весов.
-
-
Изложите схему классификации электронных состояний двухатомных молекул и способ подсчёта статистических весов электронных уровней молекул. Покажите, как выглядит колебательно-вращательный сектор двухатомной молекулы, как определяются предельные колебательные и вращательные квантовые числа и как вычислить электронно-колебательную-вращательную статическую сумму молекулы.
-
Изложите квантовую теорию вращательного энергетического спектра гомодермных двухатомных молекул и объясните, почему чистый газ, состоящий из таких молекул, фактически следуют рассматривать как смесь.
-
Берется сумма по вращательным весам нечетную, а каждый уровень энергии уменьшается, с одного уровня до следующего. Так как состоит из одних и техже атомов, но уровни их различны.
-
-
Дайте обоснование применению модели (гармонический осциллятор-жесткий ротатор) для описания колебательно-вращательного энергетического спектра двухатомной молекулы. Объясните, как на основе этой модели вычислить стандартные термодинамические функции двухатомного газа и каково влияние погрешности используемой модели на результаты расчета.
-
При использование данной модели энергетические спектры колебательные и вращательные показывают себя не правильно и даже очень, колебательный постоянный по уровням, а вращательный даже ускоряется при этом. Погрешность возникает в определение постоянной вращательной и колебательных.
-
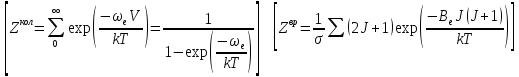
-
Изложите процедуру подсчёта числа симметрии молекулы на основе анализа ее вращательной симметрии. Объясните, как и при каких условиях следует использовать эту величин для вычисления стандартных термодинамических функции газа.
-
Подсчёт числа симметрии молекулы заключается нахождении такой оси при которой поворот на угол меньшее 360 приводит к повторению картины. Она считается для вращательной статистической суммы.
-
-
Выведите формулу для вычисления статистической суммы смеси больцмановских идеальных газов. Покажите как на этой основе подчитать термодинамические функции рассматриваемой системы. Какие термодинамические функции смеси идеальных газов подчиняется закону Амага, какие – не подчиняются? Приведите соответствующие соотношения.
-
Дайте определение парциальных термодинамических функций компонентов смеси. Совпадают ли эти велечины с соответствующими термодинамическим функциями чистых компонентов? Подчитайте парциальную энергию Гиббса компонента смеси идеальных газов и используя полученное выражение найдите парциальные объем, энтропию и энтальпию.
-
Выведете общее условия химического равновесия и на этой основе – уравнение химического равновесия в смеси идеальных газов (уравнение изотермы Вант-Гоффа). Объясните, какими исходными данными необходимо располагать чтобы вычислить термодинамическую константу химического равновесия (Кр).
-
Объясните, как рассчитать состав любой химически реагирующей смеси идеальных газов. Приведите примеры.
-
Дайте определение стандартного теплового эффекта химической реакции. Как связана эта величина с температурной зависимостью термодинамической константы химического равновесия? Как рассчитать эту величину, зная стандартные тепловые эффекты реакций образования реагентов из стандартных веществ?
-
Тепловой эффект хим. рек. Это количество тепла, которая выделяется при реакции смеси.
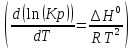 .
Как сумму этих элементов на соответствующий
количество молей реакции.
.
Как сумму этих элементов на соответствующий
количество молей реакции.
-
-
Сформулируйте и обоснуйте закон Гесса. Объясните, как на основе этого закона построить расчета теплового эффекта любой химической реакции с использованием стандартных тепловых эффектов реакций образования химических соединений из стандартных веществ.
-
Объясните, почему значение термодинамической константы химического равновесия не зависит от выбора начал отчета стандартных энтропий реагентов и как это связанно с тепловой теоремой Нернста.
-
Так как берется разность этих значений.
-
-
Постройте диаграммы, иллюстрирующие зависимость от температуры и давления основных термодинамических функций химически реагирующего идеального газа, и дайте соответствующие пояснения. Укажите источники погрешностей расчета этих величин и степень их влияния на результаты расчета.
-
Приведите и обоснуйте наиболее употребительные аналитические соотношения для описания термических уравнений состояний вещества в конденсированном состоянии и в состоянии умеренного сжатого газа. Укажите характерные порядки величин, определяющих поведение вещества в этих состояний.
-
Постройте диаграммы, иллюстрирующие вид термического уравнения состояния вещества, включая области фазовых переходов. Поясните связь наблюдаемого поведения вещества с влиянием сил межмолекулярного взаимодействия.
-
Дайте определение тройной точки вещества. Изобразите фазовую диаграмму, содержащую тройную точку равновесия газа, жидкой и твердой фаз. Приведите пример вещества, у которого такой тройной точки нет, покажите его фазовую диаграмму и прокомментируйте ее вид. Проведите примеры фазовых диаграмм, в которых имеется тройные точки, связанные с полиморфными превращениями в твердой фазе вещества.
-
Постройте графики, иллюстрирующие поведение энергии Гиббса вещества в окрестности фазового превращения. Что такое стабильные и метастабильные состояния вещества? Приведите примеры. Постройте бинодаль и спинодаль для фазового перехода жидкость – газ. Укажите соотношения, определяющие поведения вещества в критической точке этого фазового перехода.
-
Что такое единое уравнение состояния вещества? Приведите примеры. Покажите, как на основе такого уравнения состояния рассчитать параметры фазового перехода жидкость – газ. Докажите правило Максвелла.
Задачи
-
Выведете формулу для Джоуля-Томсона вещества, используя данные о термическом уравнении состояния и изобарную теплоемкость.
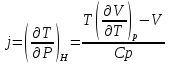
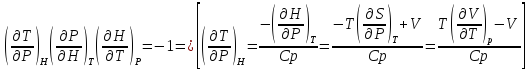
-
Выведете формулу для (Сv) используя (Ср) и термическое уравнение состояние.
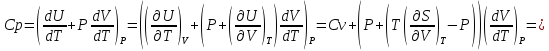
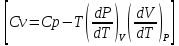
-
Покажите, как зависит от давление и температуры функции H,S,Cp,Cv.
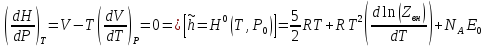

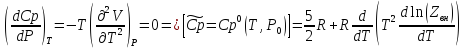
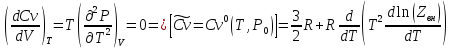
-
Доказать, что
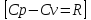 ,
а эффект Джоуля-Томсона отсутствует.
{Смотри
2 задачу}
,
а эффект Джоуля-Томсона отсутствует.
{Смотри
2 задачу}

-
Докажите, что V,H,Cp подчиняются закону Амага. Объясните почему.
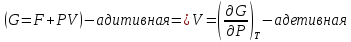
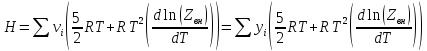
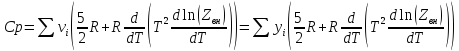
-
Выведите закон Дальтона и формулу для энтропии, использую статистическую термодинамику. Объясните смысл парадокса Гиббса.
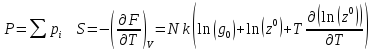
-
При вычислении стандартных термодинамических функций двух атомного газа, состоящего из гомодермных молекул, ошибочно вычислили, суммировав по всем значением вращательного квантового числа. Можно ли исправить результаты расчета, не проводя его заново?
-
Можно использовать данные результаты только лишь при достаточном большом характеристической температуры и намного меньшей. В районе характеристической температуре придется делать пере расчёт.
-
-
Оцените (груба) (Ср) четырехатомного газа. При (Т=500 К)
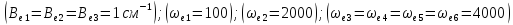
-
Вращательные степени свободы полностью активированы (3/2R), и одна колебательная (R), поэтому приблизительно Ср=7R
-
-
Сравните на одном графике температурные зависимости вклада колебательных степеней свободы молекулы в теплоёмкости и результата расчёта по гармоническому осциллятору.
-
Необходимо нарисовать обыкновенную теплоемкость для колебательного составляющего и для реального вещества. Так как используется гармонический осциллятор, то разность между энергиями сохраняется, у реального уменьшается. Что означает, что реальное вещество характеристическая температура будет меньше чем у гармонического осциллятора.
-
-
Покажите, что разность (Ср-Сv) вещества в конденсированном состоянии мала по сравнению с самими этими величинами.
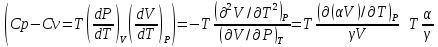
-
Выведете формулу для двухатомного дислоцирующего газа для V,H,S и изобразите их зависимость от температуры и давления.
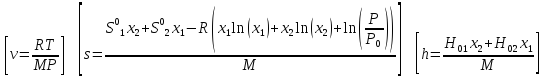
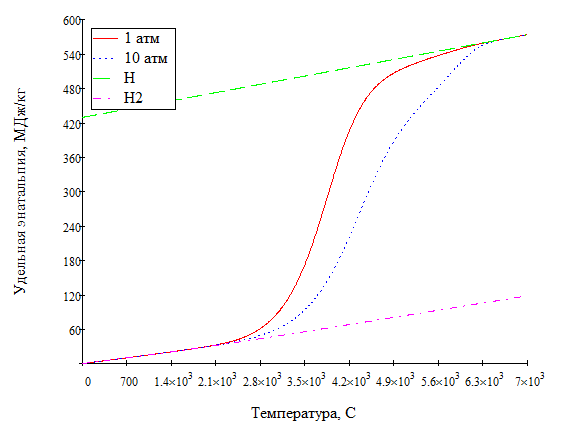


-
Изобразите теплоемкость для орто, пара и гетроядерных молекул.

-
Выведете формулу,
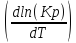
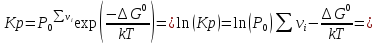

-
Запишите уравнения для расчета состава продуктов сгорания
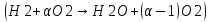 .
Изобразите зависимость состава системы
от температуры.
.
Изобразите зависимость состава системы
от температуры. -
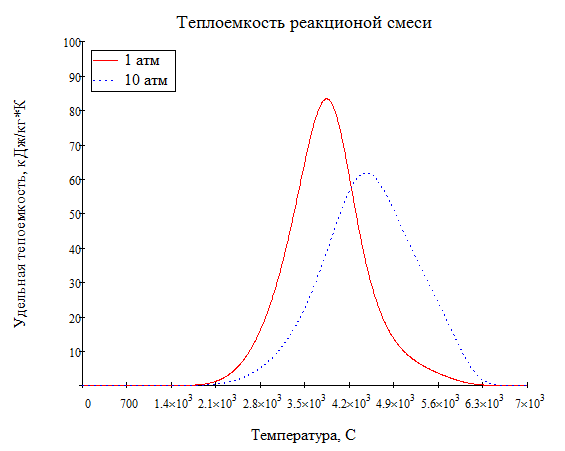
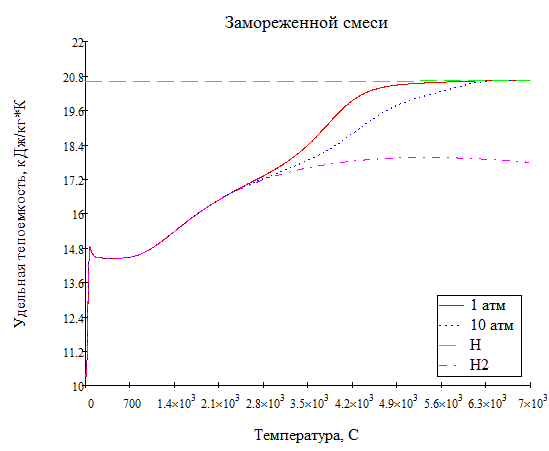
Выведете формулы для (Cp=Cpr+Cpf). И изобразите каждый график от температуры и давления
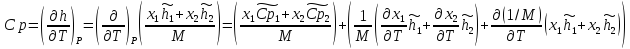
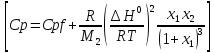
-
Выведете формулу скорости звука используя Ср и термические состояние вещества.
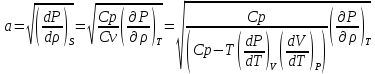
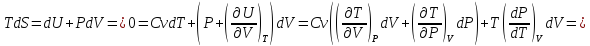
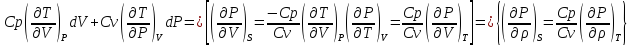
-
Определите (груба) вклады в Cp колебательных составляющих при температуре 1000 и 5000, а we 1500; 3500.
-
(0-R); (R-2R)
-
-
Выведете уравнение для состава двух атомного дислоцирующего газа. Как зависет (Кр) от температуры. Х(T,P).
-
У нас имеется химическая уравнение распадение вещества на атомы, а также уравнение состава.
-
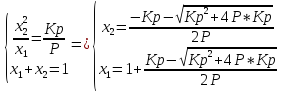
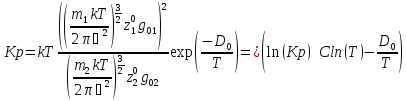
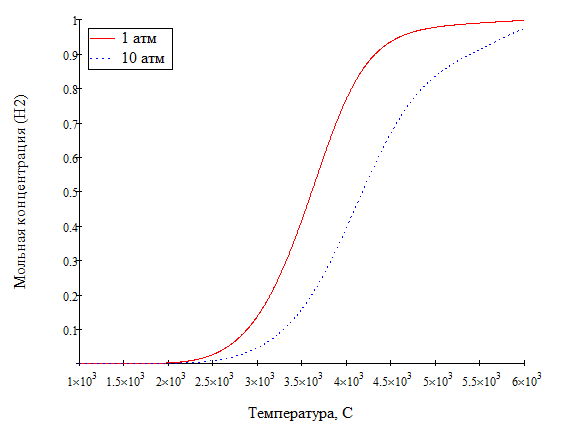
-
Выведете на основе статистической термодинамики энергию Гиббса смеси идеальных газов. Получите от сюда зависимость G(T,P,x)
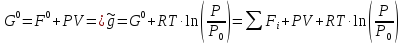
-
Выведете для внутренних степеней свободы S,H,Cp. Покажите что они соответствуют теореме Нерста.