
1-7 Физ химия
.docx1.Химическая кинетика - раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1)расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача);2)определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость
химической реакции
описывает изменение концентраций
реагирующих веществ в единицу времени.
Для реакции aA
+ bB
+ ...![]() dD
+ eE
+ ...
dD
+ eE
+ ...
Скорость реакции зависит от природы реагирующих веществ, их концен- трации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики - законом действующих масс:
Скорость
химической реакции в каждый момент
времени пропорциональна текущим
концентрациям реагирующих веществ,
возведенным в некоторые степени:
![]() где k -
константа скорости (не зависящая от
концентрации); x, y -
некоторые числа, которые называют порядком
реакции по веществам A
и B, соответственно. Сумма показателей
степеней x + y называется общим
порядком реакции.
Порядок реакции может быть положительным
или отрицательным, целым или дробным.
Кинетическое уравнение реакции первого
порядка:
где k -
константа скорости (не зависящая от
концентрации); x, y -
некоторые числа, которые называют порядком
реакции по веществам A
и B, соответственно. Сумма показателей
степеней x + y называется общим
порядком реакции.
Порядок реакции может быть положительным
или отрицательным, целым или дробным.
Кинетическое уравнение реакции первого
порядка:
![]() ;Приведение
уравнения к линейному виду даёт
уравнение:
;Приведение
уравнения к линейному виду даёт
уравнение:
![]()
Для
реакций второго порядка кине- тическое
уравнение имеет следующий вид:
![]() или
или
![]()
Линейная
форма уравнения:
![]()
Большинство
химических реакций состоит из нескольких
стадий, называемых элементарными
реакциями.
Под элементарной реакцией обычно
понимают единичный акт образования
или разрыва химической связи, протекающий
через образование переходного комплекса.
Число частиц, участвующих в элементарной
реакции, называ-ют молекулярностью реакции.Элементарные
реакции бывают только трех типов:
мономолекулярные(A ![]() B
+ ...), бимолекулярные
(A + B
B
+ ...), бимолекулярные
(A + B![]() D
+ ...) и тримолекулярные
(2A + B
D
+ ...) и тримолекулярные
(2A + B ![]() D
+ ...). Для элементарных реакций общий
порядок равен молекулярности, а порядки
по веществам равны коэффициентам в
уравнении реакции.
Мономолекулярные реакции-реакц-ии,
в которых происходит химическое
превращение одной молекулы (изомеризация,
диссоциация и т. д.).
Бимолекулярные реакции —
реакции, элементарный акт которых
осуществляется при столкновении двух
частиц (одинаковых или различных.
Тримолекулярные реакции —
реакции, элементарный акт которых
осуществляется при столкновении трех
частиц: О2 +
NО + NО → 2NО2.
Реакции с молекулярностью более трёх
неизвестны.Для элементарных реакций,
проводимых при близких концентрациях
исходных веществ, величины молекулярности
и порядка реакции совпадают. Чётко
определен-ной взаимосвязи между
понятиями молекулярности и порядка
реакции нет, так как порядок реакции
характеризует кинетическое уравнение
реакции, а молекулярность — механизм
реакции.
D
+ ...). Для элементарных реакций общий
порядок равен молекулярности, а порядки
по веществам равны коэффициентам в
уравнении реакции.
Мономолекулярные реакции-реакц-ии,
в которых происходит химическое
превращение одной молекулы (изомеризация,
диссоциация и т. д.).
Бимолекулярные реакции —
реакции, элементарный акт которых
осуществляется при столкновении двух
частиц (одинаковых или различных.
Тримолекулярные реакции —
реакции, элементарный акт которых
осуществляется при столкновении трех
частиц: О2 +
NО + NО → 2NО2.
Реакции с молекулярностью более трёх
неизвестны.Для элементарных реакций,
проводимых при близких концентрациях
исходных веществ, величины молекулярности
и порядка реакции совпадают. Чётко
определен-ной взаимосвязи между
понятиями молекулярности и порядка
реакции нет, так как порядок реакции
характеризует кинетическое уравнение
реакции, а молекулярность — механизм
реакции.
Катализ — процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Каталитические реакции — реакции, протекающие в присутствии катализаторов.Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) — при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного — снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.Многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов.
2.В условиях замкнутой системы химические превращения обратимы. Однако положение равновесия может быть смещено вправо настолько сильно,что скоростью обратной реакции можно пренебречь. Такие превращения можно описать кинетическими уравнениями односторонних реакций. В общем виде для односторонней реакции: aA + bB + ... продукты реакции;
W = – 1/a d[A]/dt = – 1/b d[B]/dt = = k[A]tl [B]tm,где a, b.. .- стехиометрические коэффициенты реакции, [A]t, [B]t - концентрации реагентов к моменту времени t после начала реакции или так называемые текущие концентрации. Определению константы скорости из опытных данных o Ct предшествует установление стехиометрических коэффициентов и порядков реакции по реагентам. Определение стехиометрических коэффициентов основано на предложенном Оствальдом приеме проведения реакций в условиях избытка всех реагентов по сравнению с одним. Стехиометрические коэффициенты устанавливают по изменению концентраций оставшихся в системе реагентов после полного израсходованная одного из реагентов (D, например):aA + bB + dD продукты и a/d = {[A]0 - [A]}/[D]0, b/d ={[B]0 - [B]}/[D]0.Для реагента с наименьшим значением С принимают единичный стехиометрический коэффициент.(Следует еще раз подчеркнуть, что в большинстве случаев нет соответствия между стехиометрическими коэффициентами и частными порядками реакций.) Если концентрация одного из реагентов (при единичном стехиометрическом коэффициенте) на порядок выше, чем остальных, изменением его концентрации в ходе реакции можно пренебречь, т.е. общий порядок кинетического уравнения снижается на единицу. Реакции, протекающие в таких условиях, называют реакциями псевдо-(p -1) -го порядка.
3. В приведенных кинетических уравнениях фигурирует, как переменная, время от начала реакции. Это удобно при изучении реакции в условиях замкнутого объема, в который в момент времени t = 0 вводится дозируемое количество реагентов. Иной режим протекания химических превращений - в условиях открытой системы, когда происходит непрерывный материальный обмен с окружающей средой. Такой обмен - подвод и отвод реагентов через границы системы - характерен на клеточном уровне для всех живых организмов. Разность концентраций вне и внутри клетки - движущая сила потока реагентов и продуктов. Кинетическое описание реакций в открытых системах проводят введением в дифференциальные уравнения дополнительных членов: скорости введения реагентов в реактор и скорости удаления продукта и непрореагировавших реагентов из реактора. Условия в реакторе обычно резко отличаются от условий в подводящих и отводящих магистралях, и превращение веществ происходит лишь во время нахождения их в реакторе. В реакторе поддерживаются постоянными температура и давление. Постоянство давления обеспечивается равенством объемных скоростей подвода реагентов и отвода смеси продуктов и непро-реагировавших веществ. В зависимости от скорости подачи реагентов, объема и конфигурации реактора и других характеристик осуществляется тот или иной гидродинамический режим потока – ламинарный или турбулентный. В случае ламинарного режима потока его можно рассматривать как совокупность независимых друг от друга (замкнутых) перемещающихся миниреакторов.В каждом сечении реактора в установившемся режиме подачи реагентов и отвода смеси продуктов из реактора характерной будет неизменность концентраций реагентов и продуктов.Кинетическое описание процессов в подобном реакторе идеального вытеснения практически не отличается от такового для замкнутых систем.
4.Струевые кинетические методы (проточные методы), кинетические методы изучения быстрых р-ций, основанные на исследовании их протекания в потоке после быстрого смешения реагентов. Изменение состава реакц. смеси фиксируют спектрофотометрически, кондуктомет-рически, методами термического анализа или ЭПР. В зависимости от скорости потока, к-рая м. б. постоянной, нарастающей или мгновенно падающей до нуля, различают методы непрерывной, ускоренной или остановленной струи.
- В методе непрерывной струи два р-ра с разными реагентами поступают в смесит. камеру, а затем в трубку (трубчатый реактор), в к-рой на нек-ром расстоянии от места смешения определяют концентрацию одного изреагентов или продуктов р-ции по оптич. плотности или электропроводности р-ра. Время протекания р-ции прямо пропорционально расстоянию, пройденному реакц. смесью от смесит. камеры до места в трубке, где проводят измерения. Меняя скорость потока и расстояние от точки смешения до места измерения, можно получить данные для построения кинетич. кривой.
В методе ускоренной струи концентрации реагентов определяют в фиксир. точке потока, когда скорость р-ции непрерывно меняется. Время, прошедшее от начала р-ции до момента наблюдения, обратно пропорционально скорости потока и в ходе опыта уменьшается.
В методе остановленной струи два р-ра с реагентами после смешения поступают в трубку, к-рая заканчивается поршнем. Р-р давит на поршень и перемещает его до момента, пока поршень не упрется в ограничитель, в результате чего поток реагентов прекращается и р-ция заканчивается. Измерения концентраций реагентов или продуктов р-ции проводят как в методе ускоренной струи; характеристики и возможности этих двух методов примерно одинаковые.
5.Наиболее общим является деление частиц на два типа: заряженных и незаряженных (нейтральных), участвующих в двух типах реакций: в окислительно-восстановительных и в изогипсических. Разделяют эти два типа реакций по признаку изменения или постоянства Z - формального заряда атомов в соединениях. Его определяют в предположениях, что в гетероядерных соединениях все связи ионные; Z = 0 для свободных атомов и атомов в составе гомоядерных молекул Cl2, O3, P4, S8 и т.п.; в подавляющем большинстве гетероядерных соединений Z(H) = + 1 и Z(0) = – 2. К изогипсическим относятся все реакции изомеризации, полимеризации, распада молекул на симметричные фрагменты, электролитической диссоциации и обратной реакции ионной рекомбинации и некоторые другие:CH2 = CH2 (-CH2-CH2-)n Z(C) = – 2, Z(H) = + 1 и в исходных, и в конечных частицах; аналогично для реакций: NaCl Na+ + Cl-; Z(Na) = + 1, Z(Cl) = – 1;
C2H6 2CH3; Z(C) = – 3, Z(H) = + 1.Все остальные реакции относят к окислительно-восстановительным:
Zn + 2H+ Zn2+ + H2;
Z(Zn) = 0 +2, Z(H) = +1 0;
C2H4Cl2 C2H4 + Cl2;
Z(C) = –1 –2, Z(Cl) = –1 0;
CO + 2H2 CH3OH;
Z(C) = +2 –2, Z(H) = 0 +1.
Недостатком деления частиц на два типа, как и их реакций, является излишняя общность. При таком делении исчезает столь важная характеристика как механизм реакции, а реакционноспособность однотипных по этой классификации частиц, как например, H и CCl4 или газового иона N2+ и иона H+ в растворе не может сравниваться ни по каким показателям.Более информативным и конкретным является деление частиц по физико-химическим признакам с анализом характерных реакций частиц каждого типа.
6.
см 5 + В
земных условиях наиболее распространенной
и устойчивой формой существования
веществ является молекулярная. Признаком
молекул служит электронейтральность
частиц, включающих
два
и
более атомов и четное число валентных
электронов.
Энергия связи атомов в молекулах
варьирует от нескольких десятков до
нескольких сотен кДж/моль. Самой прочной
является связь в молекуле CO (1075 кДж/моль),
а среди простых связей наибольшая
энергия характеризует связи Li–F и H–F
(578 и 565 кДж/моль). При разрыве химической
связи (гомо- или гетеролитическом)
образуются атомы и свободные радикалы
или же ионы: А
+
В
 A
: B
A
: B
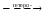 А+
+ :В–
А+
+ :В–
Большинство
химических превращений молекул требует
преодоления значительных активационных
барьеров. Какой-либо корреляции между
Е
и rH,
как
и
для других молекулярных реакций, не
наблюдается. В то же время многими
принимается качественное правило: чем
благоприятнее энергетика реакции, тем
она быстрее протекает в случае
сопоставления однотипных реакций.
Очевидна связь Е
и rH
в случае реакций гомолитического
разрыва связи в молекулах: обратная
реакция рекомбинации радикалов не
требует энергии активации, т.е.
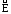 =
0 и
rH
=
=
0 и
rH
=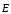 .
В
трех- и более атомных молекулах при их
термическом возбуждении происходит
разрыв самой слабой связи. Как уже
указывалось, реакционноспособность -
понятие относительное. И среди
молекулярных реакций имеются
безактивационные - образование
донорно-акцепторной связи при
взаимодействии молекул, одна из которых
имеет неподеленную пару электронов, а
другая - вакантную спин-орбиталь,
например:F3B
+ :NH3
F3B
: NH3.
С
малой, вплоть до нулевой, энергией
активации протекают реакции
гетеролитической диссоциации в
растворах: H:Cl
(г)
H+
(р)
+ :Cl–
(р).
.
В
трех- и более атомных молекулах при их
термическом возбуждении происходит
разрыв самой слабой связи. Как уже
указывалось, реакционноспособность -
понятие относительное. И среди
молекулярных реакций имеются
безактивационные - образование
донорно-акцепторной связи при
взаимодействии молекул, одна из которых
имеет неподеленную пару электронов, а
другая - вакантную спин-орбиталь,
например:F3B
+ :NH3
F3B
: NH3.
С
малой, вплоть до нулевой, энергией
активации протекают реакции
гетеролитической диссоциации в
растворах: H:Cl
(г)
H+
(р)
+ :Cl–
(р).
7. см 5 + Атомы и радикалы.Валентная "ненасыщенность этих частиц определяет их высокую реакционную способность. Безактивационны реакции образования связи между атомами, атомами и радикалами, двумя радикалами. Однако в случае атомов и радикалов с малым числом атомов прямое взаимодействие типа А + А А2, А + R RA, R + R R2
не происходит. Столкновение будет результативным лишь при участии в нем третьей частицы. Ее роль - принять на себя какую-то часть энергии образующейся связи. В противном случае образовавшаяся молекула, обладающая избыточной энергией, равной энергии связи, при первом же колебании будет распадаться на атомы и радикалы. Ее время жизни не превысит поэтому 10-13 с. Природа третьего тела не существенна. Им может быть атом инертного газа, любая молекула, а также стенка реакционного сосуда. В случае радикалов, включающих несколько атомов “n” и обладающих (3n-6) колебательными степенями свободы, энергия образующейся связи может пойти на возбуждение колебательных уровней энергии и тем стабилизировать “новорожденную” молекулу, образовавшуюся в парном соударении. Константы скорости бимолекулярных реакций рекомбинации радикалов и тримолекулярных реакций рекомбинации атомов близки к предельным, лимитируемым диффузией, значениям.
Рекомбинация радикалов может иногда сопровождаться не только образованием связи, но и диспропорционированием, как например: 2C2 H5 C2H4 + C2H6, 2HO2 H2O2 + O2.Такие реакции могут иметь небольшую энергию активации.
- Вторым типом реакций с участием радикалов является гомолитическое замещение:
R1 + R2X R1X + R2
- Третьей характерной реакцией радикалов является их присоединение по кратной связи, т.е. реакции типа R1 + M R 2
Реакции присоединения радикалов и атомов по кратной связи обычно характеризуют малые энергии активации.
. При высоких температурах в газовой фазе реализуются и обратные реакции распада радикалов на более простые радикал и молекулу с кратной связью. Очевидно, что все реакции этого типа эндотермичны, т.к. рвется -, а образуется -связь. Безактивационный характер реакций гибели большинства радикалов, проходящих со скоростью, лимитируемой лишь диффузией и стерическими затруднениями, определяет абсолютную малость концентраций радикалов в реакционной смеси.
Признак радикалов - наличие неспаренного
электрона и электронейтральность. А́том (от др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств[1]
8.Ионы в растворах.
Реакции ионов в растворах подобны реакциям радикалов и атомов.Основными типами являются реакции ионной рекомбинации (1), гетеролитического замещения (2), присоединения по кратной связи (3):
1. Ag+ + Cl– AgCl, 2. Cl– + C2H5I I– + C2H5Cl, 3. H+ + R-CH=CH2 RCH+ – CH3.
Ионная рекомбинация происходит с небольшими тепловыми эффектами и может быть как экзо-,так и эндотермической.Это очевидно,т.к. ионная рекомбинация обратна реакии гетеролитической диссоциации молекул. Экзотермические реакции рекомбинации происходят безактивационно.
Все реакции ионной рекомбинации бимолекулярны, поскольку сольватированный ион является многоатомной частицей со многими колебательными степенями свободы сольватирующих его частиц растворителя.Присоединение ионов по кратной связи не протекает столь быстро, как присоединение радикалов. В случае ионов знак rН для реакции может быть и отрицательным, и положительным. Выигрыш энергии за счет разницы энергии - и -связи не всегда будет компенсировать проигрыш энергии сольватации. При равном заряде частиц эта энергия тем больше, чем меньше радиус частицы. Присоединение же иона по кратной связи - это переход от иона с меньшим к иону с большим радиусом:CN– + (CH3)2 O NC - (CH3)2 -O-; OH– + R CH = O HO CH(O-) R; H+ + R- CH = CH2 RCH+2 CH3
Для специфически сольватированных катионов характерны реакции пересольватации:(H:OH2)+ + HCOOH H2O + HCOOH+2.По той же причине, что рассмотрена выше, тепловые эффекты реакции пересольватации могут быть и положительными, и отрицательными, а скорость реакций - варьировать в широких пределах. Это относится и к реакциям гетеролитического замещения полярной группы молекулы:Y– + RX X– + RY. В отличие от реакций гетеролитической диссоциации или рекомбинации заметные энергии активации характерны и для экзо- и для эндотермических реакций гетеролитического замещения. Их значения - от десятков до сотен кДж/моль. Каких-либо корреляционных зависимостей типа правила Семенова-Поляни для реакций гетеролитического замещения не наблюдается. Это связано, в частности, с тем, что эти реакции, в отличие от гомолитических, могут протекать по разным механизмам, обозначаемым как SN1 и SN2. Если гетеролитическое замещение Y– + RX X– + RY
Характеризуя ионы в растворах в целом,, можно сказать, что их реакционная способность ниже, чем у атомов и радикалов, хотя намного превосходит реакционную способность молекул.
9.Ион-радикалы.Все приведенные реакции с участием ионов относятся к изогипсическим. Не менее распространены, однако, и окислительно-восстановительные реакции с их участием, протекающие с переносом электрона. Такие реакции характерны для ионов металлов переменной валентности:Cu+ + Fe3+ Cu2+ + Fe2+ ,Sn2+ + Tl 3+ Sn4++ Tl+
В подобных реакциях электронного переноса могут участвовать и молекулы, и безметалльные ионы:
Fe2+ + H2O2 Fe3+ + OH– + OH; Ce4+ + CH3OH Ce3+ + H+ + CH2OH;
SO32– + HOCl SO42–- + H+ + Cl–; NO2– + C(NO2)4 2 NO2 + C(NO2)–3
Приведенные реакции одно- и двухэлектронного переноса сопровождаются разрывом химических связей. В случае же относительной стабильности первичного продукта реакции одноэлектронного переноса наблюдают образование ион-радикалов:ClO2 + SO32– ClO2– + SO3– ;Cu+ + O2 Cu2+ + O2– .
Анион-радикалы обычно более устойчивы, чем катион-радикалы. Катион-радикалы, как первичные продукты реакции, образуются при окислении органических веществ в полярных растворителях.
Образуются ион-радикалы и при гетеролитической диссоциации радикалов, содержащих “кислый” атом H: HO2 H++O2– ; HSO3 H+ + SO3– ; OH H+ + O–.
Характерными реакциями ион-радикалов являются те же реакции электронного переноса:
O2– + C(NO2)4 O2 + NO2 + C(NO2)3– ; Fe3+ + O2– Fe2+ + O2 и реакции, подобные реакциям рекомбинации радикалов: 2SO3– S2O62– ;2O–C6H4–O– O––C6H4-O– + O=C6H4=O (хинон).
Короткоживущие нестабильные ион-радикалы распадаются на ион и радикал:
C6H6+ H+ + C6H5; C2H5Br– C2H5 + Br– .
Газовые ионы.
Наивысшая реакционная способность присуща газовым ионам. Такие ионы образуются в различных газоразрядных устройствах, в плазменных горелках, в газах, облучаемых потоками ускоренных электронов и ядер. Образование газовых ионов происходит в условиях работы устройств новой техники - в ударных и детонационных волнах при быстром движении тел в воздухе. В природных условиях газовые ионы возникают в канале разряда молний в верхних слоях атмосферы на высотах более 90 км под действием излучения Солнца
Другой “мягкий” путь образования газовых ионов - “прилипание” электронов к нейтралям, безактивационное в случае экзотермического характера реакции, но в большинстве случаев протекающее лишь при тройных соударениях:O2 + e– + M O2– + M – 84; NO2 + e– + M NO2– + M – 156 кДж/моль
Высокая реакционная способность газовых ионов проявляется в том, что большинство их экзотермических реакций с нейтралями происходит безактивационно. К таким реакциям относятся:
1. Ион-молекулярные реакции с переносом атома: NH3+ + NH3 NH4+ + NH2 – 130 кДж/моль;
H– + H2O OH– + H2 – 130 кДж/моль
2. Ион-молекулярные реакции с переносом электрона: H+ + CO CO+ + H – 39 кДж/моль;
O+ + O2 O2+ + O – 108 кДж/моль.
Качественной причиной безактивационного характера реакций является понижение активационного горба за счет энергии поляризации нейтраля ионом происходит с большой энергией активации.
Еще одним типом реакций газовых ионов является их безактивационная нейтрализация или рекомбинация разнозарядных частиц:Na+г c Сl–г, I+ c I– или молекулярных ионов с электроном, как например, N2+ или O+2 c e–. Поскольку энергия, выделяющаяся в таких реакциях: N2+ + e– (N2) – 1495, Na+ + Cl– (NaCl) – 540 кДж/моль больше энергии связи атомов в продуктах: N2 ( = 945), NaCl ( = 412 кДж/моль), молекулы продуктов будут при первом же колебании ядер диссоциировать на атомы. Реакции типа N2+ + e- 2N называют реакциями диссоциативной рекомбинации.
Комплексы.
Понятие "комплекс" менее строго определено, чем понятия для других частиц. Частицы в комплексах связаны обычно водородными связями, силами электростатического взаимодействия; немало комплексов образуется за счет донорно-акцепторного взаимодействия частиц. Комплексами являются по сути все ионы в растворах, связанные с молекулами растворителя силами ион-дипольного взаимодействия. В растворителях с низкой диэлектрической проницаемостью часть, а иногда и все ионы присутствуют в форме комплексов - ионных пар, образованных противоположно заряженными сольватированными ионами.
Велико число примеров комплексов, образованных за счет водородных связей:
Нередки случаи, когда при вхождении частицы в состав комплекса реакционноспособность ее повышается. Это может происходить в результате:сильной поляризации частицы ее партнером,
полного или частичного внутрикомплексного переноса заряда,
Роль комплексов в химических процессах важна, а образование их как промежуточных веществ происходит во многих сложных реакциях.
