
- •Профессия: Аппаратчик хво
- •Расчет по уравнениям
- •Растворы
- •2. Концентрация растворов
- •4.Пересыщенные растворы
- •Растворы электролитов. Теория электролитической диссоциации.
- •2.Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- •3.Реакции нейтрализации
- •Произведение растворимости
- •5.Диссоциация воды. Водородный показатель.
- •6.Индикаторы
- •Гидролиз солей
- •Характеристика природных вод
- •Основные показатели качества воды
- •Титр. Титрование.
- •Титр. Титрованный раствор.
Профессия: Аппаратчик хво
Тема: Общие сведения из химии
ПОЛОЖЕНИЯ АТОМНО-МОЛЕКУЛЯРНОЙ ТЕОРИИ
СТРОЕНИЯ ВЕЩЕСТВА
Основы атомно-молекулярного учения впервые были изложены Михаилом Васильевичем Ломоносовым. В 1841 году в одной из своих первых работ - «Элементы математической химии» - Ломоносов сформулировал важнейшие положения своей корпускулярной теории строения вещества.
В основе атомно-молекулярного учения лежит принцип дискретности (прерывистости) строения вещества: всякое вещество не является чем-то сплошным, а состоит из отдельных очень малых частиц-молекул.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами и способная существовать самостоятельно.
Молекулы состоят из атомов.
Атом – наименьшая частица элемента, обладающая его химическими свойствами.
В состав молекулы может входить различное число атомов. Молекулы благородных газов – одноатомны; молекулы водорода, азота – двухатомны; воды – трехатомны. Молекулы наиболее сложных веществ – высших белков и нуклеиновых кислот – построены из сотен тысяч атомов. При этом атомы могут соединяться друг с другом не только в разных соотношениях, но и различным образом. Поэтому при сравнительно небольшом количестве элементов, число различных веществ велико.
Ломоносов установил закон сохранения массы(1848 г.): масса (вес) веществ, вступающих в реакцию, равна массе (весу) веществ, образующихся в результате реакции.
В результате установления этого закона с конца XVIII века в химии прочно утвердились количественные методы исследования. При изучении количественного состава веществ был установлен закон постоянства состава: каждое химическое соединение, независимо от способа его получения, имеет определенный весовой состав.
В 1803 году английский ученый Дальтон установил закон кратных отношений: если два элемента образуют друг с другом несколько химических соединений (СО иСО2), то весовые количества одного из элементов, приходящиеся в этих соединениях на одно и то же количество другого, относятся между собой как небольшие целые числа. В случае СО и СО2 – на одну весовую часть углерода в двуокиси углерода приходится ровно в 2 раза больше кислорода, чес в окиси.
Из закона постоянства состава следует, что элементы соединяются друг с другом в определенных весовых соотношениях.
Поэтому одновременно с установлением этого закона в химию было введено понятие эквивалентного веса (сокращенно эквивалента) элемента.
«Эквивалентный» означает «равноценный».
Эквивалентом элемента называют его весовое количество, соединяющееся с 8 весовыми частями кислорода, или с 1,0079 весовыми частями водорода, или заменяющие те же количества кислорода или водорода в их соединениях.
Д.И.Менделеев указал на необходимость различать понятия простого вещества и химического элемента.
Каждое простое вещество характеризуется определенными химическими и физическими свойствами. Когда какое-либо простое вещество вступает в химическую реакцию и образует новое вещество, то оно при этом утрачивает большинство своих свойств. Например, железо, соединяясь с серой теряет металлический блеск, ковкость и др. Следовательно, в сульфиде железа нет железа, каким мы его знаем в виде простого вещества. Но т.к. из сульфида железа при помощи химических реакций можно снова получить металлическое железо, то химики говорят, что в состав сульфида железа входит элемент железа. Также и сера входит в сульфид железа не в виде хрупкого желтого горючего вещества серы, а в виде элемента серы.
Также водород и кислород, входящие в состав вода, содержатся не в виде газообразных водорода и кислорода с их характерными свойствами, а в виде элементов кислорода и водорода.
Химический элемент – вид атомов, характеризующийся определенной совокупностью свойств (определенной величиной положительного заряда ядра)
Путем соединения атомов одного и того же элемента образуются простые вещества.
Соединение атомов различных элементов дает сложное вещество.
Эквивалентом сложного вещества называется такое весовое количество его, которое взаимодействует без остатка с одним эквивалентом водорода (1,0079 весовых частей) или кислорода (8 весовых частей) или вообще с одним эквивалентом любого другого вещества.
Введение в химию понятия «эквивалент» позволило сформулировать закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
Количество вещества, масса которого в граммах численно равна его эквиваленту, называется грамм-эквивалентом и обозначается г-экв.
Но прежде чем приступить к определению эквивалентного веса различных веществ, необходимо ввести понятия об атомном и молекулярном весе, единицах измерения, валентности.
В 1961 году была принята единая шкала атомных весов, основой которой является углеродная единица, которая представляет собой 1/12 часть массы атома изотопа углерода 12С.
В соответствии с этим в настоящее время атомным весом (относительной атомной массой) элемента называют массу его атома, выраженную в углеродных единицах.
Согласно шкале атомных весов масса атома водорода равна 1,0079 у.е., масса атома кислорода = 15,9994 у.е. и т.д. (см. периодическую систему элементов Д.И.Менделеева).
Так как масса молекулы любого вещества равна сумме масс атомов, образующих эту молекулу, то молекулярные веса выражаются в тех же единицах, что и атомные.
Молекулярным весом (относительной молекулярной массой) простого или сложного вещества называют массу его молекулы, выраженную в углеродных единицах.
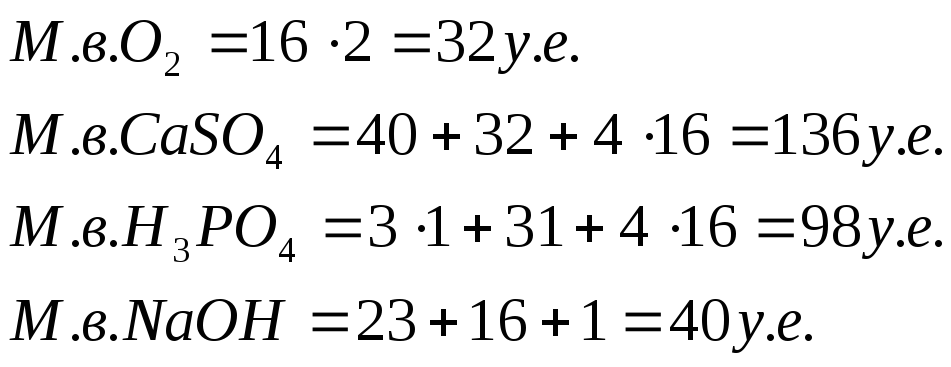
В химии наряду с граммом как единицей массы пользуются также мерой количества вещества, называемой грамм-молекулой (сокращенно моль).
Грамм-молекулой называют количество вещества, масса которого в граммах численно равна молекулярному весу вещества.
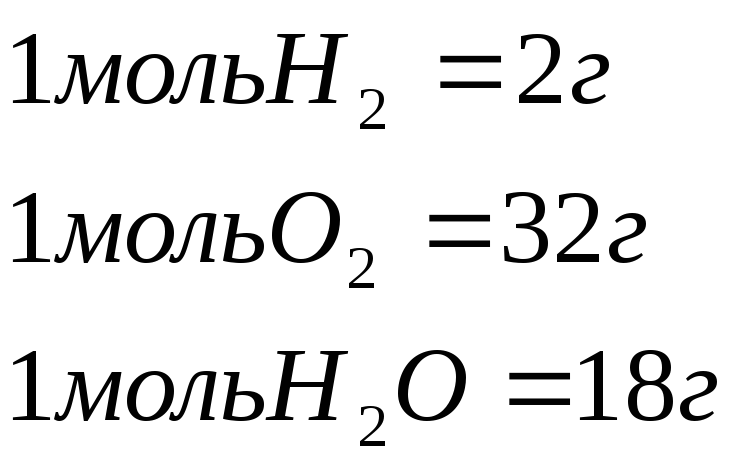
Соответственно, грамм-атомом называют количество элемента, масса которого в граммах численно равна атомному весу элемента.
![]()
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью по водороду.
Например, в соединениях HCl, H2O, NH3, CH4 валентность
хлора по водороду равна 1,
кислорода=2,
азота=3,
углерода=4.
Валентность кислорода, как правило, равна 2. Поэтому, зная состав или формулу кислородного соединения того или другого элемента, можно определить его валентность по кислороду.
Например, в соединениях N2O, CO, SiO2, SO3 валентность
азота по кислороду=1,
углерода=2,
кремния=4,
серы=6.
Между валентностью элемента в данном соединении, его атомным весом и эквивалентом существует простое соотношение.
Эквивалент элемента равен атомному весу элемента, деленному на его валентность в данном соединении.
![]()
Например в соединении NaOH
![]()
Эквивалент сложного вещества вычисляют исходя из его молекулярного веса.
Эквивалент кислоты – равен молекулярному весу кислоты, деленному на ее основность. Основностью называется число атомов водорода, способных замещаться на металл с образованием соли.
Например, эквивалент ортофосфорной кислоты H3PO4
![]()
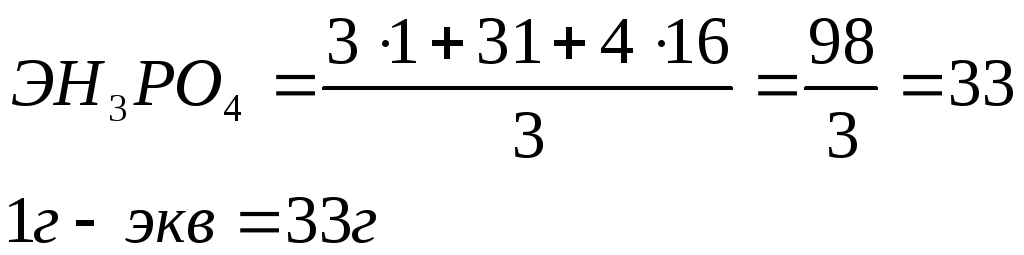
Эквивалент основания(щелочи) равен молекулярному весу основания деленному на валентность металла. (Основания состоят из металла и одновалентных гидроксильных групп).
Например, эквивалент едкого натра NaOH
![]()
1г-экв=40г
Эквивалент соли равен молекулярному весу соли, деленному на произведение валентности металла на число его атомов в молекуле
Например, эквивалент сульфата кальция CaSO4
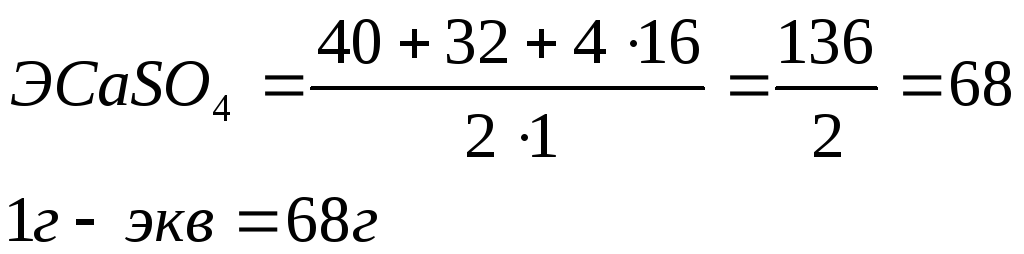
Чтобы произвольно записать формулу сложного вещества необходимо пользоваться правилом. Произведение валентности на число атомов одного элемента = произведению валентности на число атомов другого элемента.
Al2O3
Кислород двухвалентен, 2х3=6.
Алюминий трехвалентен, 3х2=6
Валентность кислотного остатка = количеству атомов водорода кислоты
H2SO4: валентность водорода=1, валентность SO4 =2
Следовательно, в соединении CaSO4 валентность SO4 =2, тогда валентность кальция =2.
