
3 КУРС (БИОХИМИЯ ЭНЕРГИЯ) / Коллоквиум по биохимии (углеводы)
.docВопросы к коллоквиуму по биохимии и молекулярной биологии
(Тема 1. Химия и обмен углеводов)
-
Понятие метаболизма.
Метаболизм – совокупность ферментативных реакций в живых клетках.
Он выполняет четыре специфические функции:
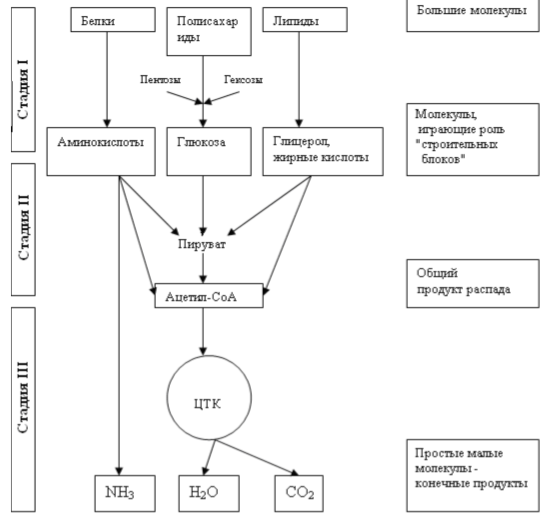
1) снабжение организма энергией, которая добывается путем расщепления богатой энергией пищей, поступающих из среды, или путем преобразования улавливаемой энергии солнечного света;
2) превращение молекул пищевых веществ в строительные блоки, которые в дальнейшем используются клеткой для построения макромолекул;
3) сборка белков, нуклеиновых кислот, липидов, полисахаридов и прочих клеточных компонентов из этих строительных блоков;
4) синтез и разрушение тех биомолекул, которые необходимы для выполнения каких-либо специфических функций.
-
Катаболические, анаболические, амфиболические пути.
Промежуточный метаболизм складывается из двух фаз: катаболизма и анаболизма.
Катаболизм – это фаза, на которой происходит расщепление сложных органических молекул до более простых конечных продуктов. Углеводы, жиры и белки, поступившие извне с пищей или присутствующие в самой клетке в качестве запасных веществ, распадаются в серии последовательных реакций до таких соединений, как молочная кислота, СО2 и аммиак. Катаболические процессы сопровождаются высвобождением свободной энергии, заключенной в сложной структуре больших органических молекул.
Анаболизм, называемый также биосинтезом, – та фаза метаболизма, в которой из малых молекул-предшественников, или «строительных блоков», синтезируются белки, нуклеиновые кислоты и другие макромолекулярные компоненты клеток. Поскольку биосинтез – процесс, в результате которого увеличиваются размеры молекул и усложняется их структура, он требует затраты свободной энергии

В амфиболических процессах, выполняются одновременно биосинтетические и биодеградативные функции, т.е по сути процессы катаболизма и анаболизма происходят почти одновременно.
-
Центральные и специальные метаболические пути.
Выделяют внешний и промежуточный обмен веществ:
Внешний обмен веществ – внеклеточное переваривание веществ на пути их поступления и выделения из организма.
Промежуточный обмен веществ превращение веществ внутри клеток с момента их поступления до образования конечных продуктов. Попав внутрь клетки, питательное вещество метаболизируется, т.е. претерпевает ряд химических изменений, катализируемых ферментами. Определённая последовательность таких химических изменений называется метаболическим путём, а образующиеся промежуточные продукты – метаболитами. Большей частью метаболические пути линейны
Все метаболические пути делят на центральные и специальные (вторичные).
Центральные метаболические пути – пути превращения основных пищевых веществ в клетке (углеводов, жиров, белков и нуклеиновых кислот). На этих путях потоки метаболитов довольно внушительны. Например, в организме взрослого человека ежесуточно окисляется несколько сотен граммов глюкозы до СО2 и воды. Последовательности химических превращений на каждом из центральных метаболических путей, в принципе, у всех живых форм едины. Так, например, расщепление D-глюкозы протекает почти у всех живых организмов одинаково, т. е. через те же реакции и с образованием одних и тех же промежуточных продуктов.
Кроме центральных путей есть и другие метаболические пути со значительно меньшим потоком метаболитов (ежесуточный синтез или распад при этом измеряется миллиграммами).
Эти специальные метаболические пути составляют так называемый вторичный метаболизм, роль которого – в образовании различных специализированных веществ, требующихся клеткам в малых количествах. К вторичным метаболическим путям принадлежит, например, биосинтез коферментов и гормонов, потому что эти соединения вырабатываются и используются только в следовых количествах. Сотни различных высокоспециализированных биомолекул, в том числе нуклеотиды, пигменты, токсины, антибиотики и алкалоиды, продуцируются у разных форм жизни на вторичных метаболических путях.
-
Катаболизм углеводов.
Метаболизм (обмен) углеводов в организме человека состоит в основном из следующих процессов:
1. Расщепление в пищеварительном тракте поступающих полисахаридов и дисахаридов до моносахаридов. Всасывание моносахаридов из кишечника в кровь;
2. Синтез и распад гликогена в тканях, прежде всего в печени;
3. Гликолиз, т.е. расщепление глюкозы.В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата, фруктозобисфосфата и пирувата как в отсутствие, так и в присутствии кислорода. В последнем случае употребляют термин «аэробный гликолиз» в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты (лактата).
4. Аэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь (пентозный цикл).
5. Взаимопревращение гексоз.
6. Аэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как его завершающая стадия: окисление продукта гликолиза – пирувата.
7. Наконец, важным является процесс глюконеогенеза, или образование углеводов из неуглеводных продуктов. Такими продуктами являются в первую очередь пировиноградная и молочная кислоты, глицерин, аминокислоты и ряд других соединений.
-
Расщепление углеводов в пищеварительном тракте.
Кишечник способен всасывать только моносахариды, поэтому процесс переваривания глюкозы заключается в ферментативном шидролизе гликозидных связей в углеводах, имеющих олиго- или полисахаридное строение.
Переваривание глюкозы в ротовой полости:
В ротовой полости пища измельчается при пережёвывании, смачиваясь при этом слюной. Слюна на 99% состоит из воды и обычно имеет значение рН, равное 6,8. В слюне присутствует гидролитический фермент α-амилаза (α-l,4-гликозидаза), расщепляющая в крахмале α-l,4-гликозидные связи. В ротовой полости крахмал не расщепляется полностью, т. к. действие фермента на него кратковременно. Кроме того, амилаза слюны не расщепляет α-l,6гликозидные связи (связи в местах разветвлений); поэтому крахмал переваривается лишь частично с образованием крупных фрагментов (декстринов) и небольшого количества мальтозы. Следует отметить, что амилаза слюны не гидролизует гликозидные связи в дисахаридах. Действие амилазы слюны прекращается в резко кислой среде содержимого желудка (рН 1,5 – 2,5). Однако внутри пищевого комка активность амилазы может некоторое время сохраняться, пока уровень рН не изменится в кислую сторону.
Желудочный сок не содержит ферментов, расщепляющих углеводы. В желудочном содержимом возможен лишь незначительный кислотный гидролиз гликозидных связей
Переваривание углеводов в кишечнике:
Последующие этапы переваривания нерасщеплённого или частично расщеплённого крахмала, а также других углеводов пищи происходит в тонком кишечнике, в разных его отделах, под действием гидролитических ферментов гликозидаз.
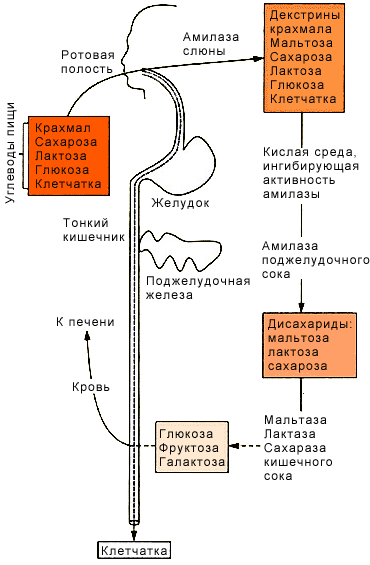
Рис. Переваривание глюкозы в пищеварительном тракте человека.
-
Амилолитические ферменты, характеристика.
В двенадцатиперстной кишке рН среды желудочноro содержимого нейтрализуется, т. к. секрет поджелудочной железы имеет рН – 7,5-8,0 и содержит бикарбонаты (НСО3¯). С секретом поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент гидролизует α-l,4гликозидные связи в крахмале и декстринах.
α-Амилаза поджелудочной железы (так же, как и α-амилаза слюны) действует как эндогликозидаза. Панкреатическая α-амилаза не расщепляет αl,6-гликозидные связи в крахмале. Этот фермент также не гидролизует β-1,4гликозидные связи, которыми соединены остатки глюкозы в молекуле целлюлозы. Целлюлоза не расщепляется, но выполняет важные функции, придавая пище обьём и стимулируя перистальтику кишечника.
Мальтоза, изомальтоза и трисахариды, образующиеся в верхних отделах кишечника из крахмала, – промежуточные продукты. Дальнейшее их переваривание происходит в тонком кишечнике под действием специфических ферментов. Сахароза и лактоза также гидролизуются специфическими дисахаридазами.
-
Всасывание моносахаридов в тонком кишечнике и их дальнейший транспорт.
Моносахариды, образовавшиеся в результате переваривания, всасываются эпителиальными клетками тощей и подвздошной кишок с помощью специальных механизмов транспорта через мембраны этих клеток.
Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться разными способами: путём облегчённой диффузии и активного транспорта. В случае активного транспорта глюкоза и Na+ проходят через мембраны с люминальной стороны, связываясь с разными участками белка-переносчика. При этом Na+ поступает в клетку по градиенту концентрации и одновременно глюкоза транспортируется против градиента концентрации (вторично-активный транспорт). Следовательно, чем больше градиент Na+, тем больше поступление глюкозы в энтероциты. Если концентрация Na+ во внеклеточной жидкости уменьшается, транспортирование глюкозы снижается. Градиент концентрации Na+, являющийся движущей силой активного симпорта, создаётся работой Na+,K+-АТPазы. Перенос в клетки слизистой оболочки кишечника по механизму вторично-активного транспорта характерен также для галактозы.
-
Глюкозные транспортеры.
При разной концентрации глюкозы в просвете кишечника «работают» различные механизмы транспорта. Благодаря активному транспорту эпителиальныe клетки кишечника могут поглощать глюкозу при её очень низкой концентрации в просвете кишечника. Если же концентрация глюкозы в просвете кишечника велика, то она может транспортироваться в клетку путём облегченной диффузии. Таким же способом может всасываться и фруктоза. Следует отметить, что скорость всасывания глюкозы и галактозы гораздо выше, чем других моносахаридов.
На рис. 16.12 показано всасывание моносахаридов из кишечника путём облегчённой диффузии с помощью специaльных белков-переносчиков (транспортёров). Кроме того, мы видим, что глюкоза и галактоза транспортируются в энтероцит пyтём вторично-активного транспорта, зависящего от градиента концентрации ионов натрия. Белки-транспортёры, зависимые от гpaдиента Na+, обеспечивают всасывание глюкозы из просвета кишечника в энтероцит против градиента концентрации. Концентрация Na+, необходимая для этого, обеспечивается Na+,K+-АТPазой, которая работает как насос, откачивая из клетки Na+ в обмен на К+. В отличие от глюкозы, фруктоза транспортируется системой, не зависящей от градиента натрия.
После всасывания моносахариды (главным образом, глюкоза) покидают клетки слизистой оболочки кишечника через мембрану, обращённую к кровеносному капилляру, с помощью облегченной диффузии. Часть глюкозы (более половины) через капилляры кишечных ворсинок попадает в кровеносную систему и по воротной вене доставляется в печень. Остальное количество глюкозы поступает в клетки других тканей.
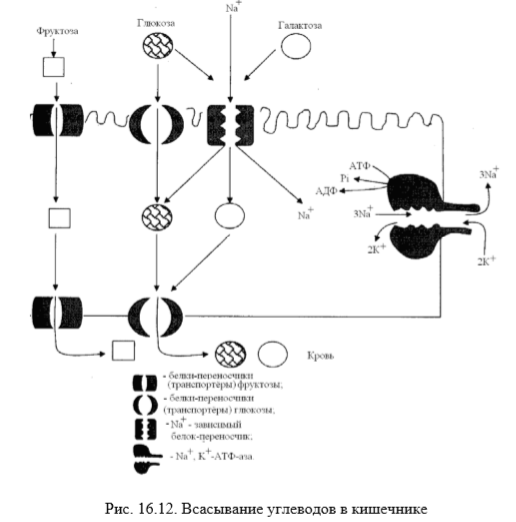
Транспорт глюкозы из крови в клетки:
Потребление глюкозы клетками из кровотока происходит также путём облегчённой диффузии. Следовательно, скорость трансмембранного потока глюкозы зависит только от градиента её концентрации. Исключение составляют клетки мышц и жировой ткани, где облегчённая диффузия регулируется инсулином (гормон поджелудочной железы). В отсутствие инсулина плазматическая мембрана этих клеток непроницаема для глюкозы, т. к. она не содержит белков-переносчиков (транспортёров) глюкозы. Транспортёры глюкозы называют также рецепторами глюкозы. Например, описан транспортёр глюкозы, выделенный из эритроцитов. Это трансмембранный белок, полипептидная цепь которого построена из 492 аминокислотных остатков и имеет доменную структуру. Полярные домены белка расположены по разные стороны от мембраны, гидрофобные располагаются в мембране, пересекая её несколько раз. Транспортёр имеет участок связывания глюкозы на внешней стороне мембраны. После присоединения глюкозы конформация белка изменяется, в результате чего глюкоза оказывается связанной с белком в участке, обращённом внутрь клетки. Затем глюкоза отделяется от транспортёра, переходя внутрь клетки. Считают, что способ облегчённой диффузии по сравнению с активным транспортом предотвращает транспорт ионов вместе с глюкозой, если она транспортируется по градиенту концентрации. Глюкозные транспоpтёры (ГЛЮТ) обнаружены во всех тканях. Существует несколько их разновидностей.

Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ, к плазматической мембране, слиянию с ней и встраиванию транспортёров в мембрану. После чего возможен облегчённый транспорт глюкозы в эти клетки. После снижения концентрации инсулина в крови транспортёры глюкозы снова перемещаются в цитоплазму и поступление глюкозы в клетку прекращается.
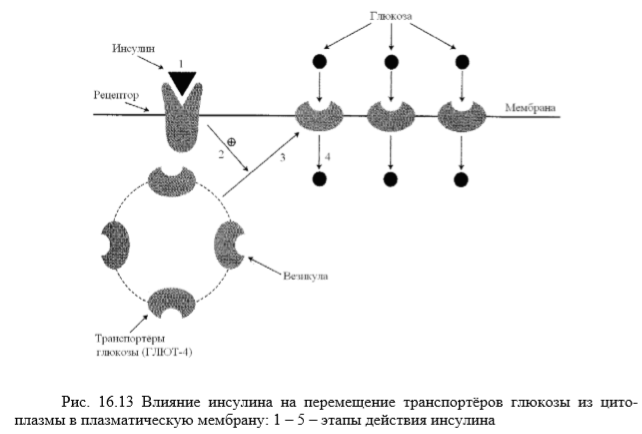
видно, что на первом этапе происходит связывание инсулина с рецептором; на втором участок инсулинового рецептора, обращённый внутрь клетки, стимулирует перемещение транспортёров глюкозы. На третьем и четвёртом транспортёры в составе содержащих их везикул перемещаются к плазматической мембране клетки, включаются в её состав и переносят глюкозу в клетку. Перемещение глюкозы из первичной мочи в клетки почечных канальцев происходит путём вторично-акгивного транспорта, подобно тому, как это осуществляется при всасывании глюкозы из просвета кишечника в энтероциты. Благодаря этому глюкоза может поступать в клетки даже в том случае, если её концентрация в первичной моче меньше, чем в клетках. При этом глюкоза реабсорбируется из первичной мочи почти полностью (99%).
Известны различные нарушения в работе транспортёров глюкозы. Наследственный дефект этих белков может лежать в основе инсулиннезависимого сахарного диабета. В то же время причиной нарушения работы транспортёра глюкозы может быть не только дефект самого белка. Нарушения функции ГЛЮТ-4 возможны на следующих этапах: - передача сигнала инсулина о перемещении этого транспортёра к мембране; - перемещение транспортёра в цитоплазме; - включение в состав мембраны; - отшнуровывание от мембраны и т.д.
-
Анаэробное расщепление глюкозы.
Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется ATP. Суммарное уравнение гликолиза можно представить следующим образом:

В анаэробных условиях гликолиз – единственный процесс в животном организме, поставляющий энергию. Именно благодаря ему организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода.
-
Гликолиз. Внутриклеточная локализация процесса.
Гликолиз (от гр. glycys – сладкий + lysis – растворение, распад) – это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием ATP.
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как, например, в активно сокращающейся мышце, пируват превращается в лактат. Таким образом, гликолиз – это не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если последний доступен (аэробные условия), но может протекать и в его отсутствие (анаэробные условия). Кроме того, на промежуточных стадиях образуются трехуглеродные фрагменты, которые используются для биосинтеза ряда веществ.
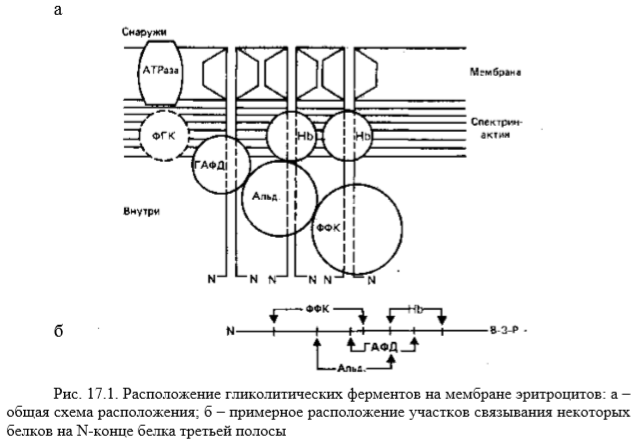
Внутриклеточно гликолиз локализуется в цитоплазматическом компартменте. При этом установлено, что гликолитические ферменты способны связываться с мышечными белками. На долю F-актина приходится больше связанных ферментов гликолиза, чем на долю миозина, актомиозина или белков стромы. Из ферментов наибольшим сродством к F-актину обладает альдолаза и несколько меньшим – глицеральдегид-3-фосфатдегидрогеназа (ГАФДГ). Среди других ферментов, проявляющих определенную склонность к связыванию, необходимо отметить фосфофруктокиназу (ФФК), 3фосфоглицераткиназу, пируваткиназу (ПК) и лактатдегидрогеназу (ЛДГ). Предполагаемая схема расположения гликолитических ферментов на мембране эритроцитов представлена на рис. 17.1.
-
Отдельные реакции гликолиза, их характеристики.
Процесс
гликолиза катализируется одиннадцатью
ферментами, большинство из которых
выделено в гомогенном, кристаллическом
или высокоочищенном виде и свойства
которых достаточно известны. Первой
ферментативной реакцией
гликолиза является фосфорилирование,
т.е. перенос остатка ортофосфата на
глюкозу за счет ATP. Реакция катализируется
ферментом гексокиназой:
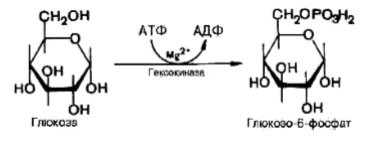
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом. Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, который служит одновременно и продуктом реакции, и аллостерическим ингибитором. Второй реакцией гликолиза является превращение глюкозо-6-фосфата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6фосфат:
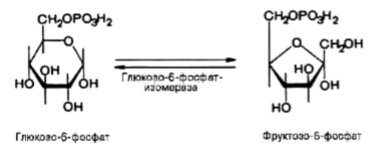
Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы ATP:
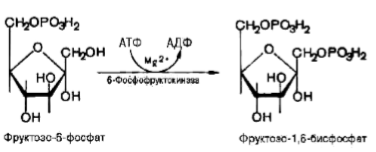
Аналогично гексокиназной данная реакция практически необратима, протекает в присутствии ионов магния и является самой медленной реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под его влиянием фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
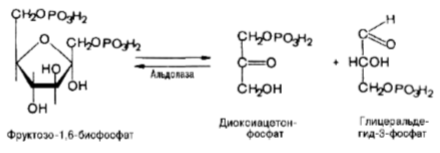
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидроксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция – это реакция изомеризации триозофосфатов. Она катализируется ферментом триозофосфатизомеразой:
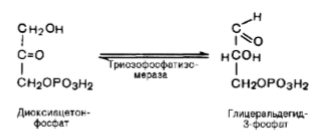
Равновесие данной изомеразной реакции сдвинуто в сторону дигидроксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глицеральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого в ходе дальнейших превращений альдегидной формы фосфотриозы дигидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата завершается первая стадия гликолиза.
-
Окисление D-глицеральдегид-3-фосфата, сопряжённое с фосфорилированием карбокcильной группы.
Вторая стадия гликолиза наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакцию гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется ATP.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента NAD+ и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы NAD (NADH).
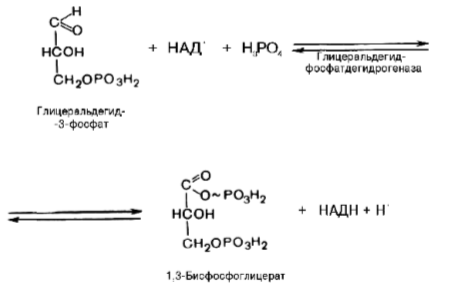
1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата NAD+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования NADH глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочна и поэтому расщепляется под влиянием неорганического фосфата; при этом образуется 1,3-бисфосфоглицериновая кислота.
-
Ресинтез АТP в реакциях, катализируемых фосфоглицераткиназой и пируваткиназой (субстратное фосфорилирование).
Седьмая реакция катализируется фосфоглицераткиназой; при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на ADP с образованием ATP и 3-фосфоглицериновой кислоты (3-фосфоглицерат):

Таким образом, благодаря действию двух ферментов (глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии ATP. В отличие от окислительного фосфорилирования образование ATP из высокоэнергетических соединений называется субстратным фосфорилированием.
Важной отличительной особенностью гликолиза в эритроцитах является то, что 1,3-бифосфоглицерат может превращаться в 2,3-бифосфоглицерат, который является аллостерическим эффектором, понижающим сродство гемоглобина к кислороду.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
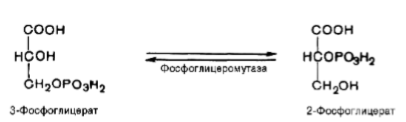
Реакция легкообратима, протекает в присутствии ионов Mg2+. Кофактором фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат.
Девятая реакция катализируется ферментом енолазой, при этом 2фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической.
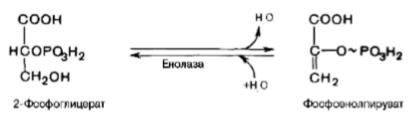
Енолаза активируется двухвалентными катионами Mg2+ или Мn2+ и ингибируется фторидом.
Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на ADP (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:

Для действия пируваткиназы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки реакция является практически необратимой.
В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образование молочной кислоты. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента NADН, образовавшегося в шестой реакции:

Реакцией восстановления пирувата полностью завершается внутренний окислительно-восстановительный цикл гликолиза. NAD+ при этом играет роль промежуточного переносчика водорода от глицеральдегид-3-фосфата (6-я реакция) на пировиноградную кислоту (11-я реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитической оксидоредукции.
-
Энергетический баланс анаэробного гликолиза.
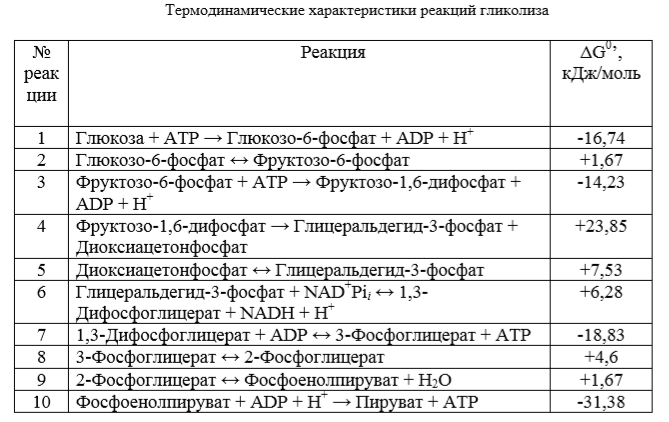
Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачивается две молекулы ATP (гексокиназная и фосфофруктокиназная реакции). На последующих образуются четыре молекулы ATP (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет две молекулы ATP на одну молекулу глюкозы.
-
Регуляция гликолиза на уровне гексокиназы, фосфофруктокиназы пируваткиназы.
Рассмотрено выше.
-
Регенерация NAD+, роль лактатдегидрогеназы в этом процессе.

-
Образование 2,3-бисфосфоглицерата в шунте Рапопорта-Люберинга. Спиртовое брожение.
См.выше.+
Спиртовое и молочнокислое брожение – основные источники обеспечения энергией некоторых микроорганизмов в анаэробных условиях. Спиртовое брожение осуществляется так называемыми дрожжеподобными организмами, а также некоторыми плесневыми грибками. Суммарную реакцию спиртового брожения можно изобразить следующим образом:

Механизм процесса спиртового брожения чрезвычайно близок к гликолизу. Расхождение начинается лишь после этапа образования пирувата. При гликолизе пируват при участии фермента ЛДГ и кофермента NADH восстанавливается в лактат. При спиртовом брожении этот конечный этап заменен двумя другими ферментативными реакциями: пируватдекарбоксилазной и алкогольдегидрогеназной.
В дрожжевых клетках (спиртовое брожение) пируват вначале подвергается декарбоксилированию, в результате чего образуется ацетальдегид. Данная необратимая реакция катализируется ферментом пируватдекарбоксилазой, который требует наличия ионов Mg2+ и кофермента (TРP):

Образовавшийся ацетальдегид присоединяет к себе водород, отщепляемый от NADH, восстанавливаясь при этом в этанол. Реакция катализируется ферментом алкогольдегидрогеназой:
