- •Строение белка. Уровни структурной организации молекулы белка.
- •Строение, размер и форма белковой молекулы, функции белков.
- •Денатурация, причины и признаки, использование в медицине.
- •Ферменты. Особенности ферментативного катализа. Строение и структура ферментов.
- •Полиферментные комплексы, метаболоны.
- •Механизм действия ферментов. Этапы ферментативного катализа.
- •Факторы, определяющие активность ферментов [e], [s], [p], Km. Влияние pH, [p], tº, ионной силы на активность ферментов.
- •Изостерическая и аллостерическая регуляция.
- •Николаев а. Я. Биологическая химия. М.: Высшая школа, 1989. С. 52–92.
- •Марри р. И др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 63–75.
- •Филиппович ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 105–144.
- •1. Мультимедийная презентация.
- •Механизмы и роль аллостерической регуляции. Характеристика аллостерических ферментов. Виды ингибирования (обратимое, необратимое, конкурентное, неконкурентное, бесконкурентное).
- •Изоферменты, их природа, биологическая роль, строение лдг.
- •Изменение активности ферментов в онтогенезе.
- •Николаев а. Я. Биологическая химия. М.: Высшая школа, 1989. С. 52–92.
- •Марри р. И др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 63–75.
- •Филиппович ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 105–144.
- •1. Мультимедийная презентация.
- •Локализация ферментов в клетке, органоспецифические и маркерные ферменты.
- •Качественное обнаружение и количественное определение активности. Единицы активности (мe, катал). Удельная активность. Число оборотов ферментов.
- •Сопряженные ферментные системы их применение. Номенклатура, классификация ферментов (тривиальная, рациональная, систематическая). Принципы классификации.
- •Медицинская энзимология. Основные направления Применение ферментов в лабораторной диагностике, производственной практике и биотехнологии.
- •Энзимопатии. Патогенез энзимопатий. Энзимодиагностика, цель, задачи. Типы ферментов плазмы крови.
- •Энзимотерапия. Примеры. Иммобилизованные ферменты, липосомы, тени эритроцитов, вирусные векторы. Биотехнология.
- •История развития учения о биологическом окислении
- •Современные представления о бо. Основные этапы бо. Строение атф, природа макроэргичности.
- •Митохондрия. Строение, функции, сравнительная характеристика мембран митохондрий. Характеристика ферментов мембран, межмембранного пространства, мx матрикса.
- •Цтк, история открытия, реакции, ферменты, коферменты, субстраты. Биологическая роль, регуляция цтк. Метаболоны цтк.
- •1. Энергетическая функция.
- •2. Пластическая функция.
- •3. Регуляторная.
- •Строение дыхательной цепи (дц), комплексы, ингибиторы. Механизм работы. Пункты сопряжения, величина овп компонентов дц. Коэффициент р/о, его значение.
- •Свободное и разобщенное дыхание. Теории сопряжения оф.
- •Структура и функция протонной атф-азы. Механизм разобщения.
- •Оф (снятие pH и ). Механизмы термогенеза. Роль бурой жировой ткани.
- •Пути потребления o2 в организме. Характеристика микросомальной дц, ее сравнение с митохондриальной. Характеристика цитохромов p450, их функция.
- •1. Сходства: а) они имеют одинаковые начало и конец и одинаковую суммарную разность потенциалов (а значит одинаковый градиент энергии в начале и конце);
- •2. Различия: а) по локализации;
- •Антиоксидантная защита: ферментная и неферментная.
- •1. Мультимедийная презентация.
- •1. Мультимедийная презентация.
Министерство здравоохранения Республики Беларусь
УО «Гомельский государственный медицинский университет»
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № _________________200__года
ЛЕКЦИЯ по биологической химии
наименование дисциплины
для студентов _2__ курса лечебного факультета
Тема Предмет и задачи биохимии Краткая история биохимии.
Время 90 мин.
Учебные и воспитательные цели:
Дать представление:
-
Об истории биохимии.
-
О строении и классификации аминокислот.
-
О строении белка и уровнях структурной организации молекулы белка.
ЛИТЕРАТУРА
-
Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 16–64; 1998. С. 19–77.
-
Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 5–53.
Дополнительная
-
Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 13–50.
-
Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 13–92.
-
Ленинджер А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 107–225.
-
Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия. М.: Медицина, 1991. С. 313–376.
-
Албертс Б. и др. Молекулярная биология клетки, М.: Мир, 1994. Т. 1. С. 113–171.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1. Мультимедийная презентация.
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
|
№ п/п |
Перечень учебных вопросов |
Количество выделяемого времени в минутах |
|
|
История биохимии. |
20 |
|
|
Строение и классификация аминокислот. |
30 |
|
|
Строение белка. Уровни структурной организации молекулы белка. |
40 |
Всего 90 мин
Введение, краткая история биохимии.
Биохимия - это наука, изучающая качественный и количественный состав, а также пути, способы, закономерности, биологическую и физиологическую роль превращения вещества, энергии и информации в живом организме.
Формирование биологической химии как самостоятельной дисциплины в системе биологических наук было длительным и сложным процессом. Современная биохимия сформировалась на рубеже ХIХ и ХХ вв. в недрах органической химии и физиологии, поэтому в ХIХ в. она называлась физиологической химией. Термин биохимия был предложен в 1858 году австрийским врачом и химиком Винцентом Клетцинским.
История биохимии отражает сложный путь познания человеком окружающего органического мира, истоки которого уходят во времена античности. В те времена гениальные пророческие идеи причудливо переплетались с наивными представлениям об окружающем мире. Так, например, Аристотель полагал, что живые существа образуются из сочетания пассивного, не имеющей жизни, начала - «материи» с активным началом - «формой», которая формирует тело и поддерживает в нем жизнь.
В последующем неоплатоники развивая эти идеи сформулировали понятие о «жизненной силе», «животворящем духе» и т.д., которые в различных модификациях существовали и в средние века. В VII – X веках в Европе с развитием алхимии стал накапливаться материал о составе сложных органических соединений.
Эпоха Возрождения характеризуется динамическим восприятием окружающего мира, которое превратило науку из ритуально-магической в открытую. Наука рассматривала человеческое тело как сложную механическую машину. Наш выдающийся современник, английский философ и историк науки Дж. Бернал так характеризует ту эпоху: «... врачи свободно общались с мастерами-художниками, математиками, астрономами и инженерами. По сути дела, многие из них занимались некоторыми из этих профессий. Так, например, Коперник получил образование и практиковал как врач...».
Именно это привело науку к новой ступени - живое стали оценивать химическими категориями. В XVI - XVII веках получила развитие ятрохимия (врачебная химия), важнейшим представителем которой был Парацельс (1493-1541), считавший, что в основе всех заболеваний лежат нарушения хода химических процессов в организме, поэтому лечить их надо тоже химическими веществами. Ятрохимия много дала практической медицине и способствовала ее сближению с химией.
Середина ХVII - конец ХVIII вв является эмпирическим периодом развития органической химии которая по определению великого шведского химика Й. Берцелиуса была химией «растительных и животных веществ». За это время произошло накопление огромного фактического материала, но еще не возникло теоретических, обобщающих представлений. Практические потребности человеческой деятельности (получение из природного сырья лекарств, масел, смол, красителей и т.д.) явились основной причиной, побуждающей к изучению органических соединений.
Совершенствование экспериментальных методов способствовало выделению индивидуальных органических соединений из растений (щавелевая, яблочная, лимонная и др. кислоты) и продуктов жизнедеятельности животных организмов (мочевина, мочевая и гиппуровая кислоты).
Следующий период - аналитический (конец ХVIII - середина ХIХ вв. - ознаменован исследованиями по установлению состава веществ, в результате которых стало очевидно, что все органические соединения содержат углерод. Вот лишь некоторые достижения этого периода:
В 1828 г. Ф. Вёлер впервые синтезировал мочевину, открыв тем самым эпоху органического синтеза.
В 1839 г Ю. Либих установил, что в состав пищи входят белки, жиры и углеводы.
В 1845 г. Г. Кольбе синтезировал уксусную кислоту
В 1854 г М. Бертло синтезировал жиры.
В 1861 г А.М. Бутлеров синтезировал углеводы.
Подводя итоги развития биохимии в ХIХ в. отметим, что основными факторами ее формирования было развитие химии важнейших природных соединений - липидов, углеводов и особенно белков, первые успехи энзимологии, разработка основных положений о многоступенчатости обмена веществ и роли ферментов в этих процессах. Биологическая химия того времени ставила своей главной целью изучение методами химии не суммарных процессов обмена веществ, а превращение в организме каждого отдельного соединения и разработка представлений о всех деталях обменных процессов в совокупности.
Наиболее интенсивно биохимия стала развивать в ХХ веке и особенно в последние десятилетия. В первой половине ХХ в. были сделаны важнейшие открытия, которые позволили построить общую схему обмена веществ, установить природу ферментов и исследовать их важнейшие свойства, значительно расширить знания об основных биологически активных соединениях. В 40-50-е годы интенсивно развивались и усовершенствовались методы биохимических исследований определившие в последующие десятилетия формирование отдельных направлений биохимии ставших самостоятельными науками - биоорганической химии, молекулярной биологии, молекулярной генетики, биотехнологии и др.
В последующем, при рассмотрении отдельных разделов биохимии, мы будем касаться их исторических аспектов, сейчас же кратко рассмотрим основные исторические этапы развития отечественной биологической химии.
История развития отечественной биохимии.
Наши соотечественники внесли большой вклад в развитие биохимии. Так, первый в России учебник физиологической химии издан еще в 1847 г. А.И. Ходневым.
Основоположником отечественной биохимии является профессор Александр Яковлевич Данилевский (1839-1923), который в 1863 г. создал первую кафедру биохимии в Казанском университете, создал первую русскую школу биохимиков. Занимаясь исследованием белков, он впервые постулировал идею пептидной связи в белке, высказал идеи об обратимости действия ферментов, на основе чего впервые осуществил синтез белковоподобных веществ - пластеидов, разработал методы очистки ферментов путем адсорбции с последующей элюцией и т.д.
В 1891 г. М.В. Ненцким (1847-1901) организована первая биохимическая лаборатория в Институте экспериментальной медицины в Петербурге, в которой проводились работы по изучению механизма синтеза мочевины, химического состава гемина и хлорофилла, исследованию обмена белков.
К числу наиболее значимых достижений отечественной биохимии следует отнести открытие в 1880 г. Н.И. Луниным витаминов, создание А.Н. Бахом в 1896 г. теории биологического окисления (активирования кислорода), открытие в 1899г. И.П. Павловым и Н.П. Шеповальниковым проферментов, разработка метода хроматографии М.С. Цветом в 1903 г., создание В.И. Палладиным в 1912 г. теории биологического окисления (активирования водорода) и др.
Советский этап развития биохимии связан с именем Алексея Николаевича Баха (1859-1946), который организовал в 1921 г. в Москве Научно-исследовательский биохимический институт Наркомздрава, а в 1935 г. он возглавил переведенный из Ленинграда в Москву Институт биохимии АН СССР, названный впоследствии его именем. На протяжении многих лет Институт биохимии АН СССР им. А.Н. Баха возглавлял акад. А.И. Опарин - автор первой теории происхождения жизни на Земле. На базе этого института в 1959 г. создан Институт молекулярной биологии АН СССР получивший впоследствии имя его основателя - акад. В.А. Энгельгардта - автора классических работ по окислительному фосфорилированию, механохимии мышц, углеводному обмену и др.
Отечественная наука по праву гордится пионерскими работами акад. Ю.А. Овчинникова в области мембранной биологии, акад. А.С. Спирина по молекулярным механизмам биосинтеза белка, акад. В.П. Скулачева по биоэнергетике.
Широко за рубежами нашего отечества известны работы по биохимии витаминов белорусской школы биохимиков, возглавляемой акад. Ю.М. Островским. Большим авторитетом в стране и за рубежом пользуются работы украинских биохимиков в области нейрохимии и биохимии витаминов (акад. А.В. Палладин), биохимии белкового, липидного обмена, возрастной биохимии.
Предмет и задачи биохимии. Методы биохимических исследований.
Биологическая химия решает большое число задач. Поскольку в основе жизнедеятельности здорового организма лежит сложнейшая совокупность биохимических реакций, то при патологии нормальное течение биохимических реакций, как правило, нарушается. В связи с чем возникает необходимость исследовать состояние обмена веществ не только в норме, но и при патологии.
Задача врача заключается в том, чтобы предотвратить развитие патологического процесса в организме и ее решение возможно лишь при своевременной и правильной диагностике, назначении адекватного лечения, которое возможно лишь в том случае, если врач понимает сущность происходящего в организме. При назначении в процессе лечения различных медикаментов, которые включаются в метаболические процессы, необходимо четко представлять механизм их действия и предвидеть возможные последствия этого лечения.
1. Познание молекулярных механизмов физиологических, генетических и иммунологических процессов жизнедеятельности в норме и при патологии и действии на организм различных факторов.
2. Совершенствование методов профилактики, диагностики и лечения заболеваний.
3. Разработка новых лекарственных средств, нормализующих обменные процессы.
4. Разработка научных основ, рационального, сбалансированного питания, здорового образа жизни.
5. Разработка научных основ Исторически сложились три направления биохимии:
1. Статическая биохимия - исследует качественные и количественный химический состав живых организмов.
2. Динамическая биохимия - изучает совокупность превращений веществ, энергии и информации в живом организме.
3. Функциональная биохимия - изучает химическую основу функций тканей, органов, систем органов и межорганных взаимоотношений.
Совершенно очевидно, что это деление весьма условно, поскольку все эти направления взаимно проникают друг в друга и лишь в совокупности они дают возможность приблизиться к пониманию сущности живого организма.
В зависимости от объекта исследования или направления исследования биохимию подразделяют на такие разделы как:
- общая биохимия которая изучает общие вопросы химических основ жизнедеятельности различных организмов
- бионеорганическая химия изучающая роль и значение в процессе жизнедеятельности комплексов неорганических ионов с органическими соединениями
- биоорганическая химия исследующая физико-химические основы функционирования живых систем
- биохимия человека и животных, (растений, микроорганизмов)
- техническая биохимия, изучающая состав пищевых продуктов, химическую основу технологических процессов их хранения, переработки и т.д.
- сравнительная (эволюционная) биохимия которая исследует биохимические процессы в сравнительном (эволюционном) аспекте
- радиационная биохимия изучает биохимические основы радиационного повреждения и способы его профилактики в живой организме
- медицинская (клиническая) биохимия исследует биохимические основы патологических процессов.
В недрах биохимии на стыке биологии, медицины, химии, физики, математики, кибернетики сформировалась новая наука - физико-химическая биология, объединяющая цели и задачи всех вышеназванных направлений биохимии.
Основные методические подходы к изучению метаболизма
|
Метод |
Характеристика (пример) |
|
Исследование на уровне целого организма |
1. удаление органа (гепатэктомия) 2. изменение диеты (голодание, усиленное питание) 3. прием лекарств 4. введение токсинов 5. наблюдение за животными со специфическими заболеваниями (сахарный диабет) 6. использование сложным методов (ЯМР-спектроскопия и др.) |
|
Перфузия изолированных органов |
наиболее пригодны сердце, печень, почки |
|
Инкубация тканевых срезов |
чаще используются срезы печени |
|
Инкубация целых клеток |
наиболее пригодны клетки крови и печени |
|
Изучение гомогенатов |
1. работа с бесклеточными препаратами 2. можно удалять или добавлять различные вещества и наблюдать за результатами 3. можно фракционировать различные органеллы путем дифференциального центрифугирования |
|
Исследование изолированных органелл |
широко используются митохондрии, микросомы, рибосомы и др. |
|
Субфракционирование изолированных органелл |
например митохондрий для выделение комплексов дыхательной цепи |
|
Выделение и характеристика ферментов и метаболитов |
обязательно при описании любой химической реакции и метаболического пути |
|
Клонирование генов, кодирующих ферменты и др. белков |
исследование особенностей структуры и регуляции гена и первичной структуры белка, кодируемой этим геном |
Строение белка. Уровни структурной организации молекулы белка.
Белки – высокомолекулярные соединения (ВМС), полипептиды, образованные путем сополимеризации 20 протеиногенных аминокислот (АК).
Белок - основа жизни, главная молекула жизни. Если ДНК является своеобразным информационным чертежом (програмным обеспечением) организма, то белок - это и материал и средство (аппаратное обеспечение), при помощи которого по этому чертежу построен организм. С химической точки зрения белки являются самыми сложными из известных молекул. С современных позиций белок представляет собой машину - жесткий автомат, являющийся пределом делимости живого.

На пути дезинтеграции организма: белок является последней стадией, при которой еще сохраняются свойства живого, т.к. потеря его структурной организации (денатурация) сопровождается исчезновением всех признаков жизни.
История химии белка
История химии белка начинается с выделения Якопом Баккари в 1728 году первого препарата белковой природы из пшеничной муки названного им клейковиной. Химия того времени была преимущественно неорганической и биологические вещества редко становились объектом исследования, поэтому лишь к началу ХIХ века расширился список исследуемых белковых веществ.
Термин «белок» как название группы родственных веществ был впервые употреблен Й. Жакеном в 1793 г. С начала ХIХ века исследуются не только общие свойства белков (способность к коагуляции и осаждению (высаливанию), клейкость, эластичностью, вязкость, набухание и др.), но и некоторые химические свойства.
Введение в химическую науку А.Лавуазье количественного метода ускорило исследование элементного состава белка. Первые работы посвященные количественному определению элементного состава растительных и животных белков подтвердили предположение об их химическом единстве, которое было получено ранее на основании описательного изучения этих веществ.
В первой половине ХIХ века были сделаны робкие и малоудачные попытки химического обоснования жизненных процессов и открытое к тому времени явление ферментативного катализа никак не ассоциировалось с функцией белков.
Исследованиями второй половины ХIХ века, на основании экспериментов по гидролитическому, главным образом ферментативному расщеплению, установлено, что белки являются полимерами (Ф. Гоппе-Зайлер, А. Хеннингер, А. Вюрц, Р. Харт). Создание теории химического строения молекул к тому времени определило появление структурных гипотез строения белка (П. Шютценберже, А.Я. Данилевский, А. Коссель), согласно которым роль главным структурным элементом белковой молекулы отводилась АК. Эти работы способствовали открытию ряда новых АК, разработке методов цветных качественных реакций на белки. Кроме того впервые предпринято физиологическое изучение белков, предложены различные схемы расщепления белков в организме под действием пищеварительных ферментов. Рассмотрена роль пепсина и трипсина в переваривании белка.
Блестящие работы М. Бертло и Э. Фишера по синтезу соответственно липидов и углеводов стимулировали исследования в области синтеза белков, однако они не имели успеха, поскольку не было реального представления о химической природе белков.
Более глубокое проникновение в биологию методов химии, физики и физической химии (высаливание, кристаллизация, диализ и др.) в конце ХIХ века, становление современной биофизики, существенно продвинуло исследование белков. Первыми важными достижениями в этой области было определение криоскопическим методов молекулярной массы альбумина яйца (А.П. Сабанеев 1891), методом осмотического давления молекулярной массы гемоглобина (Э.Рейд, 1905). Хотя результаты этих исследований были далеки от истины, тем не менее, они подготовили новый этап в изучении белков, связанный главным образом с именем немецкого ученого Эмиля Фишера (1852 - 1919).
Э. Фишер предложил эвристическую идею, включившую в себя четыре постулата:
1. Белки состоят только из -АК. Из всей массы продуктов расщепления белков аминокислоты являются главными составляющими, а все остальные соединения относятся к вторичным продуктам.
2. АК входящие в состав белков относятся к L ряду.
3. Белковая молекула представляет собой линейный полимер.
4. -АК образуют линейный полимер путем образования пептидной связи между карбоксильной группой одной АК и аминогруппой - другой.
Данные постулаты легли в основу обширной программы исследования, реализация которой привела к синтезу Э. Фишером 125 пептидов, представленных, главным образом, полимерами состоящими из 5- 18 остатков. Эти работы на протяжении двух десятилетий после смерти Э. Фишера никто не мог воспроизвести, а его коллекцию очень долго использовали особенно физики в рентгеноструктурных исследованиях пептидов.
На протяжении более 30 лет теория Фишера подвергалась многократным ревизиям и проверкам, в связи с чем предлагались альтернативные теории основанные на идее циклического строения пептидов.
Представления о полипептидном строении белков прочно утвердилось лишь только к 40-м годам. Этому в немалой степени способствовало развитие химии макромолекул (Г. Штаудингер) и возникновением квантовой механики, обосновавших, казавшихся неверояным возможность образования компактных детерминированных структур из нитевидных полимерных белковых цепей. Эти обстоятельства, а также развитие рентгеноструктурного метода анализа, по существу, подготовили почву для исследования пространственного строения белков.
В 1952 г. К. Линдерштрем-Ланг предложил первую классификацию белков основанную на принципе пространственной организации белковой молекулы. Хотя эта классификация является общепринятой, необходимо отметить, что, по существу, есть два типа структур: линейная и пространственная.
Аминокислоты - главные составные части белков
Физико-химические и биологические свойства белков определяются их аминокислотным составом. Аминокислоты - это аминопроизводные класса карбоновых кислот. Аминокислоты входят не только в состав белков. Многие из них выполняют специальные функции. Поэтому в живых организмах различают аминокислоты протеиногенные (кодируются генетически) и непротеиногенные (не кодируются генетически). Протеиногенных аминокислот 20. 19 из них являются -аминокислотами. Это означает, что аминогруппа у них присоединена к -углеродному атому той карбоновой кислоты, производным которой они являются. Общая формула этих аминокислот выглядит следующим образом:
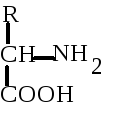
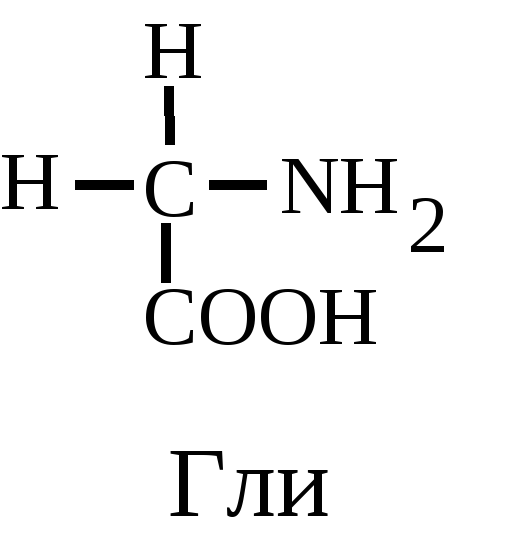
Только одна аминокислота - пролин не соответствует этой общей формуле. Ее относят к иминокислотам.
-углеродный атом аминокислот является ассимметричным (исключение составляет аминопроизводное уксусной килоты - глицин). Это означает, что у каждой аминокислоты имеются, как минимум, 2 оптически активных антипода. Природа выбрала для создания белков L-форму. Поэтому природные белки построены из L-- аминокислот.
Во всех случаях, когда в молекуле органического соединения атом углерода связан с 4 разными атомами или функциональными группами, этот атом ассиметричен, поскольку он может существовать в двух изомерных формах, называемых энантиомерами или оптическими (стерео-) изомерами. Соединения с ассимметричными атомами "С" встречаются в виде двух форм (хиральных соединений) - левой и правой, в зависимости от направления вращения плоскости поляризации плоскополяризованного света. Все стандартные аминокислоты кроме одной (глицин) содержат в -положении ассимметричный атом углерода, с которым связаны 4 замещающих группы. Поэтому они обладают оптической активностью, то есть способны вращать плоскость
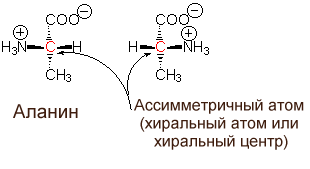
поляризации света в том или ином направлении.
Однако в основе системы обозначения стереоизомеров лежит не вращение плоскости поляризации света, а абсолютная конфигурация молекулы стереоизомера. Для выяснения конфигурации оптически активных аминокислот их сравнивают с глицериновым альдегидом - простейшим трехуглеродным углеводом, который содержит ассимметричный атом углерода. Стереоизомеры всех хиральных соединений, независимо от направления вращения плоскости поляризации плоскополяризованного света, соответствующие по конфигурации L-глицериновому альдегиду, обозначаются буквой L, а соответствующие D-глицериновому альдегиду - буквой D. Таким образом, буквы L и D относятся к абсолютной конфигурации 4 замещающих групп при хиральном атоме "С", а не к направлению вращения плоскости поляризации.
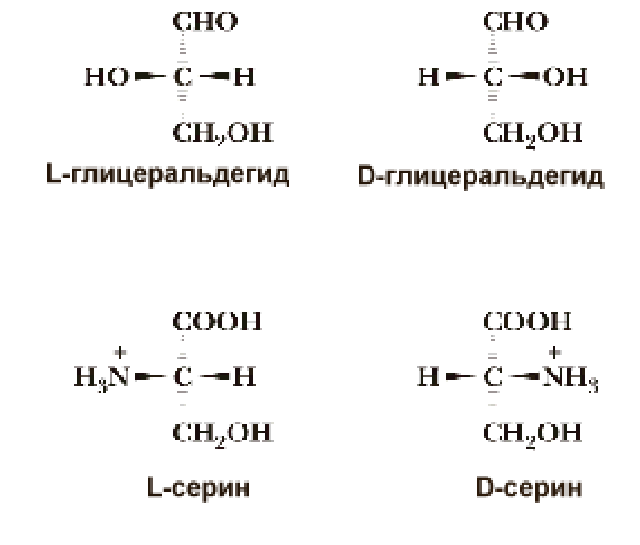
Классификация аминокислот проводится по строению их радикала. Существуют разные подходы к классификации. Большая часть аминокислот - это алифатические соединения. 2 аминокислоты являются представителями ароматического ряда и 2 - гетероциклического.
Аминокислоты можно разделить, по их свойствам, на основные, нейтральные и кислые. Они отличаются числом амино- и карбоксильных групп в молекуле. Нейтральные - содержат по одной амино- и одной карбоксильной группе (моноаминомонокарбоновые). Кислые имеют 2 карбоксильные и одну аминогруппу (моноаминодикарбоновые), основные -2 аминогруппы и одну карбоксильную (диаминомонокарбоновые).
1. Собственно алифатическими можно назвать 5 аминокислот. Глицин или гликокол (Гли),
при работе с компьютером - (G), - -аминоуксусная кислота. Является единственной оптически неактивной аминокислотой. Глицин используется не только для синтеза белков. Его атомы входят в состав нуклеотидов, гема, он входит в состав важного трипептида - глутатиона.
Аланин (Ала), при работе с компьютером - (А) - -аминопропионовая кислота. Аланин нередко используется в организме для синтеза глюкозы.
По структуре все аминокислоты, за исключением глицина, можно рассматривать как производные аланина, у которого один или несколько атомов водорода в составе радикала замещены различными функциональными группами.
Валин (Вал), при работе с компьютером (V) - аминоизовалериановая кислота. Лейцин (Лей, L) - аминоизокапроновая кислота. Изолейцин (Иле, I) - -амино--этил--метилпропионовая кислота. Эти три аминокислоты, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы.
2. Гидроксиаминокислоты. Серин (Сер, S) - -амино--гидроксипропионовая кислота и треонин (Тре, T) - -амино--гидроксимасляная кислота играют важную роль в процессах ковалентной модификации структуры белков. Их гидроксильная группа легко взаимодействует с фосфорной кислотой, что бывает необходимым для изменения функциональной активности белков.
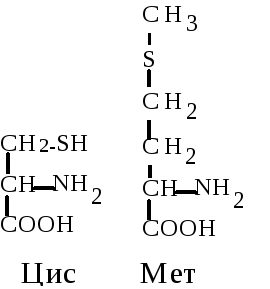
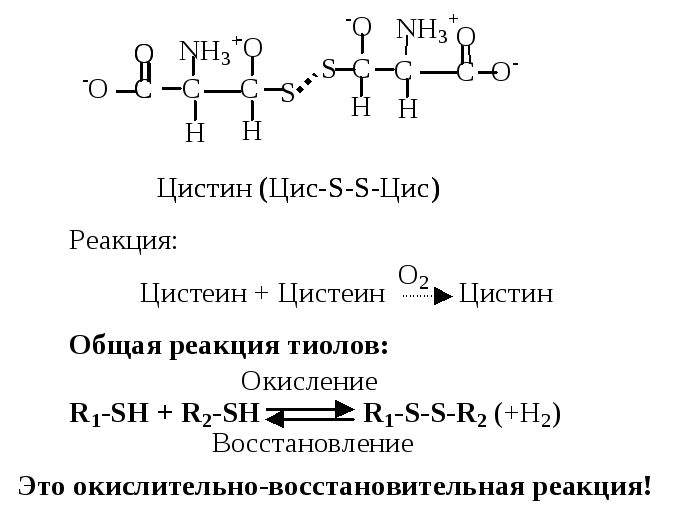
3. Серусодержащие аминокислоты. Цистеин (Цис, C) --амино--тиопропионовая кислота. Специальным свойством цистеина является способность к окислению (в присутствии кислорода) и взаимодействию с другой молекулой цистеина с образованием дисульфидной связи и нового соединения - цистина. Эта аминокислота благодаря активной -SH группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков, входит в состав активного центра ферментов.
Метионин (Мет, M) --амино--тиометилмасляная кислота. Выполняет функцию донора подвижной метильной группы, необходимой для синтеза биологически активных соединений: холина, нуклеотидов и т.д. Это гидрофобная аминокислота.
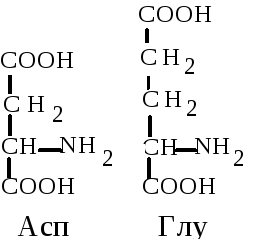
4. Дикарбоновые аминокислоты. Глутаминовая (Глу, E) - -аминоглутаровая кислота и аспарагиновая кислота (Асп, D) --аминоянтарная кислота. Это наиболее распространенные аминокислоты белков животных организмов. Обладая дополнительной карбоксильной группой в радикале, эти аминокислоты способствуют ионному взаимодействию, придают заряд белковой молекуле. Эти аминокислоты могут образовывать амиды.
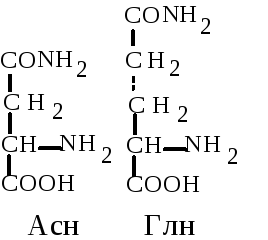
5. Амиды дикарбоновых аминокислот. Глутамин (Глн, Q) и аспарагин (Асн, N). Эти аминокислоты выполняют важную функцию в обезвреживании и транспорте аммиака в организме. Амидная связь в их составе частично имеет характер двойной. За счет этого амидная группа обладает частичным положительным зарядом и не будет диссоциировать.
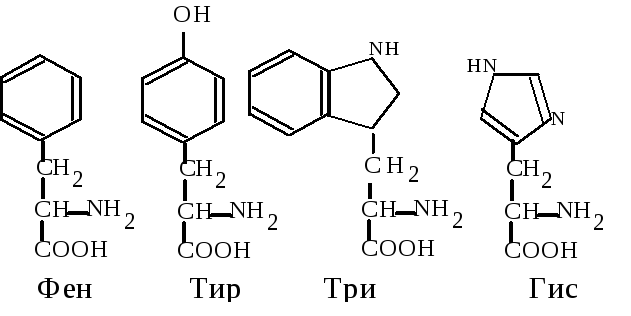
6. Циклические аминокислоты имеют в своем радикале ароматическое или гетероциклическое ядро. Фенилаланин (Фен, F) - -амино--фенилпропионовая кислота. Тирозин (Тир, Y) - -амино--параоксифе-нилпропионовая кислота. Эти 2 аминокислоты образуют взаимосвязанную пару, выполняющую важные функции в организме, среди которых следует отметить использование их клетками для синтеза ряда биологически активных веществ (адреналина, тироксина).
Триптофан (Три, W) -амино--индолилпропионовая кислота. Используется для синтеза витамина PP, серотонина, гормонов эпифиза.

Гистидин (Гис, H) - -амино--имидазолилпропионовая кислота. Может использоваться при образовании гистамина, регулирующего проницаемость тканей и проявляющего свое действие при аллергии.
7. Диаминомонокарбоновые аминокислоты. Лизин (Лиз, K) - диаминокапроновая кислота. Аргинин (Арг, R)--амино--гуанидин-валериановая кислота. Эти аминокислоты имеют дополнительную аминогруппу, которая придает основные свойства белкам, содержащим много таких аминокислот. Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).

8. Иминокислота - пролин (Про, P). Отличается от других аминокислот по строению. Её радикал образует с -аминогруппой единую циклическую структуру. Благодаря этой особенности вокруг связи между -аминогруппой и -углеродным атомом невозможно никакое вращение. У всех других аминокислот возможность вращения вокруг этой связи имеется. Вдобавок в состав пролина входит вторичная аминогруппа (с азотом азота связан только один атом водорода), которая отличается, по своим химическим характеристикам от первичной аминогруппы (-NH2) в составе других аминокислот. Особое место отводится этой аминокислоте в структуре коллагена, где пролин, в процессе синтеза коллагена, может превращаться в гидроксипролин.
В скобках указаны сокращенные обозначения аминокислот, которые образуются из первых трех букв их тривиального названия. В последнее время для записи первичной структуры используются и однобуквенные символы, что важно при использовании ЭВМ в работе с белками.
Структурная организация белковой молекулы
Согласно классификации К. Линдерштрема-Ланга различают четыре уровня структурной организации белковой молекулы:
П ервичная
(одномерная, линейная) структура - это
порядок или последовательность
расположения аминокислотных остатков
в пептидной цепи (включая -S-S- связи), ее
химическое строение.
ервичная
(одномерная, линейная) структура - это
порядок или последовательность
расположения аминокислотных остатков
в пептидной цепи (включая -S-S- связи), ее
химическое строение.
Пример: пептид ангиотензин-2, повышающий давление
Особенности строения пептидной связи:
Н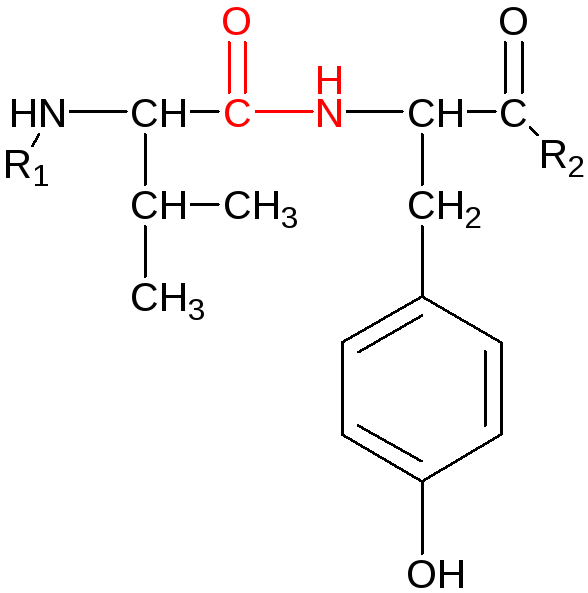 аличие
плоской (компланарной) сопряженной
системы в пептидном звене затрудняет
вращение вокруг связи С-N
аличие
плоской (компланарной) сопряженной
системы в пептидном звене затрудняет
вращение вокруг связи С-N
М езомерия
пептидной связи
езомерия
пептидной связи
Вторичная структура белков
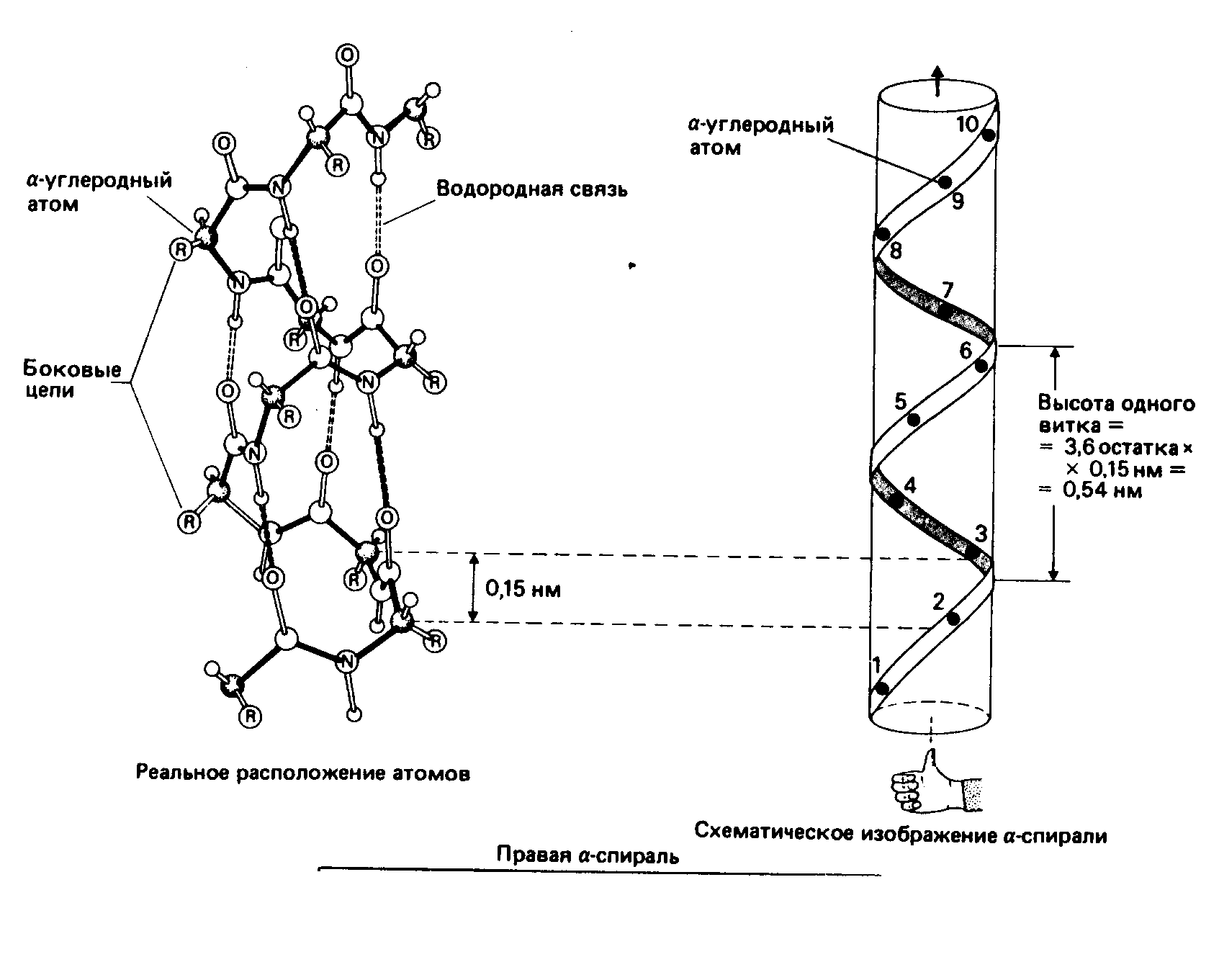
В 1950 г. Лайнус Полинг предложил два вида пространственной структуры белков - альфа-спираль и бета-структуру. Эти понятия сохранились до настоящего времени как виды вторичной структуры белков. Кроме них сейчас различают ещё один, третий тип вторичной структуры - -поворот. Вторичная структура белка - это локальная конформация полипептидной цепи, обусловленная вращением отдельных участков этой полипептидной цепи вокруг одинарных ковалентных связей.
Стабильность спирали поддерживают водородные связи между атомами пептидных группировок аминокислот, расположенных на соседних витках спирали. Все условия, ведущие к формированию спиральных структур, могут успешно реализоваться и при другой форме расположения полипептидной цепи. Эту альтернативную спирали форму назвали -структурой. Она формируется при укладке цепи в форме плоских шпилек. -структура также стабилизирована водородными связями. Из двух или более -структурных участков полипептидной цепи формируется -слой. В грубом приближении она плоская и напоминает лист. Однако из-за того, что плоскости пептидных групп в каждом -структурном участке наклонены поочередно в разные стороны относительно направления этого участка, плоский -слой приобретает складчатую форму.
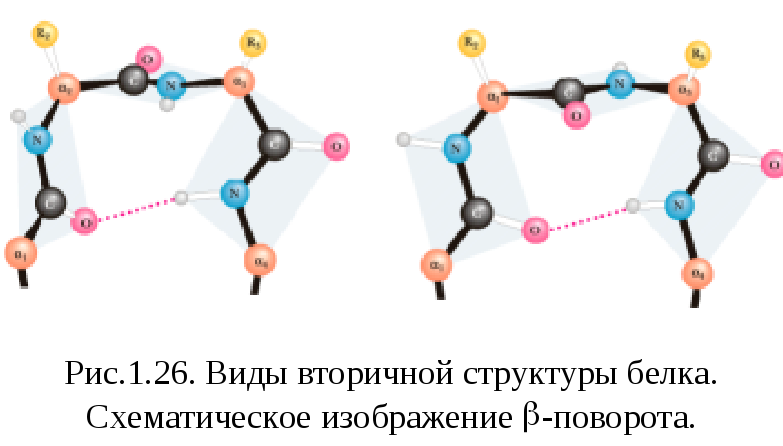
-поворот или -изгиб - ещё один тип вторичной структуры, встречающийся во многих глобулярных белках в тех местах, где направление полипептидной цепи меняется на противоположное. Данная структура часто рассматривается как связующее звено между двумя уложенными антипараллельно -участками в составе -слоя. Она образуется в полипептидной цепи там, где встречается пролин. Дело в том, что эта аминокислота не может изгибаться, и там где она встречается в полипептидной цепи, -спираль и -структура обычно нарушаются. В этом месте образуется своеобразный излом - -поворот. В -повороте водородная связь замыкается через три аминокислотных остатка. Там, где встречается -поворот, полипептидная цепь делает изгиб. -повороты обычно находятся у поверхности белковой молекулы.
|
|
|
|
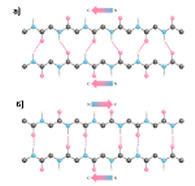
Схематическое изображение -структуры. а) параллельное, б) антипараллельное расположение -структурных участков полипептидной цепи в -слое
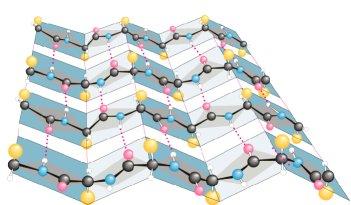
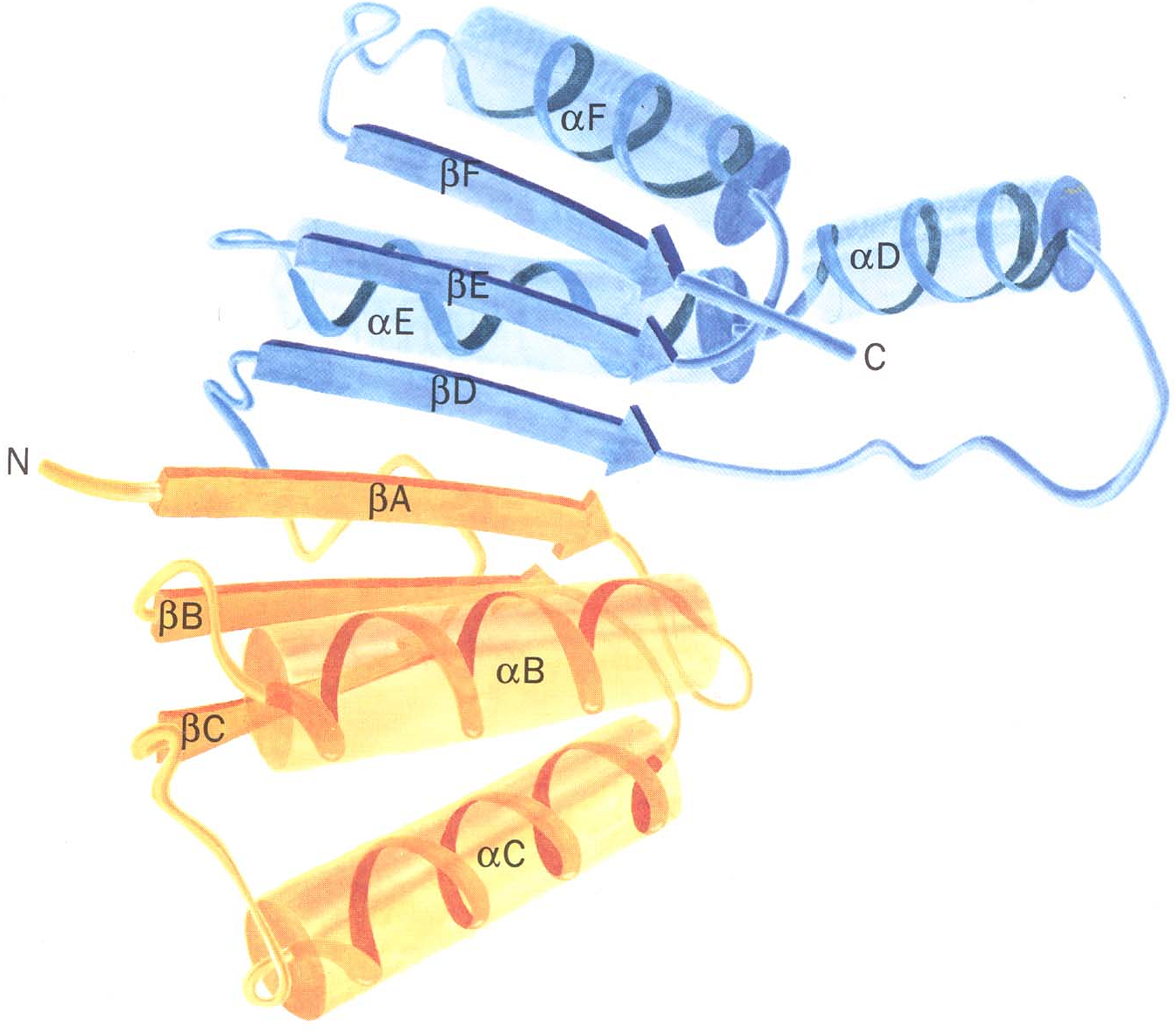
Увеличение числа известных белков привело ученых к необходимости более подробно исследовать пространственную структуру полипептидных цепей. Оказалось, что несколько участков цепи, организованных в пространстве в форме -спирали или -структуры, могут объединяться, формируя так называемую надвторичную структуру. В белке может быть несколько организованных таким образом участков. Всех их можно подразделить на четыре класса: /, /, / и + , в зависимости от взаимного расположения в цепи -спиральных и -структурных участков.
Полипептидная цепь изображается в виде ленты, при этом -спиральные участки представлены спиралями, -структурные - стрелками, а нерегулярные - светлыми петлями. Боковые цепи не показаны, хотя во всех белках пространство между атомами основной цепи заполнено атомами боковых цепей. / структура состоит в основном из -спиралей, -участки в ней практически отсутствуют. -спирали упакованы таким образом, что неполярные боковые цепи оказываются спрятанными внутрь. В / типе имеется несколько -цепей и нет (или почти нет) -спиралей. В / варианте - и -участки чередуются вдоль цепи. Часто -участки образуют параллельный -слой, окруженный -спиралями. В + -типе - и -участки обычно располагаются в разных сегментах полипептидной цепи.
|
|
|
Варианты объединения -спиральных и -структурных участков (надвторичной структуры) в полипептидной цепи
В крупных белках при сворачивании полипептидной цепи часто образуются две или более пространственно разделенные области, называемые доменами. По своей
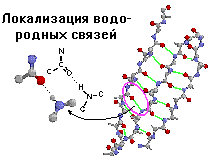
структуре каждый домен напоминает отдельный небольшой белок. Обычно в одном домене содержится от 40 до 300 остатков. Доменом называют участок белковой молекулы, образованный несколькими вторичными или надвторичными структурами, имеющий глобулярную форму. В разных белках они могут быть одинаково организованными участками и выполнять одинаковые функции. Домены часто обладают специфическими функциями, такими как связывание небольших молекул.

|
|
Обобщенное изображение кофермент-связывающего домена в составе различных дегидрогеназ. Этот домен состоит из двух одинаковых по структуре единиц (один - желтого и один - синего цвета). Каждая единица связывает НАД (никотинамидадениндинуклеотид) и образует в месте связывания складку. |
Использование понятия "домен" позволило выделить целые семейства белков, имеющих общего предшественника, что проливает свет на процессы совершенствования живого мира.
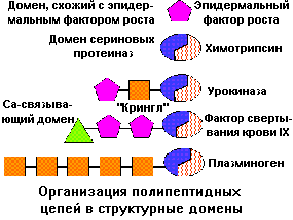
В ряде случаев четко определить функции тех или иных доменов не удается. Между доменами в пределах одной и той же полипептидной цепи устанавливаеются гидрофобные контакты. В этих зонах формируется каталитический центр, а образующие его группы размещены в обоих доменах.
На этом уровне структурной организации белка еще не принимались во внимание возможности взаимодействия радикалов аминокислот между собой и с растворителем (водой), в котором белок должен выполнять свои функции.
Третичная структура белков
Третичной структурой белков назвали расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют свою локальную конформацию, то есть сохраняют спиральные или -структурные формы. Большая часть белков на уровне третичной структуры принимает глобулярную (шаровидную) форму. Это связано, в первую очередь, с тем, что многие неполярные группы радикалов аминокислот под влиянием полярного растворителя, воды, объединяются между собой в кластеры, исключающие воду. При этом они разрывают водородные связи между диполями воды, уменьшая энтропию, и сближаются на расстояния, доступные для электростатического взаимодействия между ними. Такое взаимодействие получило название "сил гидрофобного взаимодействия". Эти силы, требующие небольших усилий для разрыва, тем не менее приобретают важнейшее значение для стабилизации пространственной структуры белка. Аналогичным образом формируются липидные мицеллы. Поэтому при складывании полипептидной цепи гидрофобные радикалы оказываются внутри белковой молекулы, а гидрофильные - наружи, тем самым снижение энтропии становится минимальным.
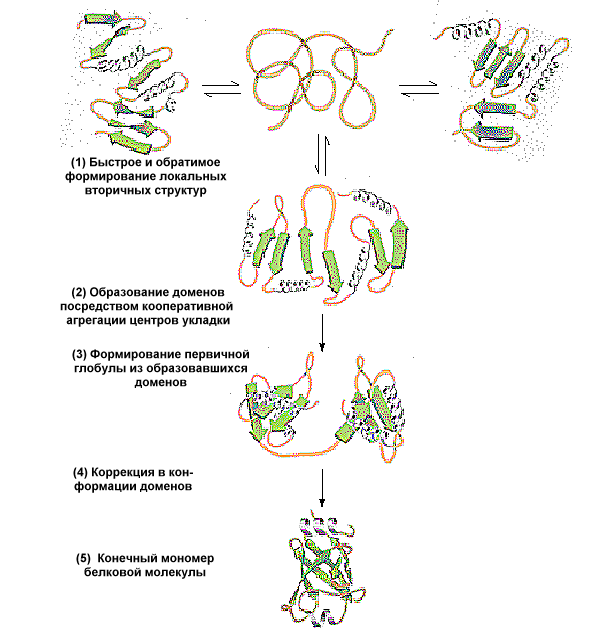
Этапы пространственной укладки полипептидной цепи и приобретения ею третичной структуры
Важную роль в стабилизации третичной структуры белка играют водородные связи и ионное взаимодействие. Указанные силы успешно сочетают прочность структуры белка и ее довольно значительную подвижность, что чрезвычайно важно для выполнения функций. В ряде белков прочность структуры укрепляется дополнительно и ковалентными дисульфидными связями.
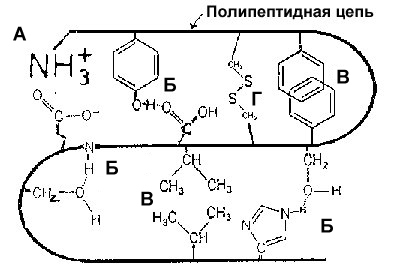
Связи, стабилизирующие третичную структуру белка. А. Ионная связь. Б. Водородная связь (три типа показаны). В. Гидрофобное взаимодействие (две формы - нижнее кластерного типа, а верхнее типа -связи). Г. Дисульфидная связь.
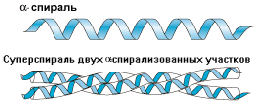
В фибриллярных (нитевидных) белках третичная структура формируется или путем многослойной укладки плоских -структур, или параллельной укладкой нескольких спиральных структур. В любом случае возникают ориентированные в длину волокнистые структуры. Такие волокна имеют высокую прочность. Примером такого белка может служить белок соединительной ткани - коллаген. Его молекула представляет своеобразную суперспираль, состоящую из 3-х спирально свернутых полипептидных цепей. Такие суперспирали, в свою очередь, укладываются в форме более толстых протофибрилл, объединяемых затем в коллагеновое волокно.
В заключение надо отметить, что для уникальному пространственному расположению атомов в молекуле белка (укладка полипептидной цепи в пространстве), которое "запрограммированно" самой аминокислотной последовательностью полипептидной цепи и поэтому образуется самопроизвольно, тем не менее нужны помощники. Эти помощники также являются белками и получили название "шапероны" (см.гл.10). Впервые они были открыты как "белки теплового шока" (hsp 60 и hsp 70). Их функция заключается в защите складывающейся полипептидной цепи от взаимодействия с другими многочисленными клеточными белками и, возможно, в ускорении этого процесса.
Четвертичная структура белков
Под четвертичной структурой понимают структуру белков, состоящих из нескольких полипептидных цепей. Каждая из этих цепей имеет свою завершенную пространственную структуру и называется субъединицей белка с четвертичной структурой. Белок при таком объединении нескольких цепей приобретает новую функцию.
![]()
![]()
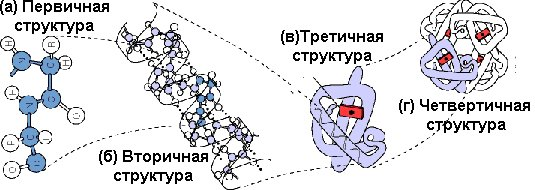
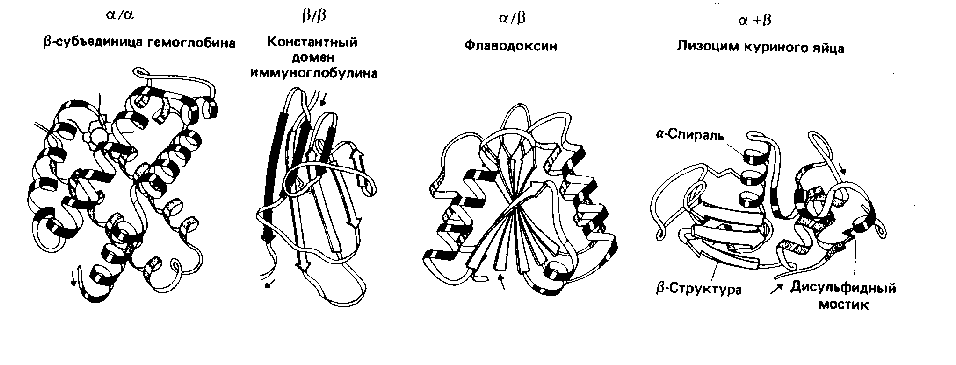
![]() Уровни
структурной организации белковой
молекулы
Уровни
структурной организации белковой
молекулы
![]() Связи,
которые имеются между субъединицами,
как правило, нековалентные (силы
гидрофобного взаимодействия, ионные,
водородные), хотя в ряде белков (например,
белки плазмы крови) субъединицы соединены
ковалентными дисульфидными мостиками.
Создание белков с четвертичной структурной
организацией позволило Природе расширить
свои возможности в области качественного
разнообразия белков при незначительном
увеличении количества генетического
материала. Например, фермент
лактатдегидрогеназа (ЛДГ), состоящий
из 4-х субъединиц, формируется из 2-х
генетически детерминированных
полипептидных цепей H и M. Их разные
комбинации (HHHH,HHHM,HHMM,HMMM,MMMM) позволяют
существовать в организме 5 ферментам
ЛДГ, катализирующих одинаковую реакцию
в разных органах и тканях: ЛДГ1,
ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5.
Такие белки с одинаковыми функциями,
но отличающимися физико-химическими
свойствами получили название изопротеинов
(изоферментов).
Связи,
которые имеются между субъединицами,
как правило, нековалентные (силы
гидрофобного взаимодействия, ионные,
водородные), хотя в ряде белков (например,
белки плазмы крови) субъединицы соединены
ковалентными дисульфидными мостиками.
Создание белков с четвертичной структурной
организацией позволило Природе расширить
свои возможности в области качественного
разнообразия белков при незначительном
увеличении количества генетического
материала. Например, фермент
лактатдегидрогеназа (ЛДГ), состоящий
из 4-х субъединиц, формируется из 2-х
генетически детерминированных
полипептидных цепей H и M. Их разные
комбинации (HHHH,HHHM,HHMM,HMMM,MMMM) позволяют
существовать в организме 5 ферментам
ЛДГ, катализирующих одинаковую реакцию
в разных органах и тканях: ЛДГ1,
ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5.
Такие белки с одинаковыми функциями,
но отличающимися физико-химическими
свойствами получили название изопротеинов
(изоферментов).
Слабое взаимодействие между отдельными частями белкой молекулы дает ей некоторую свободу к изменениям пространственной структуры. Мы уже указывали, что расположение атомов или групп атомов молекулы органического вещества, обусловленное возможностями вращения их вокруг ковалентных связей, получило название конформации. Изменение конформации белковой молекулы лежит в основе ее биологической активности.
Каждая отдельно взятая полипептидная цепь, которая называется протомером, чаще всего не обладает биологической активностью. Эту способность белок приобретает при объединении с другими протомерами. Образовавшуюся при этом молекулу называют мультимером. Мультимерные белки чаще всего построены из чётного числа протомеров. Функционально активная часть мультимера называется субъединицей.
В частности молекула белка глобина состоит из 2 и 2 субъедениц, каждая из которых состоит из двух одинаковых полипептидных цепей соответственно. То есть молекула гемоглобина состоит из четырех полипептидных цепей, каждая из которых окружает группу гема.
При определённых условиях (в присутствии мочевины) или при сдвиге рН молекула гемоглобина обратимо диссоциируют на 2 и 2 полипептидных цепи. После удаления мочевины происходит автоматическая ассоциация исходной молекулы. Это возможно благодаря информации, заложенной в первичной структуре. То есть последовательность аминокислот содержит в себе информацию, которая реализуется на всех уровнях структурной организаци белка. Наиболее изученным мультемерным ферментом является ЛДГ, состоящий из 4-х субъединиц и может существовать в 5-ти формах (изоферменты).
ПЯТЫЙ УРОВЕНЬ организации представлен в виде ферментных комплексов, которые катализируют цепной и метаболический путь. Эти комплексы называются метаболонами, они чаще связаны с клеточными мембранами.
Стабильность четвертичной структуры обусловлена ковалентными связями между контактными площадками протомеров, которые взаимодействуют друг с другом по принципу комплементарности. Так, например, в гемоглобине каждая субъединица имеет 4 контактные поверхности для связывания с гемом, 3 – для связывания с другими протомерами.
В последние годы была сформулирована теория доменной структуры белка. Домен – это функциональный модуль, рабочая поверхность отдельного белка. То есть белок – это полифункциональный модуль, состоящий из нескольких доменов. Было установлено, что белки выполняющие одну и ту же функцию, но выделенные из разных веществ, имеют сходное строение. Домены друг относительно друга могут смещаться благодаря “ гибкости” белковой молекулы. Смещение происходит под действием температуры, факторов внешней среды, фосфорилирования, метилирования, и это отражается на свойствах и функциях белка.
Уникальная пространственная структура каждой белковой молекулы и ее возможности в определенных пределах изменять эту структуру придают белкам способность выполнять многочисленные специфические функции. Главный принцип, лежащий в основе этой специфичности, это принцип комплементарности или пространственной дополнительности между определенным участком белковой молекулы (активным участком) и молекулой или участком молекулы (лигандом), с которой реагирует этот белок. Активные участки белковых молекул образуются на поверхности в "карманах", "расщелинах". При этом если для функции необходимы гидрофобные радикалы аминокислот, то они, упрятанные от воды в глубине белковой молекулы, становятся доступными благодаря изменению её конформации. В таком случае говорят о кооперативном эффекте, который образно можно представить на модели "рука - перчатка".
Лигандами могут быть самые разные по химической природе вещества: белки, углеводы, липиды, неорганические вещества и т.д. Примерами такого специфического белок-лиганд взаимодействия являются взаимодействие между ферментом и субстратом, антителом и антигеном, рецептором и гормоном и т.д.
Учитывая важность конформационных изменений для выполнения белками их функций, становится понятным, что в регуляции их функциональной активности важная роль отводится факторам, влияющим на конформацию белка. Такими факторами могут быть изменения pH, температуры, которые в равной мере влияют на все белки и могут быть названы неспецифическими факторами регуляции. С другой стороны, это могут быть специфически взаимодействующие с белками вещества и тогда говорят о специфических факторах регуляции. Последние создают неограниченные возможности в специфической регуляции процессами жизнедеятельности.
Для определения количества белков используют разные подходы
Для количественного анализа белков можно использовать определение белкового азота. Для этого пробу сжигают при высокой температуре в присутствии серной кислоты и перекиси водорода (окислитель). Происходит минерализация, при этом азот в форме аммиака связывается серной кислотой (сульфат аммония). Количество сульфата аммония определяют или с реактивом Несслера, или после перегонки аммиака титрометрически.
Значительно чаще для количественного определения используют цветные реакции (биуретовую или реакцию на фенольные группы Lowry). Биуретовая реакция основана на том, что в щелочной среде ионы меди реагируют с пептидными группировками, образуя комплексные соединения, окрашенные в фиолетовый цвет. Интенсивность окраски фотометрируется. Сочетание биуретовой реакции и реакции на фенольные группировки используется в методе Lowry.
Для количественного определения индивидуальных белков в сложных смесях белков большой популярностью пользуются иммунологические методы. При взаимодействии белка со специфической антисывороткой образуется мутный раствор. Интенсивность помутнения может быть измерена колориметрическими методами.
|
Заведующий кафедрой биологической химии, д.м.н., проф. |
Грицук А. И. |
___________ |
21.10.2006
Министерство здравоохранения Республики Беларусь
УО «Гомельский государственный медицинский университет»
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № _________________200__года
ЛЕКЦИЯ по биологической химии
наименование дисциплины
для студентов _2__ курса лечебного факультета
Тема Ферменты-1. Строение и свойства.
Время 90 мин.
Учебные и воспитательные цели:
Дать представление:
-
О строении, размерах и форме белковой молекулы, функциях белков.
-
Понятия «денатурация»: причины и признаки, использование в медицине.
-
Понятия «ферменты»: особенностях ферментативного катализа. О строении и структуре ферментов.
-
О полиферментных комплексах, метаболонах.
ЛИТЕРАТУРА
-
Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 92–102; 1998. С. 114–143.
-
Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 5–92.
Дополнительная
-
Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 63–75.
-
Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 93–99.
-
Ленинджер А. Л. Основы биохимии. М.: Мир, 1985. Т. 1. С. 226–302.
-
Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия, М.: Медицина, 1991. С. 313–376.
-
Албертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994. Т. 1. С. 113–171.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1. Мультимедийная презентация.
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
|
№ п/п |
Перечень учебных вопросов |
Количество выделяемого времени в минутах |
|
|
Строение, размер и форма белковой молекулы, функции белков. |
15 |
|
|
Денатурация, причины и признаки, использование в медицине. |
15 |
|
|
Ферменты. Особенности ферментативного катализа. Строение и структура ферментов. |
30 |
|
|
Полиферментные комплексы, метаболоны. |
30 |
Всего 90 мин