
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЧЕРКАСЬКИЙ ІНЖЕНЕРНО-ТЕХНОЛОГІЧНИЙ ІНСТИТУТ
Будівельний факультет
Кафедра загальної хімічної
ЛАБОРАТОРНА РОБОТА №1
з курсу: Фізична хімія
Тема: Фазова рівновага рідина-пара в
однокомпонентній системі
|
Лабораторну роботу прийняв: викладач кафедри ЗХ Солодовнік Т.В. _________________________ |
|
Лабораторну роботу виконав: студент групи _________________________ |
|
“___”______________2010р. |
|
“___” _____________2010р. |
2010
Лабораторна робота №1
Тема: Фазова рівновага рідина-пара в однокомпонентній системі.
Теоретична частина
Умова рівноважного співіснування рідини та пари в однокомпонентній системі виражається рівнянням Клапейрона-Клаузіуса:
![]() ,
(1.1)
,
(1.1)
де
![]() - похідна, що характеризує нахил кривої
рівноваги співіснуючих фаз;
- похідна, що характеризує нахил кривої
рівноваги співіснуючих фаз;
V і s, V і s - об’єм та ентропія речовини у вихідній та новоутвореній
фазах;
Нф.п. = Н– Н = Тф.п. Sф.п. - ентальпія перетворення фази (1) у фазу (2).
Це рівняння містить три змінних (Р, V, Т) і його інтегрування в такому вигляді неможливе. Якщо знехтувати об’ємом конденсованої фази і вважати, що пара описується рівнянням Менделєєва-Клапейрона, то рівняння (1.1) набуде вигляду:
![]() (1.2)
(1.2)
або
![]() , (1.3)
, (1.3)
де Н - молярна ентальпія пароутворення.
Припускаючи в першому наближенні, що Н = const, проінтегруємо це рівняння в межах (Р1 Т1 ) і (Р2 Т2 ), одержимо:
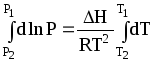 , (1.4)
, (1.4)
![]() (1.5)
(1.5)
або
![]() .
(1.6)
.
(1.6)
При орієнтовних розрахунках можна використовувати значення молярної ентальпії пароутворення, знайденої за правилом Трутона. Згідно з цим правилом:
![]() 88 Дж/(моль К) , (1.7)
88 Дж/(моль К) , (1.7)
(при Р = 101,3 кПа)
Величина H - молярна ентальпія пароутворення - це зміна ентальпії речовини, взятої в кількості 1 моль при її переході з рідкої фази в пару. Вона дорівнює кількості теплоти, що витрачається на випаровування 1 моля речовини (H = – Qвип.). Ця величина поряд з питомою теплотою пароутворення l = – H/M, широко застосовується у теплових розрахунках. Значення Н дозволяє також теоретично обчислити ебуліоскопічну сталу рідини:
![]() .
(1.8)
.
(1.8)
Перехід речовини з рідкої у газоподібну фазу (пару) прийнято називати пароутворенням, а зворотний процес – конденсацією. Слід мати на увазі, що пароутворення може бути наслідком або випаровування, або кипіння рідини. У першому випадку перехід речовини із фази в фазу йде лише з вільної поверхні рідини. При цьому рівновага в системі:
пароутворення
Р ІДИНА
ПАРА
ІДИНА
ПАРА
конденсація
встановлюється при тиску пари Рпари < Рзов. При підвищенні температури зростає тиск пари і при температурі кипіння стає рівним зовнішньому тиску. Газова фаза при цьому виникає також і в об’ємі рідини, виділяючись у вигляді бульбашок. Починається кипіння.
Якщо тиск пари дорівнює рівноважному при даній температурі, то така пара називається насиченою, незалежно від того, знаходиться вона у контакті чи ні.
Практична частина
Вимірювання тиску насиченої пари рідини проводиться за допомогою установки, схема якої подана на рис.1.1.
У колбу 1 із зворотним холодильником 3 та
термометром 2 помістити 5-10 мл досліджуваної
рідини, вкинути кип’ятильний камінчик
або запаяний капіляр і, приєднавши
систему через буферну посудину 5 до
вакуум-насосу, створити розрідження в
системі (покази вакуумметра 4 – 0,7-0,8 ).
Перекрити кран 6. Від’єднати насос !!!
колбу 1 із зворотним холодильником 3 та
термометром 2 помістити 5-10 мл досліджуваної
рідини, вкинути кип’ятильний камінчик
або запаяний капіляр і, приєднавши
систему через буферну посудину 5 до
вакуум-насосу, створити розрідження в
системі (покази вакуумметра 4 – 0,7-0,8 ).
Перекрити кран 6. Від’єднати насос !!!
Переконавшись у герметичності установки, пустити воду в зворотний холодильник 3 і включити електроплитку 7. Після того, як почнеться інтенсивне кипіння, записати покази термометра та вакуумметра. Обережно відкриваючи кран 6, що з’єднує прилад з атмосферою, збільшити тиск на п’ять поділок шкали вакуумметра, знову записати покази. Так продовжувати до того часу, поки тиск у приладі не зрівняється з атмосферним. Тиск, при якому відбувається кипіння (Ркип.), дорівнює різниці атмосферного тиску і розрідження:
Ркип. = Ратм. – Ррозр. , (1.9)
де Ррозр. - покази вакуумметра, Па.
Одержані дані заносимо до таблиці
