
- •Основні поняття хімії
- •Приклади розв’язання типових задач
- •Задачі для самостійного розв’язання
- •Стехіометричні поняття
- •Приклади розв’язання типових задач
- •Задачі для самостійного розв’язання
- •Розрахунки за рівняннями хімічних реакцій
- •Приклади розв’язання типових задач
- •Задачі для самостійного розв’язання
-
Розрахунки за рівняннями хімічних реакцій
Розрахунок кількості речовини та маси реагентів і продуктів. Розрахунок об’єму газоподібних реагентів та продуктів. Теоретичний та практичний вихід продукту реакції. Масова доля домішок в речовинах.
Приклади розв’язання типових задач
Задача 1.
При рентгеноскопічному досліді організму людини використовують так зване рентгеноконтрастні речовини. Так, перед тим, як просвічувати шлунок, пацієнту дають випити суспензію важкорозчинного сульфату барію, який не пропускає рентгенівське випромінювання. Визначте кількість речовини оксиду барію та сірчаної кислоти, які будуть необхідні для отримання 100 г сульфіду барію.
Дано:
m (BaSO4) = 100 г
М (BaSO4)
= 233
![]()
n(BaO) - ?
n(H2SO4) - ?
Рішення:
ВаО + Н2SО4 = ВаSО4 + Н2О.
У відповідності з коефіцієнтами рівняння реакції, які в нашому випадку дорівнюють 1, кількість речовини ВаSО4, ВаО та Н2SО4 однакова:
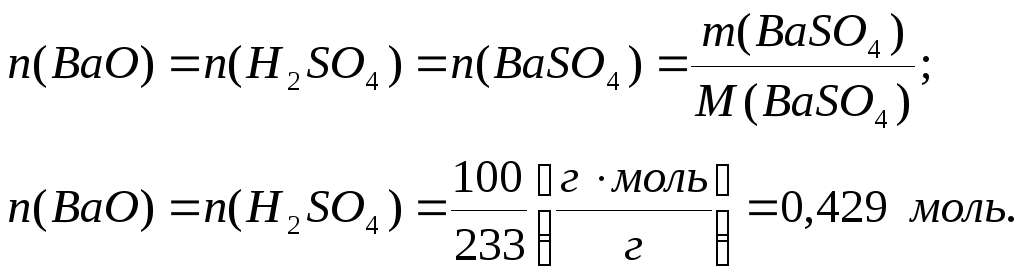
Відповідь: необхідно по 0,429 моль оксиду барію та сірчаної кислоти.
Задача 2.
Перш ніж вилити у каналізацію рідки відходи лабораторних робіт, які містять соляну кислоту, належить їх нейтралізувати лугом (наприклад, гідроксидом натрію) або кальцинованою содою (карбонатом натрію). Визначте маси гідроксиду і карбонату натрію, необхідних для нейтралізації відходів, які містять 0,46 моль HCl. Який об’єм газу (н.у.) виділиться при нейтралізації вказаної кількості відходів содою?
Дано:
n(HCl) = 0,46 моль
М (Na2CO3)
= 106
![]()
М (NaOH)
= 40
![]()
Vm
= 22,4
![]()
m(NaOH) - ?
m(Na2CO3) - ?
V(СО2) - ?
Рішення:
Запишемо рівняння реакції:
![]()
.![]()
Згідно рівнянь реакцій для нейтралізації заданої кількості HCl необхідно:
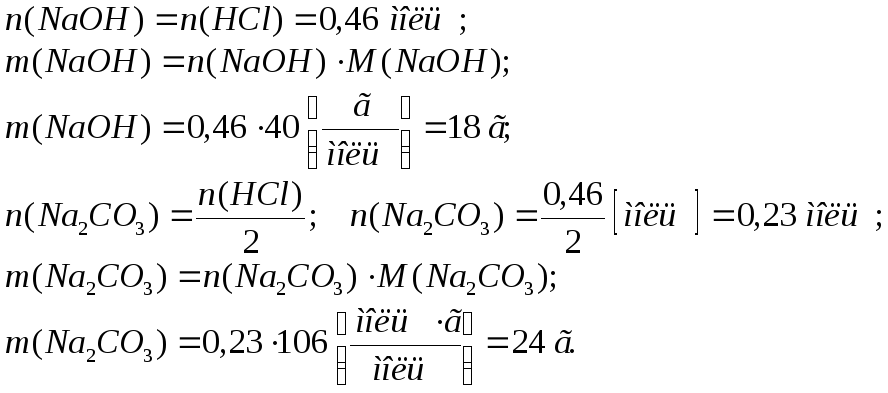
Для визначення об’єму вуглекислого газу, який виділився при нейтралізації сірчаної кислоти відповідно до рівняння реакції (2), додатково використовуємо рівняння, яке пов’язує між собою кількість газоподібної речовини, його об’єм і молярний об’єм:
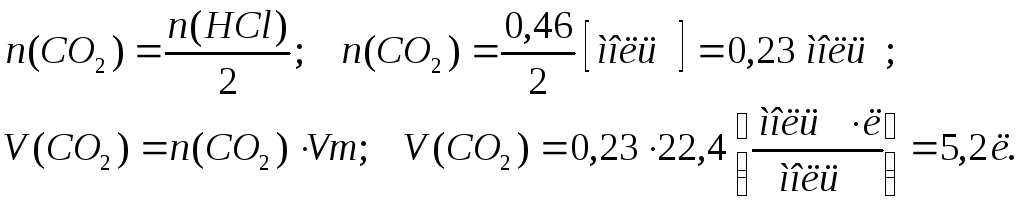
Відповідь: необхідно 18 г NaOH або 24 г Na2CO3. Виділиться 5,2 л СО2.
Задача 3.
Відомий дванадцятиденний дослід дозволив Лорану Лавуазьє пояснити природу горіння різноманітних речовин у кисні. Спочатку вчений тривалий час нагрівав в запаяному реторті навіску ртуті, а потім (і при більш високій температурі) – оксид ртуті (ІІ), який утворився на першому етапі досліду. Розрахуйте кількість речовини і об’єм кисню (н.у.), який було зібрано при розпаді 108,5 г оксиду ртуті (ІІ).
Дано:
m(HgO) = 108,5 г
M(HgO)
– 217
![]()
Vm = 22,4
![]()
V(O2) – ?
Рішення:
З![]() апишемо
рівняння реакції:
апишемо
рівняння реакції:
Кількість речовини кисню, який виділився при розкладі оксиду ртуті (ІІ), складає:
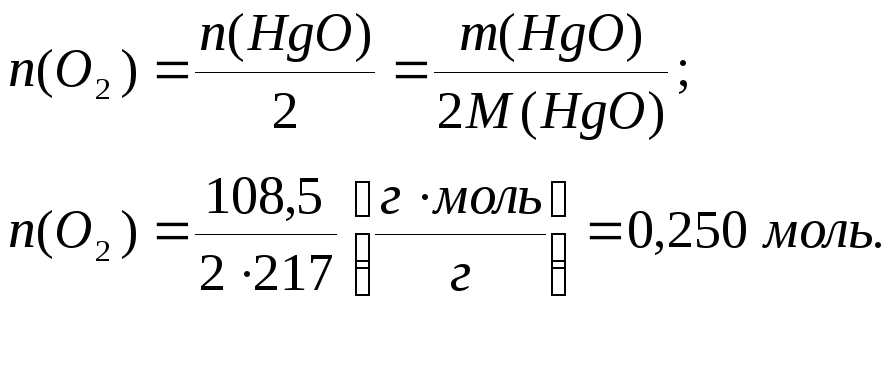
Об’єм кисню при н.у.:
V(O2)
= n(O2)
· Vm;
V(O2)
= 0,250 · 22,4
![]()
Відповідь: Зібрано 0,250 моль, або 5,60 л (н.у.), О2.
Задача 4.
Найважливішою проблемою промислового виробництва азотних добрив – отримання так званого зв’язаного азоту. Сьогодні її вирішують шляхом синтезу аміаку з азоту та водню. Який об’єм аміаку (н.у.) можна отримати при цьому процесі, якщо об’єм початкового водню дорівнює 300 л, а фактичний вихід продукту – 43 % від теоретично можливого?
Дано:
V(H2) = 300 л
η(NH3) = 43% = 0,43
V(NH3) - ?
Рішення:
З![]() апишемо
рівняння реакції:
апишемо
рівняння реакції:
Об’єм аміаку, який можна отримати на 300 л водню, складає:
Vпр(NH3)
= Vт(NH3)
· η(NH3)
=
![]() V(H2)
· η(NH3);
V(H2)
· η(NH3);
Vпр(NH3)
=
![]() · 300 · 0,43 [л] = 86 л.
· 300 · 0,43 [л] = 86 л.
Відповідь: Можна отримати 86 л (н.у.) аміаку.
Задача 5.
Найефективніший спосіб знешкодження забруднених стічних вод хімічних підприємств – обробка їх речовинами, які осаджують шкідливі домішки у вигляді важкорозчинних сполук. При цьому важливо, щоб реагент-осадник був з надлишком, інакше необхідна степінь очищення стоків не буде досягнута. Підприємство подає на ділянку водоочищення стічну воду, яка містить 3,31 кг нітрату свинцю (ІІ). Осадження катіонів свинцю (ІІ) проводять, додаючи до розчину 1,27 кг карбонату натрію. Визначте, який реагент і в якій кількості знаходиться у надлишку. Розрахуйте також масу осадку карбонату свинцю (ІІ), який випадає.
Дано:
m(Pb(NO3)2) = 3,31 кг = 3 310 г
m(Na2CO3) = 1,27 кг = 1 270 г
M(Pb(NO3)2)
= 331
![]()
M(Na2CO3)
= 106
![]()
M(PbCO3)
= 267
![]()
nнадл. - ?
m(PbCO3) - ?
Рішення:
З![]() апишемо
рівняння реакції:
апишемо
рівняння реакції:
Для того щоб визначити, яка з речовин – нітрат свинцю (ІІ) або карбонат натрію – взято з надлишком, спочатку підрахуємо кількість кожної речовини:
n(Pb(NO3)2)
=
![]()
n(Pb(NO3)2)
=
![]()
n(Na2CO3)
=
![]()
Відповідно з коефіцієнтами рівняння реакції обидві речовини повинні бути взяті в однаковій кількості, але 12,0 моль > 10,0 моль, отже, карбонат натрій з надлишком, причому його надлишок складатиме:
nнадл. = 12,0 моль – 10,0 моль = 2,0 моль.
Розрахунок маси продукту ведемо за тим реагентом, який прореагував повністю, тобто за нітратом свинцю (ІІ):
n(PbCO3) = n(Pb(NO3)2) = 10,0 моль;
m(PbCO3) = n(PbCO3) · M(PbCO3);
m(PbCO3)
= 10 · 267
![]()
Відповідь: Надлишок Na2CO3 – 2,0 моль, маса осаду – 2,67 кг.
Задача 6.
Повітря, забруднене сірководнем, протягом п’яти годин.
Дано:
m(HgO) = 108,5 г
M(HgO)
– 217
![]()
Vm = 22,4
![]()
V(O2) – ?
Рішення:
З![]() апишемо
рівняння реакції:
апишемо
рівняння реакції:
Кількість речовини кисню, який виділився при розкладі оксиду ртуті (ІІ), складає:
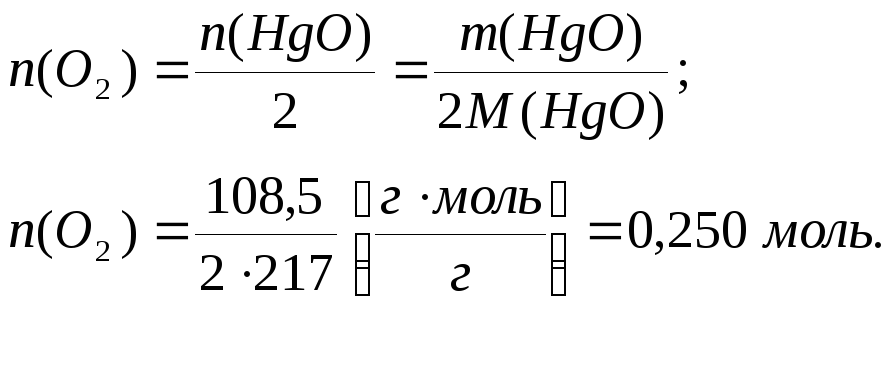
Об’єм кисню при н.у.:
V(O2)
= n(O2)
· Vm;
V(O2)
= 0,250 · 22,4
![]()
Відповідь: Зібрано 0,250 моль, або 5,60 л (н.у.), О2.
