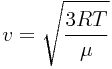Примерный перечень вопросов к коллоквиуму-2
-
Физические основы молекулярно-кинетической теории. Газовые законы. Идеальный газ. Термодинамические параметры. Уравнение состояния идеального газа ?
Ответ:
Основные положения молекулярно-кинетической теории:
-
Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
-
Атомы и молекулы находятся в непрерывном хаотическом движении.
-
Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
ГАЗОВЫЕ ЗАКОНЫ.
-
Абсолютная температура.
Если предположить, что закон теплового расширения справедлив и для низких температур (чего нельзя принять без ограничений), можно получить чисто вычислительным путём: при t = - 273ºС объем газа обратится в нуль. Абсолютный нуль лежит при - 273ºС.Абсолютная температура (шкала Кельвина) => Тº = 273 + tºС.
-
Закон Гей – Люссака.
Из закона расширения следует: при постоянном давлении объемы газов относятся, как абсолютные температуры:
V1 : V2 = T1 : T2, Закон Гей – Люссака.
-
Закон Бойля - Мариотта.
Закон устанавливает зависимость объема газа от давления при неизменной температуре. Получается:
|
p1V1 / Т1 = p2V2 / Т2 – уравнение состояния идеального газа. |
-
Изменение удельного веса и плотности с температурой.
Из того, что объем изменяется при нагревании, следует, что удельный вес и плотность также зависят от температуры. В таблицах обе величины обычно приводятся к 0ºС и давлению 760 мм рт. ст.
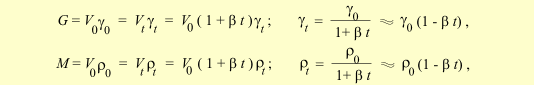
Приведение массы к нормальным условиям.
![]()
Вес газа:
![]()
ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Идеальный газ – это модель реального газа, которая обладает следующими свойствами:
-
Молекулы пренебрежимо малы по сравнению со средним расстоянием между ними.
-
Молекулы ведут себя подобно маленьким твердым шарикам: они упруго сталкиваются между собой и со стенками сосуда, никаких других взаимодействий между ними нет.
-
Молекулы находятся в непрекращающемся хаотическом движении.
Уравнение
состояния идеального газа :
![]()
-
Основное уравнение молекулярно-кинетической теории ?
Ответ:
Основное
уравнение молекулярно-кинетической
теории идеальных газов :
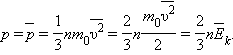
-
Закон распределения молекул по скоростям и энергиям. Наиболее вероятная скорость. Средняя арифметическая скорость ?
Ответ:
Если газ находится в равновесии, молекулы движутся хаотически, и все направления их движения равновероятны. Скорости молекул могут быть самыми различными по модулю и при каждом соударении с другими молекулами изменяются случайным образом.
Cредняя кинетическая энергия молекулы идеального газа:
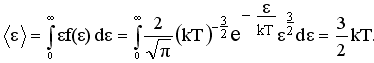
Средняя квадратичная скорость молекул :