
химия твгту 2018 вариант 74 / химия твгту 2018 вариант 74
.docx(74) 16 38 56 78 84 119 124 142 161 184 214 234 243 268 294 314
16
При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалента металла и его оксида. Чему равны молярная и относительная атомная массы металла? Ответ: 27,9 г/моль; 35,9 г/моль; 55,8г/моль; 55,8.

38
Квантовые числа для электронов внешнего энергетического
уровня атомов некоторых элементов имеют следующие значения:
п = 4;l = 0; тl = 0; ms= ± 1/2. Напишите электронные формулы атомов этих элементов и определите, сколько свободных 3d- орбиталей содержит каждый из них.
ОТВЕТ: . Квантовые числа для электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения: n = 4, l = 0, ml = 0, ms = ±1/2. Напишите электронную формулу атома этого элемента и определите, сколько свободных 3d-орбиталей он содержит.
РЕШЕНИЕ
Внешний энергетический уровень при n = 4, l = 0, ml = 0, ms = ±1/2 имеет вид: 4s1, что соответствует атому калия. 19K 1s22s22p63s23p64s1. У калия 5 свободных 3d-орбитали, т.к. на 3d у него нет ни одного электрона.
56.
Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?

78.
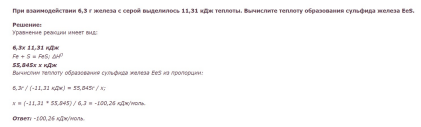
При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS.
Ответ: -100,26 кДж/моль.
84.
Реакция
горения ацетилена идет по уравнению
C2H2(г)+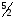 O2(г)
= 2 СO2(г)
+ Н2О(ж).
Вычислите G
O2(г)
= 2 СO2(г)
+ Н2О(ж).
Вычислите G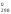 и S
и S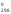 .
Объясните уменьшение энтропии в
результате этой реакции.
.
Объясните уменьшение энтропии в
результате этой реакции.
Ответ: -1235,15 кДж; -216,15 Дж/(мольּК).
РЕШЕНИЕ
C2H2(г) + 5/2O2(г) = 2CO2(г) + H2O(ж) ∆G°х.р. = 2*(-394,38) - 237,19 - 209,2 = -1235,15 кДж ∆S°х.р. = 2*213,65 + 69,94 - 200,82 - 5*205,03/2 = -216,16 Дж/моль*К Уменьшение в ходе реакции количества моль газообразных веществ всегда приводит к уменьшению энтропии в реакционной системе. До реакции было 3,5 моль газообразных веществ, после реакции 2 моль газообразных веществ.
119.
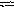
Почему при изменении давления смещается равновесие системы N2 + З Н2 2NH3 и не смещается равновесие системы
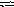 N2
+ О2
2NO?
Ответ мотивируйте на основании расчета
скорости прямой и обратной реакций в
этих системах до и после изменения
давления. Напишите выражения для констант
равновесия каждой из данных систем.
N2
+ О2
2NO?
Ответ мотивируйте на основании расчета
скорости прямой и обратной реакций в
этих системах до и после изменения
давления. Напишите выражения для констант
равновесия каждой из данных систем.
РЕШЕНИЕ
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот. В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3 Значит, при повышении давления равновесие смещается в сторону образования NH3, а при понижении давления равновесие смещается в сторону образования N2 и H2. Kр = [NH3]2/([N2]*[H2]3) А в реакции синтеза оксида азота (II) количество газов остается неизменным. N2 + О2 ↔ 2NO Значит, при повышении и при понижении давления в системе равновесие не смещается ни в сторону образования NO, ни в сторону образования N2 и О2. Kр = [NO]2/([N2]*[О2])
124.
Вычислите молярную концентрацию эквивалента и моляльную концентрацию 20,8%-ного раствора HNO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора?
Ответ: 3,70 н.; 4,17 М; 931,8 г.

РЕШЕНИЕ
Допустим у нас имеется 4 литра раствора, тогда:
m(р-ра) = 4000*1,12 = 4480 г
m(HNO3) = 4480*20,8/100 = 931,8 г
n(HNO3) = 931,8/63 = 14,8 моль
Cн.(HNO3) = 1*14,8/4 = 3,7 моль/л
Cm(HNO3) = 14,8/(4,48 - 0,93) = 4,17 моль/кг
142.
Вычислите массовую долю (%) водного раствора сахара C12H22O11, зная, что температура кристаллизации раствора - 0,93 °С. Криоскопическая константа воды 1,86.
Ответ: 14,6%.

161
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NаНСОз и NaOH; б) K2SiO3 и НС1; в) BaCl2 и Na2SO4.

184.
Рассчитайте рН раствора, полученного смешением 25 мл 0,5 М раствора HCl, 10мл 0,5 М раствора NaOH и 15 мл воды.
Ответ: 0,82.

214.
При смешивании растворов А12(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярные и молекулярное уравнения происходящего совместного гидролиза.
РЕШЕНИЕ
Al2(SO4)3 + 3Na2S + 6H2O → 3Na2SO4 + 2Al(OH)3↓ + 3H2S↑ 2Al3+ + 3SO42- + 6Na+ + 3S2- + 6H2O → 6Na+ + 3SO42- + 2Al(OH)3↓ + 3H2S↑ 2Al3+ + 3S2- + 6H2O → 2Al(OH)3↓ + 3H2S↑
234.
См. условие задачи 222.
К2Сr2О7 + HC1 ® Сl2 + СгС13 + KC1 + Н2O;
Au + HNО3 + HC1 ® AuС13 + NO + H2O.
222. Реакции выражаются схемами:
Р + НIO3 + Н2О Н3PO4 + НI;
H2S + Cl2 + H2O H2SО4 + НСl.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое— восстановителем; какое вещество окисляется, какое —восстанавливается.

![]()
243.
При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
Ответ: 0,30 моль/л.

268.
Электролиз раствора сульфата цинка проводили в течение
5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока.
Ответ: 5,74 А.

294.
Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, медь или висмут? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии?

314.
Какая масса CaSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 ммоль/л.
Ответ:108, 9г.
Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (моль/л) . М (CaSO4) = 136,14 г/моль; Мэкв (CaSO4) = 136,14 : 2 = 68,07 г/моль•экв. В 1 л воды жесткостью 8 ммоль содержится: 8 • 0,001 = 0,008 моль, или 0,008 • 68,07 = 0,5445 г CaS04. В 200 л воды жесткостью 8 ммоль содержится: 0,5445 • 200 = 108,9 г CaS04.
Решение:
|
Дано: |
|
V(H2O) = 200 л |
|
Ж = 8 мэкв = 8∙10-3 моль/л |
|
Найти: |
|
m(СаSO4) = ? |
|
Решение: |
Жесткость
воды обуславливается присутствием
солей кальция и магния и определяется
по формуле:
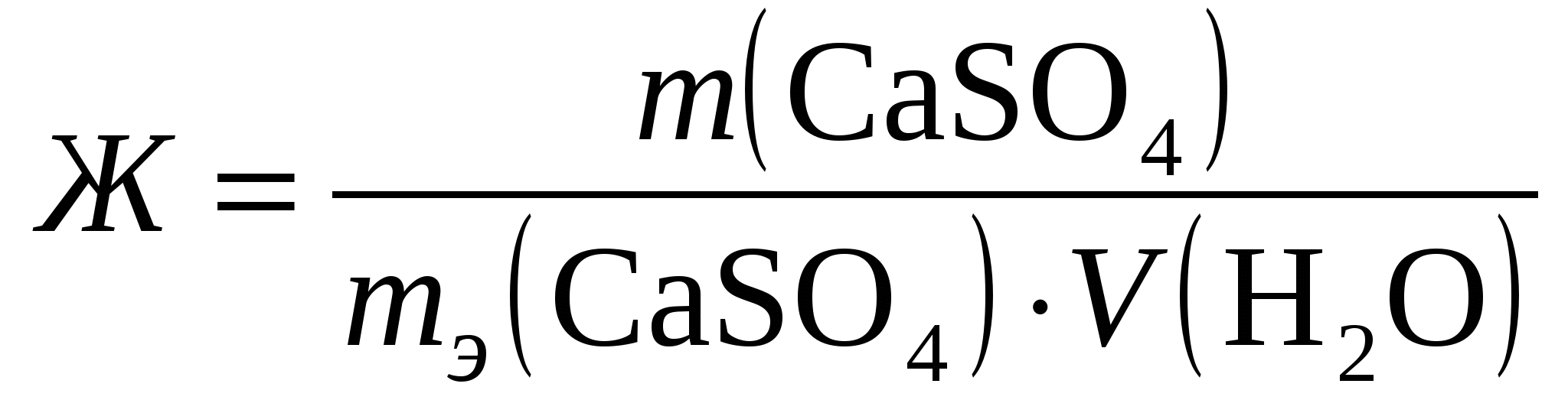 М(СaSO4)
= 40 + 32 + 16*4 = 136 г/моль
mэ(СaSO4)
= ½∙М(СaSO4)
= ½∙136 = 68 г/моль
Отсюда:
М(СaSO4)
= 40 + 32 + 16*4 = 136 г/моль
mэ(СaSO4)
= ½∙М(СaSO4)
= ½∙136 = 68 г/моль
Отсюда:
![]() =
8∙10-3 ∙68
∙200 = 108,9 г
=
8∙10-3 ∙68
∙200 = 108,9 г
