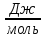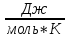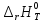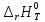- •Оглавление
- •Вариант №10а
- •Термодинамические свойства веществ реакции
- •Расчет изменения теплоемкости в ходе химической реакции
- •Расчет и построение графической зависимости стандартного теплового эффекта реакции от температуры
- •Расчет зависимости константы равновесия от температуры
- •Расчет изменений стандартной энергии Гиббса и стандартной энтропии реакции
- •Расчет парциальных давлений компонентов при заданном начальном составе смеси
- •Определение направления процесса при заданных условиях
- •Определение влияния давления на смещение равновесия
- •Определение равновесных парциальных давлений

МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«МИРЭА – Российский технологический университет»
РТУ МИРЭА
|
|
Институт тонких химических технологий им. М.В. Ломоносова |
|
(наименование Института)
|
|
Кафедра физической химии им. Я.К. Сыркина |
|
(наименование кафедры)
Домашнее задание на тему:
«РАСЧЕТ ХИМИЧЕСКОГО РАВНОВЕСИЯ»
Работу выполнила
Студентка группы ХББО-02-16
Иванова Елена Анатольевна
Руководитель работы
Зобнина Аэлита Николаевна
Москва, 2018
Оглавление
I.Термодинамические свойства веществ реакции 3
II.Расчет стандартного теплового эффекта реакции при Т=298 К 3
III.Расчет изменения теплоемкости в ходе химической реакции 3
IV.Расчет и построение графической зависимости стандартного теплового эффекта реакции от температуры 4
V.Расчет изменения стандартной энтропии реакции при Т=298 К 6
VI.Расчет изменения стандартной энергии Гиббса при Т=298 К 6
VII.Расчет констант равновесия при р=1 атм и Т=298 К 8
VIII.Расчет зависимости константы равновесия от температуры 8
IX.Расчет изменений стандартной энергии Гиббса и стандартной энтропии реакции 10
X.Расчет парциальных давлений компонентов при заданном начальном составе смеси 11
XI.Определение направления процесса при заданных условиях 13
XII.Определение влияния давления на смещение равновесия 13
XIII.Определение равновесных парциальных давлений 13
Выводы 16
Вариант №10а
Условия расчета
|
Реакция |
ΔT, K |
T, K |
P(общ), атм |
n1, моль |
n2, моль |
n3, моль |
n4, моль |
M |
|
C3H8 = 4H2 + 3Cгр |
300-700 |
500 |
10 |
0,01 |
1,5 |
- |
- |
0,2 |
-
Термодинамические свойства веществ реакции
Таблица №1
|
В-во |
Δf |
|
С◦p,298,
|
Коэффициент уравнения Ср=f(T) |
Интервал |
||||
|
a |
b*103 |
cꞌ*10-5 |
c*106 |
ΔT, K |
|||||
|
C3H8 |
-103,85 |
269,91 |
73,51 |
1,72 |
270,75 |
- |
-94,48 |
298-1000 |
|
|
H2 |
0 |
130,52 |
28,83 |
27,28 |
3,26 |
0,50 |
- |
298-1000 |
|
|
Cгр |
0 |
5,74 |
8,54 |
16,86 |
4,77 |
-8,54 |
- |
298-2500 |
|
-
Расчет стандартного теплового эффекта реакции при Т=298 К
На основании первого следствия из закона Гесса
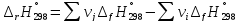
получим:
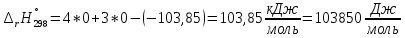
Полученный результат
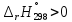 показывает, что реакция эндотермическая,
следовательно, по принципу Ле-Шателье
повышение
температуры
в реакции будет способствовать образованию
продуктов.
показывает, что реакция эндотермическая,
следовательно, по принципу Ле-Шателье
повышение
температуры
в реакции будет способствовать образованию
продуктов.
-
Расчет изменения теплоемкости в ходе химической реакции

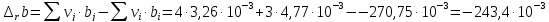
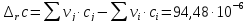
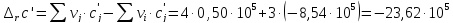

-
Расчет и построение графической зависимости стандартного теплового эффекта реакции от температуры
Согласно закону Кирхгоффа:
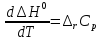
В случае II
приближения
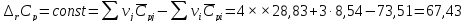
При определенном интегрировании уравнения Кирхгоффа (298<T<T1) получаем:
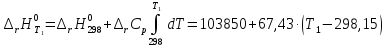
Рассмотрим интервал температур 300<T<700 с шагом в 50 К:
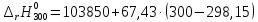 =103974,75
=103974,75
 =107346,25
=107346,25
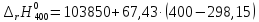 =110717,75
=110717,75
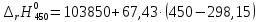 =114089,25
=114089,25
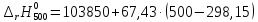 =117460,75
=117460,75
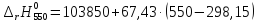 =120832,25
=120832,25
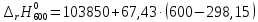 =124203,75
=124203,75
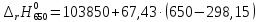 =127575,25
=127575,25
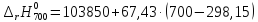 =130946,75
=130946,75
В случае III
приближения
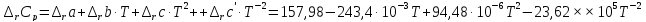
При неопределенном интегрировании уравнения Кирхгоффа получаем:
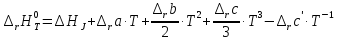
Из
данного уравнения необходимо найти
константу интегрирования
 .
Для этого примем T=298,15
К:
.
Для этого примем T=298,15
К:
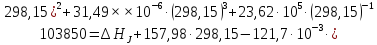
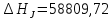
Следовательно,
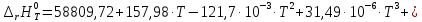
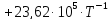
Рассмотрим снова интервал температур 300<T<700 с шагом в 50 К:
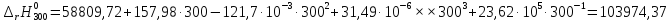
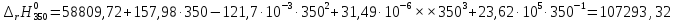
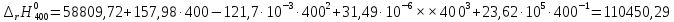
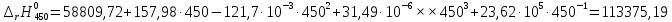

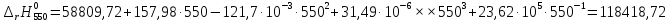

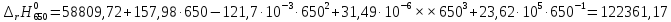
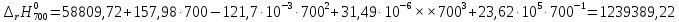
Полученные
результаты заносим в таблицу и строим
график

Таблица №2
|
T,K |
(II приближение) |
(III приближение) |
|
298,15 |
103850 |
103850 |
|
300 |
103974,75 |
103974,37 |
|
350 |
107346,25 |
107293,32 |
|
400 |
110717,75 |
110450,29 |
|
450 |
114089,25 |
113375,19 |
|
500 |
117460,75 |
116035,39 |
|
550 |
120832,25 |
118418,72 |
|
600 |
124203,75 |
120524,95 |
|
650 |
127575,25 |
122361,17 |
|
700 |
130946,75 |
123939,22 |
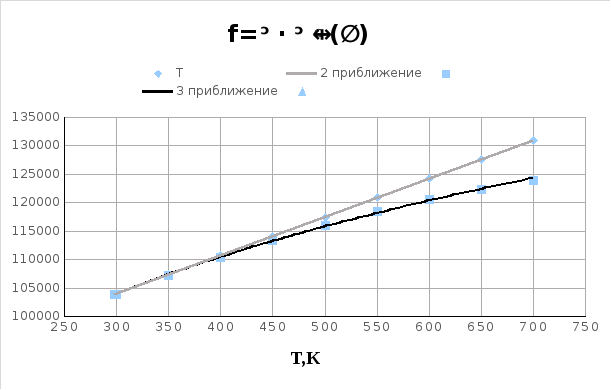
График 1. Зависимость стандартного теплового эффекта данной реакции от температуры
-
Расчет изменения стандартной энтропии реакции при Т=298 К
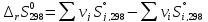
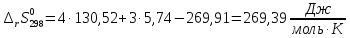
Энтропия – функция, характеризующая «порядок» в системе: чем больше значение энтропии, тем больше в системе «беспорядок». В данном случае при протекании реакции энтропия значительно возросла.
-
Расчет изменения стандартной энергии Гиббса при Т=298 К

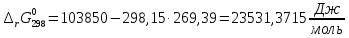
Энергия Гиббса
является одним из критериев самопроизвольного
протекания процесса. Т.к.
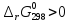 следует, что при Т=298 К данная реакция
не может идти
в сторону образования продуктов
самопроизвольно.
следует, что при Т=298 К данная реакция
не может идти
в сторону образования продуктов
самопроизвольно.
-
Расчет констант равновесия при р=1 атм и Т=298 К
Из уравнения
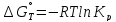
найдем значения lnKp,298, Kp,298 и Кс при T=298,15 К:
-
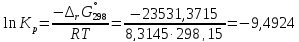
-
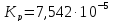
-
Т.к. Kp=Kc(RT)Δν, где Δν=∑νj - ∑νi = 4-1=3, то
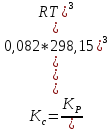
Так как
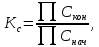 следует,
что при увеличении
молярных концентраций конечных
газообразных продуктов
при заданных p
и T
константы равновесия
Kc
и Kp
возрастают, увеличивается изменение
энергии Гиббса, что приводит к
смещению равновесия в сторону реагентов
(чем большее ΔG,
тем сильнее равновесие смещается в
сторону реагентов).
следует,
что при увеличении
молярных концентраций конечных
газообразных продуктов
при заданных p
и T
константы равновесия
Kc
и Kp
возрастают, увеличивается изменение
энергии Гиббса, что приводит к
смещению равновесия в сторону реагентов
(чем большее ΔG,
тем сильнее равновесие смещается в
сторону реагентов).

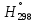 ,
,
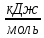
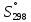 ,
,