
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Фактори, що визначають напрямок хімічних реакцій.
У природі існує багато екзотермічних процесів: згорання палива, реакція нейтралізації, процеси кристалізації, біохімічні процеси тощо. Звідси виник принцип Бертло – Томсена, відповідно до якого самі по собі (спонтанно) протікають тільки ті процеси, при яких ентальпія системи зменшується.
Але відомо також багато спонтанних процесів: випарювання рідин, розчинність у воді таких речовин як KCl, KNO3, розширення газів, то що. Тому екзотермічність процесу не може бути єдиним фактором, що визначає можливість його протікання: це залежить також від стану внутрішньої структури системи. В самій природі речовини внаслідок руху її електронів, атомних ядер атомів, молекул закладено прагнення до переходу із стану з більшим упорядкуванням до менш упорядкованого стану. Так, при розчиненні твердої речовини відбувається спонтанний перехід від більш упорядкованого стану кристалічної решітки у менш упорядкований рідкий стан; випаровування рідин теж супроводжується зменшенням упорядкування частинок у системі.
Мірою безладдя, невпорядкованості системи є ентропія (S). Вона відбиває стан внутрішньої структури речовини у зв’язку з тепловим рухом її частинок. Ентропія зростає із збільшенням рухливості частинок при нагріванні, випаровуванні, плавленні, розчиненні, розширенні газу, при послабленні або розриві хімічних зв’язків між атомами тощо.
Процеси, що пов’язані з упорядкуванням системи: конденсація, кристалізація, стиснення, зміцнення зв’язків, полімеризація тощо – приводять до зменшення ентропії.
Ентропія – це статистичне поняття і має одиниці розміру енергетичні – Дж/(моль·К) або в ентропійних одиницях (е.о.): 1е.о.= 1 Дж/(моль·К). Ентропію, що визначена для стандартних умов (температура 298К; р= 101,33 кПа) обозначають S0298, або S0; називають стандартною ентропією. У відповідності із наслідком із закону Гесса зміну ентропії (ΔS) можна підрахувати за рівнянням:
ΔSХ.Р.
=
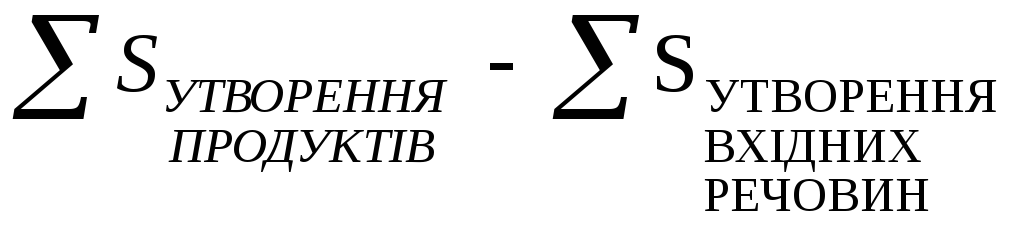 (6)
(6)
Отож на напрямок протікання процесу (в тому числі і хімічного) впливають дві протилежні тенденції, що закладені природою: з одного боку, частинки прямують до упорядкування (що веде до зменшення внутрішньої енергії і ентальпії системи); з другого боку – прямують до більш імовірного, максимально хаотичного стану, тобто до збільшення ентропії. Сумарний ефект цих двох протилежних тенденцій відбивається в термодинамічній функції, що називається ізобарно – ізотермічним потенціалом (або вільною енергією Гібса): позначається ΔG0298 або ΔG0; її розмірність: Дж/моль. Для простих речовин ΔG0 утворення умовно взята за нуль (як і ΔН0).
Взаємозв’язок між вільною енергією Гібса, ентальпією і ентропією системи відбивається у рівнянні:
ΔG = ΔН - Т ΔS = - А MAX (7)
де: ΔG – зміна ізобарного потенціалу системи під час процесу;
ΔН – зміна ентальпії;
ΔS – зміна ентропії;
Т – температура за шкалою Кельвіна;
А MAX – максимальна робота системи під час процесу.
Дане рівняння є найважливішим в хімічній термодинаміці. З нього визначається з яких причин імовірна дана реакція: в одних випадках процесу сприяють і тепловий ефект і зміна ентропії, в других – процес йде завдяки екзотермічності реакції, в третіх – реакція можлива завдяки збільшенню ентропії. У всіх випадках, коли процес має місце, ΔG<0. Якщо ΔS>0, то реакції сприяють великі температури; в протилежному випадку (ΔS<0) імовірність реакції зростає при зниженні температури. Якщо ΔG>0, то реакція у даних умовах неможлива.
Розрахувати значення ΔG можна як з рівняння (7) так і з наслідку з закону Гесса:
ΔGХ.Р.
=
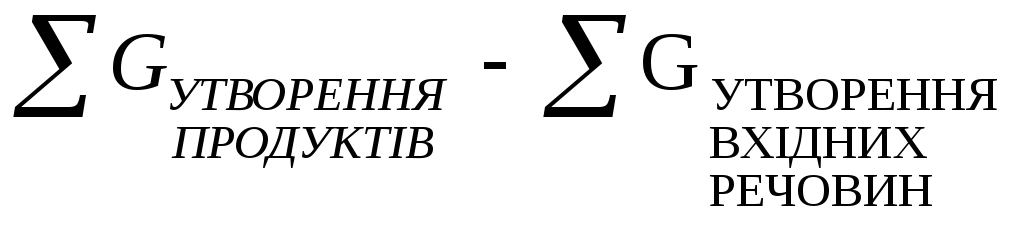 (8)
(8)
Відповідні ΔG утворення речовин беруть з довідників.
У випадку, коли ΔG = 0 (це означає, що в рівнянні (7) ׀ΔН׀ =׀Т ΔS׀) система знаходиться у стані термодинамічної рівноваги. Такий стан спостерігається у фазових переходах (при плавленні, кристалізації, випаровуванні, конденсації тощо). З рівняння (7) маємо:
ΔG = ΔН - Т ΔS = 0 ;
ΔН = Т ΔS (9)
ΔS
=
![]() (10)
(10)
Застосовуючи рівняння (10) до фазових перетворень маємо:
ΔS =
=
![]() (11)
(11)
З рівняння (11) видно, що зміну ентропії в умовах фазових перетворень можна підрахувати, якщо визначити теплоту і температуру цих процесів.
Отож розрахунки термодинамічних характеристик системи ΔН, ΔS, ΔG дають можливість визначити імовірність протікання хімічної реакції і вплив на неї температури. Всі означені характеристики є функціями стану системи, тобто не залежать від кількості стадій в даному процесі, а визначаються тільки початковим і кінцевим станом речовин. Тому для їх розрахунків застосовуються однакові за формою рівняння (5), (6), (8).
