
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Контрольні питання
-
Дією яких сполук на: а) Нітроген, б) сіль амонію, в) нітратну кислоту, г) нітрид Алюмінію можливо отримати аміак? Написати відповідні реакції.
-
Скласти рівняння гідролізу NH4NO3, NaNO2, NH4NO2, NaNO3. Яка з сполук гідролізу не підлягає?
-
Написати емпіричні та графічні формули кислот: а) фосфорної і пірофосфорної, б) фосфористої і фосфорноватистої, враховуючи, що перша – двохосновна, а друга – одноосновна.
-
Здійсніть перетворення:
Ca3(PO4)2 → P → P2O5 → HPO3 → H3PO4 → H4P2O7
-
Які сполуки Нітрогену, фосфору використовуються у якості мінеральних добрив?
-
У вигляді яких іонів Нітроген потрапляє до рослин?
-
Чому суперфосфат не повністю розчиняється у воді?
-
Суперфосфат не можна змішувати з вапном. Чому? Відповідь підтвердить рівнянням реакції.
-
Чому фосфорити як добрива використовують лише для кислих ґрунтів?
-
Назвіть, які добрива називають комплексними?
Задачі
-
Суміш двох газів NO і NO2 в об'ємі 140 мл була змішана з 120 мл Оксигену. Після реакції в суміші газів знайдено 80 мл Оксигену. Визначити масові частки NO і NO2 в суміші у відсотках.
-
Визначити масу 70%-го розчину сірчаної кислоти, яка необхідна для отримання суперфосфату з 50 кг фосфориту, що містить 35% P2O5?
-
Скільки аміаку та 45% нітратної кислоти необхідно для отримання 1 т нітрату амонію, якщо прийняти, що у виробничих умовах втрати аміаку складають 2,5 кг, а нітратної кислоти (в перерахунку на 100%) 7,5 кг на 1 т нітрату?
-
При середньому врожаю пшениці за один сезон виноситься з 1 га до 75 кг Нітрогену. Скільки нітрату амонію може покрити таку втрату, якщо врахувати, що близько 20% Нітрогену, необхідного для живлення рослин, повертається до ґрунту в результаті природних процесів?
-
Розрахуйте вміст Нітрогену (%) в сечовині (карбамід) (NH2)2CO та порівняйте з вмістом Нітрогену в добривах складу: КNO3, NaNO3, NH4NO3, (NH4)2SO4.
Лабораторна робота №12.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА р-ЕЛЕМЕНТІВ
(VI-А та VII-А підгруп)
Мета роботи – ознайомити студентів з найбільш важливими фізичними та хімічними властивостями р-елементів, а також із застосуванням їх важливіших сполук.
ТЕОРЕТИЧНА ЧАСТИНА
ХАЛЬКОГЕНИ
До елементів VІ А групи належать Оксиген, Сульфур, селен, телур та радіоактивний полоній. Групова назва цих елементів - халькогени, тобто "що народжують мідні руди", обумовлено тим, що у природі вони зустрічаються частіше у вигляді сполук Купруму (сульфідів, оксидів, селенідів). Атоми халькогенів мають електронну конфігурацію s2p4 з двома неспареними р-електронами.
-
R (A)
I1, эВ
Еа, эВ
Ступені окислення
O
0.60
13.6
1.467
-1, -2
S
0.90
10.4
2.077
-2, 0, +2,+4,+6
Se
1.16
9.75
2.02
-“-
Te
1.35
9.1
2.0
-“-
Po
1.64
8.43
0, +2, +4
При переході від Оксигену до полонію розмір атомів та їх можливі координаційні числа зростають, а енергія іонізації (Еіон) та електронегативність зменшуються. В сполуках Сульфуру, селену, телуру з Оксигеном і галогенами реалізуються ступені окислення +6, +4 і +2. З більшістю інших елементів вони утворюють халькогеніди, де находяться в ступені окислення -2. Стійкість сполук з вищим ступенем окислення зменшується від телуру до полонію. В сполуках з негативними ступенями окислення від Сульфуру до телуру зростають відновні, а в сполуках з позитивними ступенями окислення – окисні властивості.
Одне з характерних властивостей атомів халькогенів - їх здатність зв’язуватися один з одним у кільця та ланцюги. Це явище називають катенацією, яка яскраво спостерігається у Сульфуру, селену и телуру. Для них відомі багаточислені лінійні та циклічні молекулярні форми, утворені ланцюгами. З катенацією зв’язані алотропія і поліморфізм простих речовин.
В ідомо
декілька поліморфних модифікацій
Сульфуру: ромбічна (<960С),
моноклінна (96-1190С),
пластична. Остання нестійка і при
зберіганні поступово переходить до
ромбічної модифікації. Алотропія
Сульфуру обумовлена не різним числом
атомів в молекулі, як у Оксигену, а різною
будовою восьмиатомних молекул. По мірі
нагрівання кільця розриваються і
утворюються молекули з відкритим
ланцюгом атомів.
ідомо
декілька поліморфних модифікацій
Сульфуру: ромбічна (<960С),
моноклінна (96-1190С),
пластична. Остання нестійка і при
зберіганні поступово переходить до
ромбічної модифікації. Алотропія
Сульфуру обумовлена не різним числом
атомів в молекулі, як у Оксигену, а різною
будовою восьмиатомних молекул. По мірі
нагрівання кільця розриваються і
утворюються молекули з відкритим
ланцюгом атомів.
Стабільність водневих сполук халькогенів зменшується в групі. Сірководень можливо отримати як і решту халькогеноводнів за реакцією: FeЭ + H2SO4 ® FeSO4 + Н2Э
Халькогеноводні – слабкі кислоти, сила яких зростає у групі. Вони виявляють відновні властивості. Сірководень горить на повітрі:
H2S + O2® H2O + SO2
Сірководень утворює кислі та середні солі. Більшість сульфідів нерозчинні у воді за виключенням сульфідів лужних металів та амонію.
Сульфур реагує з флуором: S + F2 ® SF6; (SF4 , S2F10). З Хлором утворюються лише низькі хлориди і оксихлориди: S2Cl2, SCl2. Селен та телур утворюють ЭГ4 - галогенангідриди, які з солями лужних металів утворюють комплекси K[SeF5], K2[SeCl6], Cs2[TeI6].
Оксид Сульфуру (ІV) отримують в лабораторіях за реакцією:
Na2SO3 + 2HCl = SO2 + 2NaCl + H2O
При розчиненні утворює сірчисту кислоту (Н2SO3). Вона нестійка, існує лише у водних розчинах, утворює солі – гідросільфіти і сульфіти. Сірчиста кислота досить активний відновник, який окислюється у розчинах Хлору, перманганату, біхромату Калію. В результаті окислення утворюється сірчана кислота. Проте, при взаємодії з більш активними відновниками виявляє окисні властивості.
Н2SO3 + 2Н2S = 3S + 3H2O
Оксид Сульфуру (VІ) жадібно з’єднуються з водою, розчиняючись утворює сірчану кислоту (Н2SO4). Пари триоксиду Сульфуру не можуть безпосередньо поглинатися водою в наслідок високого парціального тиску останньої і утворює туман, який не конденсується. Проте, пари SO3 повністю поглинаються концентрованою сірчаною кислотою. Оксид Сульфуру (VІ) та сірчана кислота сильні окисники. З розведеної кислоти, метали, що стоять в ряду напруг до Гідрогену, витісняють Гідроген. Концентрована сірчана кислота при нагріванні окислює практично всі метали, відновлюючись до оксиду Сульфуру (ІV), або вільної Сульфуру чи сірководню.
Cu + 2H2SO4 = SO2 + CuSO4 + 2H2O
3Zn +4H2SO4 = S + 3ZnSO4 + 4H2O
4Zn +5H2SO4 = H2S + 4ZnSO4 + 4H2O
С![]() ірчана
кислота
утворює
нормальні
солі
– сульфати
та
кислі
солі
– гідросульфати.
ірчана
кислота
утворює
нормальні
солі
– сульфати
та
кислі
солі
– гідросульфати.
П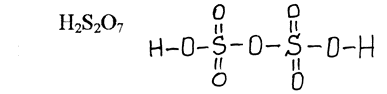 ри
умовному
заміщенні
в
сірчаній
кислоті
або
її
солях
одного
атома
Оксигену
на
атом
Сульфуру
утворюється
відповідно
тіосірчана
кислота
(H2S2O3)
та
її
солі
тіосульфати.
Останні
можуть
бути
отримані
кип’ятінням
розчинів
сульфітів
з
сіркою.
За
дії
сильних
окисників
(Хлору)
тіосульфати
окислюються
до
сірчаної
кислоти.
Сульфур
входить
до
складу
піросірчаної
кислоти
(H2S2O7),
яка
утворює
солі
– піросульфати
та
надсірчаної
кислоти
(H2S2O8),
яка
утворює
солі
– персульфати.
Над сірчана
кислота містить пероксидний ланцюг, що
обумовлює її сильні окисні властивості.
Солі піросірчаної та надсірчаної кислот
також є сильними окисниками.
ри
умовному
заміщенні
в
сірчаній
кислоті
або
її
солях
одного
атома
Оксигену
на
атом
Сульфуру
утворюється
відповідно
тіосірчана
кислота
(H2S2O3)
та
її
солі
тіосульфати.
Останні
можуть
бути
отримані
кип’ятінням
розчинів
сульфітів
з
сіркою.
За
дії
сильних
окисників
(Хлору)
тіосульфати
окислюються
до
сірчаної
кислоти.
Сульфур
входить
до
складу
піросірчаної
кислоти
(H2S2O7),
яка
утворює
солі
– піросульфати
та
надсірчаної
кислоти
(H2S2O8),
яка
утворює
солі
– персульфати.
Над сірчана
кислота містить пероксидний ланцюг, що
обумовлює її сильні окисні властивості.
Солі піросірчаної та надсірчаної кислот
також є сильними окисниками.
